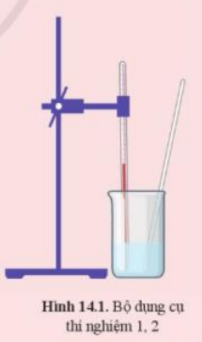
Bài 14. Phản ứng hóa học và enthalpy trang 77, 78, 79, 80, 81 Hóa 10 Cánh diềuCho các phản ứng sau: (1) Phản ứng nung vôi: CaCO3 → CaO + CO2 (2) Phản ứng than cháy trong không khí: C + O2 → CO2 Thực hiện hai thí nghiệm dưới đây: Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 77 MĐ
Phương pháp giải: Phản ứng giải phóng năng lượng dưới dạng nhiệt (phản ứng tỏa nhiệt): phản ứng đốt cháy nhiên liệu, phản ứng tạo gỉ sắt, phản ứng oxi hóa glucose trong cơ thể, ... Phản ứng hấp thụ năng lượng dưới dạng nhiệt (phản ứng thu nhiệt): phản ứng trong lò nung vôi, nung clinker xi măng, … Lời giải chi tiết: (1) Phản ứng thu nhiệt. (2) Phản ứng tỏa nhiệt. CH tr 77 TH
Phương pháp giải: - Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt - Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt Lời giải chi tiết: Thí nghiệm 1: 2HCl + MgO → MgCl2 + H2O => Cốc thí nghiệm nguội dần ( HCl ban đầu hơi ấm) => Phản ứng thu nhiệt. Thí nghiệm 2: CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O => Cốc thí nghiệm nóng lên => Phản ứng tỏa nhiệt. CH tr 78 CH
Phương pháp giải: Phản ứng tỏa nhiệt: là phản ứng hóa học thường kèm theo sự giải phóng hoặc hấp thụ năng lượng dưới dạng nhiệt. Phản ứng thu nhiệt: là phản ứng hóa học có sự cung cấp nhiệt cho phản ứng Lời giải chi tiết: - Để nhận biết phản ứng tỏa nhiệt: Ta cảm nhận hoặc đo được nhiệt độ xung quanh phản ứng thí nghiệm đó tăng lên . Hoặc phản ứng không cần cung cấp nhiệt trong suốt quá trình xảy ra phản ứng - Để nhận biết phản ứng thu nhiệt: Ta cần phải cung cấp nhiệt trong suốt quá trình xảy ra phản ứng thì phản ứng mới diễn ra CH tr 78 VD
Phương pháp giải: Phản ứng giải phóng năng lượng dưới dạng nhiệt (phản ứng tỏa nhiệt): phản ứng đốt cháy nhiên liệu, phản ứng tạo gỉ sắt, phản ứng oxi hóa glucose trong cơ thể, ... Phản ứng hấp thụ năng lượng dưới dạng nhiệt (phản ứng thu nhiệt): phản ứng trong lò nung vôi, nung clinker xi măng, … Lời giải chi tiết: a) NH4Cl(s) → HCl(g) + NH3(g) => Phản ứng cần cung cấp nhiệt trong suốt quá trình phản ứng => Phản ứng thu nhiệt. b) C2H5OH + O2 → CO2 + H2O => Phản ứng chỉ cần cung cấp nhiệt vào thời điểm ban đầu và có tỏa nhiệt trong quá trình phản ứng => Phản ứng tỏa nhiệt. c) Collagen → gelatin => Phản ứng cần cung cấp nhiệt trong suốt quá trình phản ứng (hầm) =>Phản ứng tỏa nhiệt. CH tr 78 VD
Phương pháp giải: - Phản ứng tỏa nhiệt: phản ứng giải phóng năng lượng dưới dạng nhiệt - Phản ứng thu nhiệt: phản ứng hấp thụ năng lượng dưới dạng nhiệt
Lời giải chi tiết: Phản ứng tỏa nhiệt: Sulfuric acid (H2SO4) + Đường, Xăng cháy trong không khí, Củi cháy trong không khí, Phản ứng tạo gỉ sắt, Nến cháy trong không khí … Phản ứng thu nhiệt: Băng tan, Nước lỏng bay hơi, Luộc trứng, Nấu canh, Nung gốm… CH tr 79 CH
Phương pháp giải: Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn. Lời giải chi tiết: Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) không được coi là nhiệt tạo thành chuẩn của Na2O(s) vì oxygen dạng phân tử O3 (ozone) không là dạng bền nhất. CH tr 79 CH
Phương pháp giải: ${\Delta _f}H_{298}^0$ giảm khi lượng chất tạo thành giảm. Lời giải chi tiết: 2Na(s) + ½ O2(g) → Na2O(s) ${\Delta _f}H_{298}^0 = - 417,98$kJ.mol-1 Na(s) + ¼ O2(g) → ½ Na2O(s) ${\Delta _f}H_{298}^0 = \frac{{ - 417,98}}{2} = 208,99$kJ.mol-1 CH tr 79 CH
Phương pháp giải: Đơn chất bền: tồn tại sẵn trong điều kiện chuẩn, không cần phản ứng nào để tạo thành Lời giải chi tiết: - Enthalpy tạo thành chuẩn của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn => Đơn chất bền, không cần phản ứng nào từ đơn chất để tạo thành => Enthalpy tạo thành của một đơn chất bền bằng 0 CH tr 80 CH
Phương pháp giải: Dựa vào ví dụ (1) trang 80: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ${\Delta _r}H_{298}^0 = - 890,36kJ$ ${\Delta _r}H_{298}^0$tỉ lệ thuận với lượng chất tham gia và sản phẩm Lời giải chi tiết: ½ CH4(g) + O2(g) → ½ CO2(g) + H2O(l) ${\Delta _r}H_{298}^0 = \frac{{ - 890,36}}{2} = - 445,18kJ$ CH tr 80 LT
Phương pháp giải: ${\Delta _r}H_{298}^0$ tỉ lệ thuận với lượng chất tham gia và sản phẩm Lời giải chi tiết: nC2H2 = 1/26 (mol) Đốt cháy 1/26 mol C2H2 tỏa ra 49,98 kJ => Đốt cháy 1 mol C2H2 tỏa ra x kJ => x = 1 x 49,98 : (1/26) = 1299,48 kJ => ${\Delta _r}H_{298}^0$ = -1299,48 kJ (vì đây là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm) CH tr 80 LT
Phương pháp giải: Khi đốt cháy 1 mol CH4 tỏa ra 890,36 kJ Để tạo thành 1 mol CaO bằng cách nung CaCO3 cần 178,29kJ Lời giải chi tiết: - Khi đốt cháy 1 mol CH4 tỏa ra 890,36 kJ - Để tạo thành 1 mol CaO bằng cách nung CaCO3 cần 178,29kJ => Số mol CH4 cần dùng để đốt cháy là: 178,29 : 890,36 = 0,2 mol => Số gam CH4 cần dùng để đốt cháy là: 0,2 x 16 = 3,2 (gam) CH tr 80 VD
Phương pháp giải: Sự oxi hóa chất béo, chất đường, tinh bột...trong cơ thể con người giúp giải phóng năng lượng, cung cấp năng lượng cho các hoạt động Lời giải chi tiết: - Sự hô hấp cung cấp oxygen cho các phản ứng oxi hóa chất béo, chất đường, tinh bột,... trong cơ thể con người đó là các phản ứng giải phóng năng lượng - Năng lượng kèm theo các phản ứng dùng để cung cấp năng lượng cho các hoạt động Bài tập 1
Phương pháp giải: Phản ứng cần cung cấp năng lượng trong quá trình phản ứng là phản ứng thu nhiệt Lời giải chi tiết: (a): Không cần cung cấp nhiệt (b): Không cần cung cấp nhiệt (c): Cần cung cấp nhiệt để nhiệt phân (d): Chi cần nhiệt lúc khơi mào phản ứng => Phản ứng (c) là phản ứng cần cung cấp năng lượng trong quá trình phản ứng Đáp án C Bài tập 2
Phương pháp giải: - Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt - Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt Lời giải chi tiết: - Phản ứng khi xảy ra làm nóng môi trường xung quanh => Phản ứng giải phóng năng lượng dưới dạng nhiệt => Phản ứng tỏa nhiệt - Phản ứng khi xảy ra làm lạnh môi trường xung quanh => Phản ứng hấp thụ năng lượng dưới dạng nhiệt => Phản ứng thu nhiệt Bài tập 3
Phương pháp giải: Khi phản ứng thu nhiệt thì ${\Delta _t},H_{298}^o$ > 0 Lời giải chi tiết: Ta có: ${\Delta _t},H_{298}^o$ > 0 => Đây là phản ứng thu nhiệt => Phản ứng sẽ hấp thụ năng lượng dưới dạng nhiệt => Nhiệt độ của hỗn hợp giảm Bài tập 4
Phương pháp giải: - Enthalpy tạo thành chuẩn của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn - Phản ứng tỏa nhiệt thì enthalpy mang giá trị âm Lời giải chi tiết: A. Sai vì đó là nhiệt tạo thành của 2 mol HCl B. Đúng vì (*) là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm C. Đúng vì nhiệt tạo thành tỉ lệ với số mol chất tạo thành, đây là phản ứng tỏa nhiệt nên mang giá trị âm D. Sai vì phản ứng (*) ứng với 2 mol => Đáp án B, C đúng
|




















Danh sách bình luận