Lý thuyết bài 1: Nguyên tử - KHTN 7 Cánh DiềuNguyên tử được cấu tạo từ ba loại hạt cơ bản: proton, neutron, electron Quảng cáo
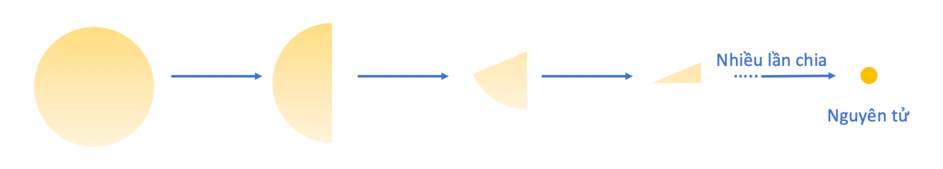
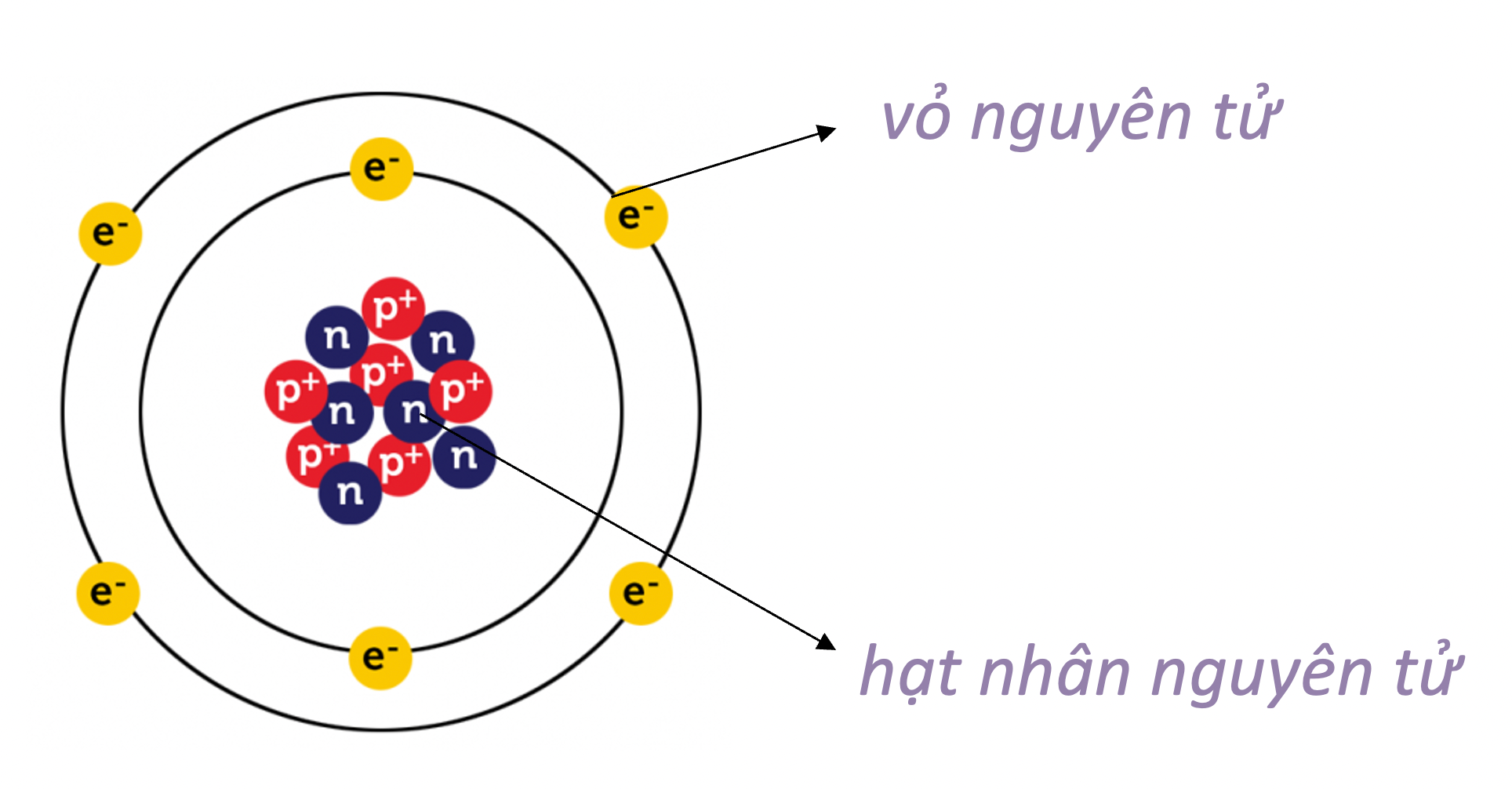
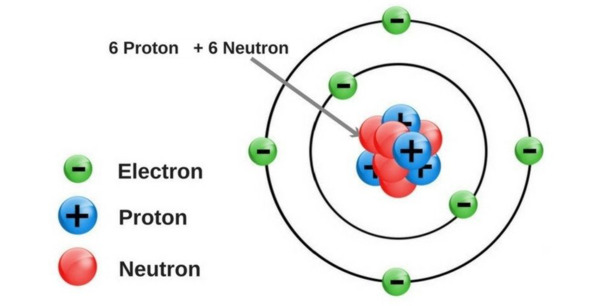
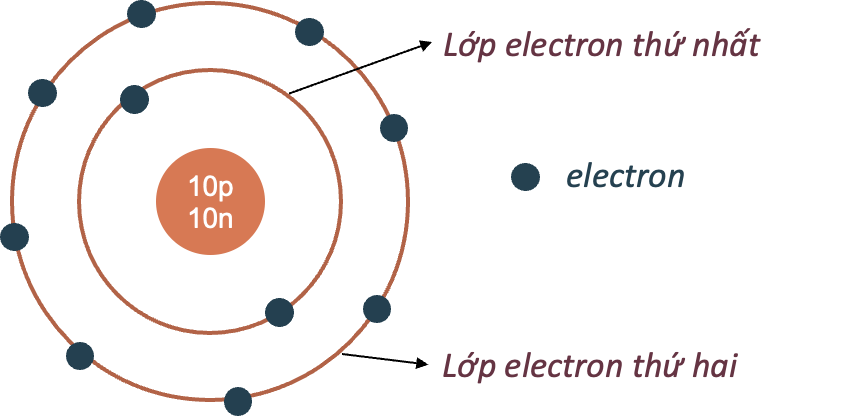
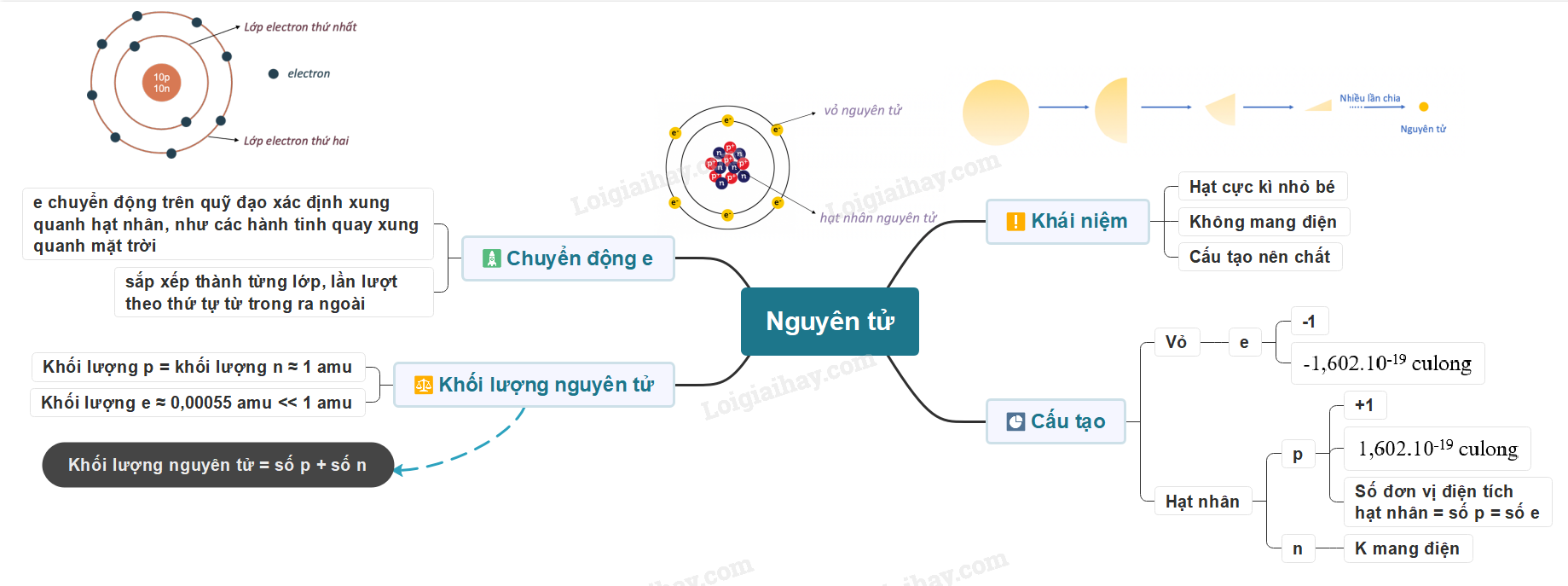
Lý thuyết: Nguyên tử I. Nguyên tử là gì? - Các nhà khoa học đã tìm thấy hàng chục triệu chất khác nhau. Tuy nhiên khi phân tích cấu tạo của các chất đó, người ta thấy rằng chúng đều được tạo thành từ nguyên tử Ví dụ: Khi phân chia đồng tiền vàng đến khi không thể chia được nữa sẽ thu được nguyên tử Khái niệm: Nguyên tử là những hạt cực kì nhỏ bé, không mang điện, cấu tạo nên chất Ví dụ + Đường saccarose được cấu tạo từ nguyên tử carbon, oxygen và hydrogen + Kim cương, than chì đều được cấu tạo từ nguyên tử carbon II. Cấu tạo nguyên tử - Nguyên tử được coi như một quả cầu, bao gồm vỏ nguyên tử và hạt nhân nguyên tử 1. Vỏ nguyên tử - Vỏ nguyên tử được tạo bởi một hay nhiều electron chuyển động xung quanh hạt nhân - Electron + Khí hiệu: e + Mang điện tích âm + Giá trị điện tích bằng một điện tích nguyên tố (1,602.10-19 culong), viết gọn là -1 2. Hạt nhân nguyên tử - Hạt nhân nằm ở tâm, có kích thước rất nhỏ so với kích thước nguyên tử - Hạt nhân nguyên tử được tạo bởi các proton và neutron - Proton + Kí hiệu: p + Mang điện tích dương + Giá trị bằng một điện tích nguyên tố (1,602.10-19 culong), viết gọn là +1 - Neutron + Kí hiệu: n + Không mang điện tích - Điện tích của hạt nhân bằng tổng điện tích của các proton - Số đơn vị điện tích hạt nhân bằng số proton Ví dụ: Nguyên tử nitrogen có 7 proton, do đó nguyên tử nitrogen có điện tích hạt nhân là +7, số đơn vị điện tích hạt nhân là 7 Lưu ý: Khi biểu diễn điện tích hạt nhân của nguyên tử cần đi kèm dấu “+” - Trong nguyên tử, số electron bằng số proton Mô hình cấu tạo nguyên tử carbon Ví dụ 4: Nguyên tử carbon gồm hạt nhân có 6 proton, 6 neutron, và vỏ nguyên tử có 6 electron III. Sự chuyển động của electron trong nguyên tử - Theo mô hình của Rutherford – Bohr, trong nguyên tử, các electron chuyển động trên những quỹ đạo xác định xung quanh hạt nhân, như các hành tinh quay xung quanh mặt trời - Các electron được sắp xếp thành từng lớp, lần lượt theo thứ tự từ trong ra ngoài - Mỗi lớp có số electron tối đa xác định: + Lớp thứ nhất có 2 electron + Lớp thứ hai có 8 electron Mô hình nguyên tử Neon Ví dụ: Nguyên tử Neon có 10 electron, lớp thứ nhất có 2 electron, lớp thứ 2 có 8 electron. Ta nói số electron lớp ngoài cùng của nguyên tử Neon là 8 electron IV. Khối lượng nguyên tử - Nguyên tử có khối lượng rất nhỏ - Để biểu thị khối lượng nguyên tử, người ta dùng đơn vị khối lượng nguyên tử, kí hiệu là amu (atomic mass unit) 1 amu = 1,6605.10-24 gam - Khối lượng proton = khối lượng neutron ≈ 1 amu - Khối lượng electron ≈ 0,00055 amu << 1 amu - Khối lượng nguyên tử = khối lượng proton + khối lượng neutron + khối lượng electron ≈ khối lượng proton + khối lượng neutron = khối lượng hạt nhân Ví dụ: Nguyên tử oxygen có 8 proton và 8 neutron, vậy khối lượng của nguyên tử oxygen là 8.1 + 8.1 = 16 amu Khối lượng nguyên tử = khối lượng hạt nhân = số proton + số neutron (amu)
|






















Danh sách bình luận