Bài 16. Điện phân trang 54, 55, 56 SBT Hóa 12 Kết nối tri thứcIon kim loại nào sau đây bị điện phân trong dung dịch (với điện cực graphite)? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
16.1 Ion kim loại nào sau đây bị điện phân trong dung dịch (với điện cực graphite)? A. Na+. B. \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\). C. \({\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}\). D. \({{\rm{K}}^{\rm{ + }}}\). Phương pháp giải: Các kim loại đứng sau Al có khả năng bị điện phân trong dung dịch. Lời giải chi tiết: Cu2+ là kim loại yếu nên bị điện phân trong dung dịch. Đáp án B 16.2 Ion halide hầu như không bị điện phân trong dung dịch là A. \({\rm{B}}{{\rm{r}}^{\rm{ - }}}\). B. \({{\rm{I}}^{\rm{ - }}}\). C. \({{\rm{F}}^{\rm{ - }}}\). D. \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\). Phương pháp giải: Các halide hầu hết bị điện phân trong dung dịch trừ fluorine. Lời giải chi tiết: Đáp án C 16.3 Phương trình hóa học nào sau đây biểu diễn quá trình điều chế kim loại bằng Phương pháp điện phân nóng chảy? A. CaCl2 → Ca + Cl2. B. Fe2O3 + 3CO → 2Fe + 3CO2 C. Mg + CuSO4 → MgSO4 + Cu. D. 2NaCl + 2H2O → 2NaOH + H2 + Cl2 Phương pháp giải: Dựa vào các Phương pháp tách kim loại. Lời giải chi tiết: Phương pháp điện phân nóng chảy dùng để điện phân muối của một số kim loại mạnh: CaCl2 → Ca + Cl2. Đáp án A 16.4 Phương trình hóa học nào sau đây biểu diễn quá trình điều chế kim loại bằng Phương pháp điện phân dung dịch? A. 2Al2O3 → 4Al + 3O2. B. 2Al + Cr2O3 → Al2O3 + 2Cr. C. Zn + CuSO4 → ZnSO4 + Cu. D. CuCl2 → Cu + Cl2. Phương pháp giải: Phương pháp điện phân dung dịch dùng để điện phân dung dịch muối của một số kim loại trung bình và yếu: Fe, Cu, Zn, Ag,… Lời giải chi tiết: CuCl2 → Cu + Cl2. Là Phương pháp điện phân dung dịch để tách kim loại đồng. Đáp án D 16.5 Trong công nghiệp, quá trình điện phân dung dịch NaCl bão hòa (điện cực trơ, có màng ngăn xốp) tạo ra khí nào sau đây ở cathode? A. Hydrogen. B. Chlorine. C. Oxygen. D. Hydrogen chloride. Phương pháp giải: Cathode là điện cực âm, xảy ra quá trình khử các ion kim loại hoặc nước Anode là điện cực dương, xảy ra quá trình oxi hóa các ion phi kim, gốc acid không có oxygen hoặc nước. Lời giải chi tiết: Na+ là kim loại mạnh nên không bị điện phân, tại cathode xảy ra quá trình điện phân của nước tạo khí hydrogen: \(2{H_2}{\rm{O + 2e}} \to {H_2} + 2O{H^ - }\) Đáp án A 16.6 Khi điện phân dung dịch gồm NaCl 1 M và NaBr 1 M, quá trình oxi hóa đầu tiên xảy ra ở anode là A. 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e. B. 2\({\rm{C}}{{\rm{l}}^{\rm{ - }}}\)→ Cl2 + 2e. C. 2\({\rm{B}}{{\rm{r}}^{\rm{ - }}}\)→ Br2 + 2e. D. Na → \({\rm{N}}{{\rm{a}}^{\rm{ + }}}\) + 1e. Phương pháp giải: Na+ là kim loại mạnh nên không bị điện phân, tại cathode xảy ra quá trình điện phân của nước tạo khí hydrogen: \(2{H_2}{\rm{O + 2e}} \to {H_2} + 2O{H^ - }\) Tại anode xảy ra quá trình điện phân của Cl- Lời giải chi tiết: Quá trình oxi hóa xảy ra ở anode là: 2\({\rm{C}}{{\rm{l}}^{\rm{ - }}}\)→ Cl2 + 2e. 16.7 Trong quá trình điện phân dung dịch CuSO4 với anode bằng graphite, ở anode xảy ra quá trình A. 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e. B. 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e. C. \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\)+ 2e → Cu. D. Cu → \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\)+ 2e. Phương pháp giải: Anode là điện cực dương, xảy ra quá trình oxi hóa các ion phi kim, gốc acid không có oxygen hoặc nước. Lời giải chi tiết: Vì \(SO_4^{2 - }\)là gốc acid có oxygen nên không bị điện phân, thay vào đó nước bị điện phân theo phương trình: 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e. Đáp án B 16.8 Khi điện phân dung dịch gồm Cu(NO3)2 0,1 M và AgNO3 0,1 M, quá trình khử đầu tiên xảy ra ở cathode là A. \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\)+ 1e → Ag. B. \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\)+ 2e → Cu. C. 2H2O + 2e → H2 + 2\({\rm{O}}{{\rm{H}}^{\rm{ - }}}\). D. 2\({{\rm{H}}^{\rm{ + }}}\)+ 2e → H2. Phương pháp giải: Cathode là điện cực âm, xảy ra quá trình khử các ion kim loại hoặc nước Anode là điện cực dương, xảy ra quá trình oxi hóa các ion phi kim, gốc acid không có oxygen hoặc nước. Lời giải chi tiết: Ag+ có tính oxi hóa mạnh hơn Cu2+ nên bị điện phân trước: \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\)+ 1e → Ag. Đáp án A 16.9 Phản ứng hóa học chính xảy ra trong quá trình điện phân nóng chảy Al2O3 trong 3NaF.AlF3 là: A. 2AlF3 → 2Al + 3F2. B. 2NaF → Na + F2. C. 2H2O → 2H2 + O. D. 2Al2O3 → 4Al + 3O2. Phương pháp giải: Dựa vào Phương pháp điện phân nóng chảy. Lời giải chi tiết: 2Al2O3 → 4Al + 3O2. Đáp án D 16.10 Việc duy trì điện áp thấp (⁓ 5 V) trong quá trình điện phân nóng chảy Al2O3 trong 3NaF. AlF3 nhằm ngăn cản quá trình nào sau đây xảy ra ở cathode? A. \({\rm{A}}{{\rm{l}}^{{\rm{3 + }}}}\)+ 3e → Al. B. \({\rm{N}}{{\rm{a}}^{\rm{ + }}}\)+ 1e → Na. C. F2 + 2e → 2\({{\rm{F}}^{\rm{ - }}}\). D. O2 + 4e →O2-.
Phương pháp giải: Dựa vào Phương pháp điện phân nóng chảy. Lời giải chi tiết: Việc duy trì điện áp thấp để nhằm ngăn cản quá trình khử ion Na+: \({\rm{N}}{{\rm{a}}^{\rm{ + }}}\)+ 1e → Na. 16.11 Trong công nghiệp, Phương pháp điện phân dung dịch được sử dụng để sản xuất một lượng đáng kể kim loại nào sau đây? A. Zn. B. Al. C. Fe. D. Mg. Phương pháp giải: Dựa vào Phương pháp điện phân dung dịch. Lời giải chi tiết: Phương pháp điện phân dung dịch được sử dụng để sản xuất kim loại trung bình: Fe. Đáp án C 16.12 Trong công nghiệp, việc tinh chế đồng từ đồng thô được thực hiện bằng Phương pháp điện phân dung dịch với anode làm bằng A. graphite. B. platinum. C. thép. D. đồng thô. Phương pháp giải: Dựa vào Phương pháp điện phân dung dịch. Lời giải chi tiết: Trong công nghiệp, việc tinh chế đồng từ đồng thô được thực hiện bằng Phương pháp điện phân dung dịch với anode làm bằng đồng thô. Đáp án D 16.13 Điện phân dung dịch chất nào sau đây (dùng điện cực trơ), thu được dung dịch có khả năng làm quỳ tím chuyển sang màu đỏ? A. NaBr. B. NaCl. C. CuSO4. D. CuCl2. Phương pháp giải: Dựa vào Phương pháp điện phân dung dịch. Lời giải chi tiết: CuSO4 khi điện phân thu được dung dịch có khả năng làm quỳ tím chuyển sang màu đỏ, vì ion \(SO_4^{2 - }\)ở anode không bị điện phân, thay vào đó nước bị điện phân theo phương trình sau: \(2{H_2}{\rm{O}} \to 4{H^ + } + {O_2} + 4e\) Đáp án C 16.14 Điện phân dung dịch chất nào sau đây (với điện cực trơ, không có màng ngăn điện cực), thu được dung dịch có khả năng tẩy màu? A. CuSO4. B. NaCl. C. K2SO4. D. AgNO3. Phương pháp giải: Dựa vào Phương pháp điện phân dung dịch. Lời giải chi tiết: NaCl khi điện phân không có màng ngăn tạo ra hỗn hợp NaCl và NaClO có khả năng tẩy màu mạnh. Đáp án B 16.15 Trong quá trình mạ bạc cho một chiếc vòng bằng thép thì ở anode xảy ra quá trình A. Ag → \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\)+ 1e. B. Fe → \({\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}\)+ 2e. C. 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e. D. C → \({{\rm{C}}^{{\rm{4 + }}}}\)+ 4e. Phương pháp giải: Dựa vào ứng dụng của Phương pháp điện phân dung dịch. Lời giải chi tiết: Trong quá trình mạ bạc cho một chiếc vòng bằng thép thì ở anode xảy ra quá trình: Ag → \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\)+ 1e. Đáp án A 16.16 Xét quá trình điện phân dung dịch NaCl 20% bằng dòng điện một chiều (với điện cực trơ, có màng ngăn xốp). Quá trình khử xảy ra ở cathode là A. 2H2O + 2e → H2 + 2\({\rm{O}}{{\rm{H}}^{\rm{ - }}}\). B. Cl2 + 2e → 2\({\rm{C}}{{\rm{l}}^{\rm{ - }}}\). C. 2\({\rm{C}}{{\rm{l}}^{\rm{ - }}}\)→ Cl2 + 2e. D. \({{\rm{H}}_{\rm{2}}}{\rm{O }} \to {\rm{ 2}}{{\rm{H}}^{\rm{ + }}}{\rm{ + }}\frac{{\rm{1}}}{{\rm{2}}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2e}}\). Phương pháp giải: Dựa vào Phương pháp điện phân dung dịch. Lời giải chi tiết: Tại cathode xảy ra quá trình điện phân nước: 2H2O + 2e → H2 + 2\({\rm{O}}{{\rm{H}}^{\rm{ - }}}\). Đáp án A 16.17 Trong quá trình điện phân KCl nóng chảy với các điện cực trơ, ở cathode xảy ra quá trình A. oxi hóa ion Z. B. khử ion \({{\rm{K}}^{\rm{ + }}}\). C. oxi hóa ion \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\). D. khử ion \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\). Phương pháp giải: Dựa vào Phương pháp điện phân nóng chảy. Lời giải chi tiết: Trong quá trình điện phân KCl nóng chảy với các điện cực trơ, ở cathode xảy ra quá trình khử ion \({{\rm{K}}^{\rm{ + }}}\). 16.18 Khi điện phân dung dịch gồm CuSO4 1,0 M và H2SO4 0,5 M, quá trình khử đầu tiên xảy ra ở cathode là. A. 2H2O + 2e → H2 + 2\({\rm{O}}{{\rm{H}}^{\rm{ - }}}\). B. \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\)+ 2e → Cu. C. \({\rm{SO}}_{\rm{4}}^{{\rm{2 - }}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 2e }} \to {\rm{ S}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}{\rm{.}}\) D. 2\({{\rm{H}}^{\rm{ + }}}\)+ 2e → H2. Phương pháp giải: Cathode là điện cực âm, xảy ra quá trình khử các ion kim loại hoặc nước Anode là điện cực dương, xảy ra quá trình oxi hóa các ion phi kim, gốc acid không có oxygen hoặc nước. Lời giải chi tiết: \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\)+ 2e → Cu. Đáp án B 16.19 Cho các cặp oxi hóa – khử và thế điện cực chuẩn tương ứng:
Khi điện phân dung dịch chứa đồng thời bốn loại ion halide ở trên với nồng độ mol bằng nhau, ion halide bị điện phân đầu tiên ở anode là A. \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\). B. \({\rm{B}}{{\rm{r}}^{\rm{ - }}}\). C. \({{\rm{F}}^{\rm{ - }}}\). D. \({{\rm{I}}^{\rm{ - }}}\). Phương pháp giải: Dựa vào thứ tự điện phân dung dịch. Lời giải chi tiết: Ion I - bị điện phân trước. Đáp á D 16.20 Cho các cặp oxi hóa – khử và thế điện cực chuẩn tương ứng:
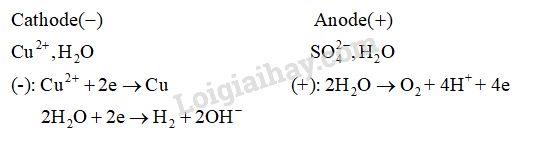
Khi điện phân dung dịch chứa đồng thời bốn loại cation ở trên với nồng độ mol bằng nhau, cation đầu tiên bị điện phân đầu tiên ở cathode là A. \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\). B. \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\). C. \({{\rm{H}}^{\rm{ + }}}\). D. \({\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}\). Phương pháp giải: Dựa vào thứ tự điện phân dung dịch. Lời giải chi tiết: Ag+ có tính oxi hóa mạnh nhất trong các ion trên nên điện phân trước. 16.21 Khi điện phân dung dịch gồm Cu(NO3)2 1 M và AgNO3 1 M, thứ tự điện phân ở cathode là A. \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\), \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\), H2O. B. \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\), \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\), H2O. C. H2O, \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\), \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\). D. \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\), H2O, \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\). Phương pháp giải: tại cathode, ion có tính oxi hóa mạnh hơn bị khử hóa trước. Lời giải chi tiết: \({\rm{A}}{{\rm{g}}^{\rm{ + }}}\), \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\), H2O. Đáp án B 16.22 Khi điện phân dung dịch gồm CuCl2 1,0 M và H2SO4 0,5 M, thứ tự điện phân ở anode là A. H2O, \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\). B. \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\), H2O. C. \({\rm{SO}}_4^{2 - }\), \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\), H2O. D. \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\), \({\rm{SO}}_4^{2 - }\), H2O. Phương pháp giải: Tại anode, các ion có tính khử mạnh hơn bị oxi hóa trước. Lời giải chi tiết: \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\), H2O bị điện phân trước, \({\rm{SO}}_4^{2 - }\)không bị điện phân. Đáp án B 16.23 Khi điện phân dung dịch gồm CuSO4 và HCl (sử dụng điện cực trơ, có màng ngăn xốp), chất khí đầu tiên thoát ra ở anode là A. O2. B. Cl2. C. H2. D. SO2. Phương pháp giải: Dựa vào thứ tự điện phân tại anode. Lời giải chi tiết: Khi đầu tiên thoát ra ở anode là Cl2 do ion Cl- bị oxi hóa trước. Đáp án B 16.24 Điện phân dung dịch CuSO4 với điện cực trơ. Sau một thời gian, ở cathode thu được 1,28 g Cu và ở anode có V mL khí O2 (25oC, 1 bar) bay ra. Giá trị của V là A. 495,8. B. 124,0. C. 247,9. D. 743,7. Phương pháp giải: Dựa vào kiến thức về điện phân dung dịch và áp dụng định luật Faraday: m = \(\frac{{A.I.t}}{{n.F}}\) Trong đó: m là khối lượng chất tạo thành; A là khối lượng nguyên tử; I là cường độ dòng điện; n là mol electron trao đổi; F là hằng số Faraday. Lời giải chi tiết: \(\begin{array}{l}Catho{\rm{d}}e( - ){\rm{ Anod}}e( + )\\C{u^{2 + }},{H_2}{\rm{O SO}}_4^{2 - },{H_2}{\rm{O}}\\{\rm{( - ): C}}{{\rm{u}}^{2 + }} + 2{\rm{e}} \to Cu{\rm{ ( + ): 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 4e}}\\{\rm{ 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} + 2{\rm{e}} \to {H_2} + 2{\rm{O}}{H^ - }\end{array}\) \(\begin{array}{l}{{\rm{m}}_{{\rm{Cu}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. }}\frac{{{{\rm{A}}_{{\rm{Cu}}}}}}{{{{\rm{n}}_{{\rm{Cu}}}}}}{\rm{. I}}{\rm{. t = 1,28 g = > }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. I}}{\rm{. t = }}\frac{{{\rm{1,28 }}{\rm{. 2}}}}{{64}} = 0,04\\{{\rm{m}}_{{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. }}\frac{{{{\rm{A}}_{\rm{O}}}}}{{{{\rm{n}}_{\rm{O}}}}}{\rm{. I}}{\rm{. t = > }}{{\rm{V}}_{{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}\frac{{{\rm{0,04}}}}{4}{\rm{. 24,79}}{\rm{. 1000 = 247,9 mL}}\end{array}\) Đáp án C \(\begin{array}{l}Catho{\rm{d}}e( - ){\rm{ Anod}}e( + )\\C{u^{2 + }},{H_2}{\rm{O SO}}_4^{2 - },{H_2}{\rm{O}}\\{\rm{( - ): C}}{{\rm{u}}^{2 + }} + 2{\rm{e}} \to Cu{\rm{ ( + ): 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 4e}}\\{\rm{ 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} + 2{\rm{e}} \to {H_2} + 2{\rm{O}}{H^ - }\end{array}\) \(\begin{array}{l}{{\rm{m}}_{{\rm{Cu}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. }}\frac{{{{\rm{A}}_{{\rm{Cu}}}}}}{{{{\rm{n}}_{{\rm{Cu}}}}}}{\rm{. I}}{\rm{. t = 1,28 g = > }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. I}}{\rm{. t = }}\frac{{{\rm{1,28 }}{\rm{. 2}}}}{{64}} = 0,04\\{{\rm{m}}_{{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. }}\frac{{{{\rm{A}}_{\rm{O}}}}}{{{{\rm{n}}_{\rm{O}}}}}{\rm{. I}}{\rm{. t = > }}{{\rm{V}}_{{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}\frac{{{\rm{0,04}}}}{4}{\rm{. 24,79}}{\rm{. 1000 = 247,9 mL}}\end{array}\) Đáp án C 16.25 Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d ở các câu 16.25 – 16.27. Trong quá trình điện phân dung dịch CuSO4 với anode bằng đồng. a) Ở anode xảy ra quá trình oxi hóa nước. b) Khối lượng anode không thay đổi. c) Nồng độ CuSO4 trong dung dịch giảm dần. d) Khối lượng cathode tăng. Phương pháp giải: Dựa vào Phương pháp điện phân dung dịch. Lời giải chi tiết: a) Sai. Ở anode xảy ra quá trình oxi kim loại đồng. Cu → Cu2+ + 2e b) Sai. Khối lượng anode giảm. c) Sai. Nồng độ dung dịch CuSO4 không đổi. d) Đúng. Vì ở cathode xảy ra quá trình khử ion Cu2+ + 2e → Cu 16.26 Điện phân dung dịch NaCl bão hòa (với điện cực trơ, màng ngăn xốp) đến khi nồng độ NaCl giảm đi một nửa thì dừng điện phân. a) Dung dịch sau điện phân làm phenolphthalein chuyển màu hồng. b) Ở cathode chỉ xảy ra quá trình khử ion Na+. c) Số mol khí Cl2 thoát ra ở anode bằng số mol H2 thoát ra ở cathode. d) Thứ tự điện phân ở anode là H2O, \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\). Phương pháp giải: Dựa vào thứ tự điện phân dung dịch. Lời giải chi tiết: a) Đúng. Ở cathode xảy ra quá trình điện phân nước: 2H2O + 2e → H2 + 2\({\rm{O}}{{\rm{H}}^{\rm{ - }}}\), dung dịch môi trường base, làm phenolphthalein chuyển màu hồng. b) Sai. Ở cathode xảy ra quá trình điện phân nước. c) Đúng. Vì số electron trao đổi ở cả hai phản ứng đều bằng nhau, bằng 2. d) Sai. \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\) điện phân trước. 16.27 Xét quá trình điện phân nóng chảy hợp chất ion MX của kim loại kiềm: a) Cực dương là anode, cực âm là cathode. b) Kim loại M được tạo thành ở cực âm. c) Điện cực âm có dòng electron chuyển đến. d) Cực dương và cực âm nối với các cực tương ứng của nguồn điện. Phương pháp giải: Dựa vào nguyên tắc điện phân dung dịch. Lời giải chi tiết: a) Đúng. b) Đúng. Ở cực âm (cathode) xảy ra quá trình oxi hóa: Mn+ + ne → M c) Sai. Electron chuyển đến cực dương (anode). d) Đúng. Sự điện phân là quá trình oxi hóa – khử xảy ra ở bề mặt điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy. 16.28 Để mạ 5,0 g bạc lên một đĩa sắt khi điện phân dung dịch chứa \({{\rm{[Ag(N}}{{\rm{H}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{]}}^{\rm{ + }}}\)với dòng điện có cường độ 1,5 A không đổi cần thời gian t phút. Cho biết: - Quá trình khử tại cathode: \({{\rm{[Ag(N}}{{\rm{H}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{]}}^{\rm{ + }}}\)+ 1e → Ag + 2NH3. - Điện lượng q = It = ne. F, F = 96 500 C/mol. Giá trị của t là bao nhiêu? (Làm trong kết quả đến phần mười). Phương pháp giải: Dựa vào công thức đề bài cho. Lời giải chi tiết: Số mol electron: ne = 1. nAg = 0,0463 mol Điện lượng q = ne . F = 4468 C \( \Rightarrow {\rm{t = }}\frac{{\rm{q}}}{{\rm{t}}}{\rm{ = }}\frac{{{\rm{4468}}}}{{{\rm{1,5A}}}}{\rm{ = 2078s = 49,6 min}}\) 16.29 Tiến hành điện phân dung dịch CuSO4 với anode bằng đồng. Để hòa tan 100 g đồng ở anode trong 8 giờ thì cần cường độ dòng điện bằng bao nhiêu ampe? (Làm trong kết quả đến phần mười). Phương pháp giải: Dựa vào công thức sử dụng trong 16.28: Điện lượng q = It = ne. F, F = 96 500 C/mol. Lời giải chi tiết: Quá trình oxi hóa ở anode: Cu → Cu2+ + 2e Số mol electron: ne = 2. nCu = 3,125 mol Điện lượng q = ne . F = 301563 C \( \Rightarrow {\rm{I = }}\frac{{\rm{q}}}{{\rm{t}}}{\rm{ = }}\frac{{{\rm{301 563 C}}}}{{{\rm{28 800 s}}}}{\rm{ = 10,5 A}}\) 16.30 Điện phân 500 mL dung dịch CuSO4 0,2 M (điện cực trơ) cho đến khi ở cathode thu được 3,2 g kim loại thì thể tích khí (đkc) thu được ở anode là A. 1,24 lít. B. 2,48 lít. C. 0,62 lít. D. 3,72 lít. Phương pháp giải: Dựa vào nguyên tắc điện phân dung dịch. Lời giải chi tiết:
\(\begin{array}{l}{{\rm{m}}_{{\rm{Cu}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. }}\frac{{{{\rm{A}}_{{\rm{Cu}}}}}}{{{{\rm{n}}_{{\rm{Cu}}}}}}{\rm{. I}}{\rm{. t = 3,2 = > }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. I}}{\rm{. t}} = 0,1\\{{\rm{m}}_{{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. }}\frac{{{{\rm{A}}_{\rm{O}}}}}{{{{\rm{n}}_{\rm{O}}}}}{\rm{. I}}{\rm{. t = > }}{{\rm{V}}_{{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}\frac{{{\rm{0,1}}}}{4}{\rm{. 24,79 = 0,61975 l\'i t}}\, \approx {\rm{0,62}}\end{array}\) 16.31 Điện phân dung dịch M(NO3)n (điện cực trơ, cường độ dòng điện không đổi), ở cathode chỉ thu được 5,4 g kim loại M và ở anode thu được 0,31 lít khí (đkc). Kim loại M là A. Fe. B. Cu. C. Ag. D. Pb. Phương pháp giải: Dựa vào nguyên tắc điện phân dung dịch. Lời giải chi tiết:
Bảo toàn electron ta có: n e nhường = n e nhận
16.32 Điện phân dung dịch MSO4 (M là kim loại) với điện cực trơ, cường độ dòng điện không đổi. Sau thời gian t giây, thu được a mol khí ở anode. Nếu thời gian điện phân là 2t giây thì tổng số mol khí thu được ở cả hai điện cực là 2,5a mol. Giả sử hiệu suất điện phân là 100%, khí sinh ra không tan trong nước. a) Tại thời điểm 2t giây, có bọt khí ở cathode. b) Tại thời điểm t giây, ion M2+ chưa bị điện phân hết. c) Dung dịch sau điện phân có pH < 7. d) Khi thu được 1,8a mol khí ở anode thì vẫn chưa xuất hiện bọt khí ở cathode. Phương pháp giải: Dựa vào nguyên tắc điện phân dung dịch. Lời giải chi tiết: Thời điểm t giây ở cathode: M2+ + 2e → M ở anode: 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e. (sinh ra a mol khí) Thời điểm 2t giây ở cathode: M2+ + 2e → M (sinh ra 3,5 a mol M) Khi M2+ hết nước bị điện phân: 2H2O + 2e → H2 + 2\({\rm{O}}{{\rm{H}}^{\rm{ - }}}\)(sinh ra 0,5a mol khí) ở anode: 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e (sinh ra 2a mol khí) a) Đúng. Tại thời điểm t giây, thu được a mol khí ở anode => thời điểm 2t giây thu được 2 a mol khí. Do vậy đã có 0,5 a mol khí sinh ra ở cathode. b) Đúng. c) Đúng. d) Sai. 16.33 Điện phân V lít dung dịch CuCl2 0,5 M với điện cực trơ. Khi dừng điện phân thu được dung dịch X và 1,86 lít khí Cl2 (đkc) duy nhất ở anode. Toàn bộ dung dịch X tác dụng vừa đủ với 12,6 g Fe. Giá trị của V là bao nhiêu? Phương pháp giải: Dựa vào nguyên tắc điện phân dung dịch. Lời giải chi tiết: ở cathode: Cu2+ + 2e → Cu ở anode: 2Cl- → Cl2 + 2e. \({n_{C{l_2}}} = \frac{{1,86}}{{24,79}} = 0,075mol\) Vì dung dịch X tác dụng với Fe nên Cu2+ chưa điện phân hết. \({n_{Fe}} = \frac{{12,6}}{{56}} = 0,225mol\) Fe + CuCl2 → FeCl2 + Cu 0,225 mol 0,225 mol \({n_{CuC{l_2}}} = 0,075 + 0,225 = 0,3mol\) V = \(\frac{n}{{{C_M}}} = \frac{{0,3}}{{0,5}} = 0,6L\) 16.34 Điện phân 200 mL dung dịch CuSO4 nồng độ x mol/L với điện cực trơ. Sau một thời gian thu được dung dịch Y vẫn còn màu xanh, có khối lượng giảm 8 g so với dung dịch ban đầu. Cho 16,8 g bột sắt vào Y, sau khi các phản ứng xảy ra hoàn toàn, thu được 12,4 g kim loại. Giá trị của x là bao nhiêu? Phương pháp giải: Dựa vào nguyên tắc điện phân dung dịch. Lời giải chi tiết:
Vì dung dịch Y vẫn còn màu xanh nên Cu2+ chưa điện phân hết Khối lượng dung dịch giảm = khối lượng Cu sinh ra + khối lượng khí O2 thoát ra Gọi số mol Cu2+ bị điện phân là a Theo số mol e trao đổi ta có: \(\begin{array}{l}C{u^{2 + }} + 2{\rm{e}} \to Cu{\rm{ 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {O_2} + 4{H^ + } + 4e\\a \to {\rm{ 2a a }}\frac{1}{2}{\rm{a}} \leftarrow {\rm{ 2a}}\end{array}\) Ta có 64 a + 32.\(\frac{1}{2}\) a = 8 g → a = 0,1 Fe + H2SO4 → FeSO4 + H2 Fe + CuSO4 → Cu + FeSO4 Số mol Fe tham gia phản ứng = số mol H2SO4 + số mol CuSO4 dư Gọi b là số mol CuSO4 chưa bị điện phân Theo định luật bảo toàn khối lượng ta có Khối lượng kim loại sau phản ứng = 16,8 g – khối lượng Fe phản ứng + khối lượng Cu sinh ra. Hay 16,8 – 56(b + 0,1) + 64 b = 12,4 => b = 0,15 mol Tổng số mol CuSO4 = a + b = 0,25 Vậy x = \(\frac{{0,25}}{{0,2}}\)= 1,25 16.35 Điện phân 500 mL dung dịch AgNO3 với điện cực trơ cho đến khi cathode bắt đầu có khí thoát ra thì dừng. Để trung hòa dung dịch sau điện phân cần 80 mL dung dịch NaOH 0,1 M. Biết cường độ dòng điện là 0,2A, thời gian điện phân là bao nhiêu giây? Phương pháp giải: Dựa vào nguyên tắc điện phân dung dịch. Lời giải chi tiết: ở cathode: Ag+ + e → Ag ở anode: 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e. Phản ứng trung hòa: H+ + OH- → H2O nNaOH = nH+ = 0,08 . 0,1 = 0,008 (mol) => số eletron trao đổi là 0,008 mol số mol Ag tham gia phản ứng điện phân 0,008 mol \({{\rm{m}}_{{\rm{Ag}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{F}}}{\rm{. }}\frac{{{{\rm{A}}_{{\rm{Ag}}}}}}{{\rm{n}}}{\rm{. I}}{\rm{. t = > t = }}\frac{{{{\rm{n}}_{{\rm{Ag}}}}{\rm{.F}}}}{{\rm{I}}}{\rm{ = }}\frac{{{\rm{0,008}}{\rm{.96500}}}}{{{\rm{0,2}}}}{\rm{ = 3860 s}}\) 16.36 Điện phân 500 mL dung dịch X gồm Cu(NO3)2 và AgNO3 với cường độ dòng điện 0,804 A cho đến khi bọt khí bắt đầu thoát ra ở cathode thì mất 2 giờ, khi đó khối lượng cathode tăng thêm 4,2 g. Nồng độ mol của Cu(NO3)2 trong dung dịch X là bao nhiêu? Phương pháp giải: Dựa vào nguyên tắc điện phân dung dịch. Lời giải chi tiết: ở cathode: Ag+ + e → Ag Cu2+ + 2e → Cu ở anode: 2H2O → 4\({{\rm{H}}^{\rm{ + }}}\)+ O2 + 4e. thì mất 2 giờ, khi đó khối lượng cathode tăng thêm 4,2 g Sau 2h, ion kim loại a mol Ag+ và b mol Cu2+ bị điện phân hết => khối lượng cathode tăng = mAg + mCu = 108 a + 64 b = 4,2 g Thời gian để điện phân hết a mol Ag+ và b mol Cu2+ => a = b = 0,02 => nồng độ mol của Cu(NO3)2 trong dung dịch X là 0,03 M.
|















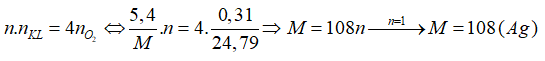







Danh sách bình luận