Đề thi học kì 1 Hóa 9 - Đề số 8Tải vềDãy chất nào sau đây gồm toàn oxit axit? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
Đề bài I. TRẮC NGHIỆM Câu 1:Dung dịch \(N{a_2}C{O_3}\) tác dụng được với chất nào dưới đây? A. \(HCl\) B. \(N{a_2}S{O_4}\) C. \(Mg{\left( {OH} \right)_2}\) D. \(BaS{O_4}\) Câu 2: Dãy chất nào sau đây gồm toàn oxit axit? A. \({H_2}O,{\rm{ }}CaO,{\rm{ }}FeO,{\rm{ }}CuO\) B. \(C{O_2},{\rm{ }}S{O_3},{\rm{ }}N{a_2}O,{\rm{ }}N{O_2}\) C. \(S{O_2},{\rm{ }}{P_2}{O_5},{\rm{ }}C{O_2},{\rm{ }}{N_2}{O_5}\) D. \(C{O_2},{\rm{ }}S{O_2},{\rm{ }}CuO,{\rm{ }}{P_2}{O_5}\) Câu 3: Khí nào sau đây có màu vàng lục? A. \(C{O_2}\) B. \(C{l_2}\) C. \({H_2}\) D. \(S{O_2}\) Câu 4: Trong các dãy chất sau, dãy nào thỏa mãn điều kiện tất cả các chất đều phản ứng với dung dịch \(HCl?\) A. \(Cu,{\rm{ }}BaO,{\rm{ }}Ca{\left( {OH} \right)_2},{\rm{ }}NaN{O_3}\) B. Qùy tím, \(CuO,{\rm{ }}Ba{\left( {OH} \right)_2},{\rm{ }}AgN{O_3},{\rm{ }}Zn\) C. Quỳ tím, \(AgN{O_3},{\rm{ }}Zn,{\rm{ }}NO,{\rm{ }}CaO\) D. Quỳ tím, \(CuO,{\rm{ }}AgN{O_3},{\rm{ }}Cu\) Câu 5: Có các chất bột để riêng biệt là: \(Cu,{\rm{ }}Al,{\rm{ }}A{l_2}{O_3},{\rm{ }}F{e_2}{O_3}.\) Chỉ dùng thêm 1 chất nào trong số các chất cho dưới đây để phân biệt chúng? A. Dung dịch \(CuS{O_4}\) B. Dung dịch AgNO3 C. Dung dịch \({H_2}S{O_{4\;}}\) loãng D. Dung dịch \(NaCl\) Câu 6: Thể tích dung dịch \(HCl\) 2M cần dùng để hoà tan vừa đủ 16,8 gam bột \(Fe\) là: A. 0.2 lít B. 0,1 lít C. 0,25 lít D. 0,3 lít Câu 7: Trong số các cặp chất sau, cặp nào có phản ứng xảy ra giữa các chất? A. Dung dịch \(NaCl\) + dung dịch \(KN{O_3}\) B. Dung dịch \(BaC{l_2}\;\) + dung dịch \(HN{O_3}\) C. Dung dịch \(N{a_2}S\) + dung dịch HCl D. Dung dịch \(BaC{l_2}\;\) và dung dịch \(NaN{O_3}\) Câu 8: Phát biểu nào dưới đây là đúng? A. Thép là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2 – 5%. B. Gang là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2 – 5%. C. Nguyên liệu để sản xuất thép là quặng sắt tự nhiên (manhetit, hematit…), than cốc, không khí giàu oxi và một số phụ gia khác. D. Các khung cửa sổ làm bằng thép (để lâu trong không khí ẩm) không bị ăn mòn. Câu 9: Trong công nghiệp, nhôm được điều chế theo cách nào? A. Điện phân nóng chảy \(A{l_2}{O_3}\;\) có xúc tác B. Cho \(Fe\) tác dụng với \(A{l_2}{O_3}\) C. Điện phân dung dịch muối nhôm D. Dùng than chì để khử \(A{l_2}{O_3}\;\) ở nhiệt độ cao Câu 10: Phát biểu nào dưới đây là không đúng? A. Phần lớn các nguyên tố phi kim không dẫn điện, dẫn nhiệt, có nhiệt độ nóng chảy, nhiệt độ sôi thấp. B. Ở điều kiện thường, phi kim tồn tại ở cả 3 trạng thái: rắn, lỏng, khí. C. Kim loại có tính dẻo, dẫn điện, dẫn nhiệt tốt, có ánh kim. D. Hợp kim của sắt với đồng và một số nguyên tố khác như mangan, sắt, silic được dùng trong công nghiệp chế tạo máy bay. Câu 11: Nhôm không tác dụng được với chất nào dưới đây? A. Dung dịch \(HCl\) B. Dung dịch \(NaOH\) C. Dung dịch \(KN{O_3}\) D. Dung dịch \(CuS{O_4}\) Câu 12: Dẫn 8,96 lít khí \(C{O_2}\;\) (đktc) vào dung dịch \(Ca{\left( {OH} \right)_2}\;\) dư. Sau phản ứng thu được m gam kết tủa. Giá trị của m là: A. 20,0g B. 40,0g C. 30,0g D. 15,0 g Câu 13: Oxit nào dưới đây, khi tan trong nước cho dung dịch làm qùy tím hóa xanh? A. \(CuO\) B. \({P_2}{O_5}\) C. \(MgO\) D. \(N{a_2}O\) Câu 14: Chọn dãy chất mà tất cả các bazơ đều bị nhiệt phân trong các dãy sau: A. \(Ca{\left( {OH} \right)_2},{\rm{ }}KOH,{\rm{ }}Fe{\left( {OH} \right)_3},{\rm{ }}Zn{\left( {OH} \right)_2}\) B. \(Fe{\left( {OH} \right)_2},{\rm{ }}Pb{\left( {OH} \right)_2},{\rm{ }}Cu{\left( {OH} \right)_2}\) C. \(Mg{\left( {OH} \right)_2},{\rm{ }}Cu{\left( {OH} \right)_2},{\rm{ }}NaOH\) D. \(KOH,{\rm{ }}Cu{\left( {OH} \right)_2},{\rm{ }}NaOH,{\rm{ }}Ba{\left( {OH} \right)_2}\) Câu 15: Nhôm, sắt không tác dụng được với chất nào sau đây? A. Axit \(HN{O_3}\) đặc nguội B. Lưu huỳnh C. Khí oxi D. Khí clo Câu 16: Hoà tan hoàn toàn m gam \(Al\) trong dung dịch \(NaOH\) dư. Sau phản ứng thu được 5,04 lít khí \({H_2}\;\)(đktc). Giá trị của m là: A. 6,075g B. 4,05g C. 8,1g D. 2,025g Câu 17: Có thể phân biệt hai mẫu bột kim loại \(Al\) và \(Fe\) (để trong các lọ riêng biệt) bằng hóa chất nào dưới đây? A. Dung dịch \(AgN{O_3}\) B. Dung dịch \(CuS{O_4}\) C. Dung dịch \(HCl\) D. Dung dịch \(NaOH\) Câu 18: Khử hoàn toàn 32 gam \(F{e_2}{O_3}\;\) cần V lít CO (đktc). Giá trị của V là: A. 13,44 lít B. 6,72 lít C. 8,96 lít D. 26,88 lít Câu 19: Dãy chất nào trong các dãy sau thỏa mãn điều kiện các chất đều có phản ứng với dung dịch NaOH? A. \(Al,{\rm{ }}C{O_2},{\rm{ }}S{O_2},{\rm{ }}Ba{\left( {OH} \right)_2}\) B. \(C{O_2},{\rm{ }}S{O_2},{\rm{ }}CuS{O_4},{\rm{ }}Fe\) C. \(C{O_2},{\rm{ }}CuS{O_4},{\rm{ }}S{O_2},{\rm{ }}{H_3}P{O_4}\) D. \(KOH,{\rm{ }}C{O_2},{\rm{ }}S{O_2},{\rm{ }}CuS{O_4}\) Câu 20: 200 ml dung dịch \(HCl\) 0,2M tác dụng vừa đủ với dung dịch \(AgN{O_3}.\) Khối lượng kết tủa thu được sau phản ứng là: A. 5,74g B. 28,7g C. 2,87g D. 57,4g II. TỰ LUẬN Bài 1: (1 điểm) Viết các phương trình hóa học thực hiện chuỗi biến hóa sau:
Bài 2: (1 điểm) Chọn chất thích hợp điền vào sơ đồ phản ứng và lập phương trình hóa học:
Bài 3: (1 điểm) 1) Nêu hiện tượng và viết phương trình phản ứng khi cho đinh sắt vào dung dịch \(CuS{O_4}.\) 2) Nhận biết các dung dịch mất nhãn sau: \({H_2}S{O_4},{\rm{ }}NaCl,{\rm{ }}NaOH,{\rm{ }}AgN{O_3}.\) 3) Axit Clohidric trong dạ dày người có vai trò quan trọng đối với quá trình trao đổi chất của cơ thể. Nhưng đôi khi ta có cảm giác đầy hơi và ợ chua (nhất là sau khi ăn) là do một trong các nguyên nhân là axit ở dạ dày đã tác động ngược lên vùng thực quản. Uống thuốc kháng axit có thể làm giảm cảm giác này). Một viên thuốc kháng axit có chứa bazơ như \(NaOH,{\rm{ }}Mg{\left( {OH} \right)_2}, \ldots \) Em hãy cho biết tác dụng của thuốc kháng axit và viết phương trình hóa học minh họa. Bài 4: (2 điểm) Cho 20 gam hỗn hợp X gồm \(CuO\) và \(F{e_2}{O_3}\) tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của \(CuO\) và \(F{e_2}{O_3}\) trong hỗn hợp X lần lượt là bao nhiêu %? Đáp án Phần trắc nghiệm
I. TRẮC NGHIỆM Câu 1:Dung dịch \(N{a_2}C{O_3}\) tác dụng được với chất nào dưới đây? A. \(HCl\) B. \(N{a_2}S{O_4}\) C. \(Mg{\left( {OH} \right)_2}\) D. \(BaS{O_4}\) Phương pháp giải Dựa vào tính chất hóa học của Na2CO3 Lời giải chi tiết Đáp án A Câu 2: Dãy chất nào sau đây gồm toàn oxit axit? A. \({H_2}O,{\rm{ }}CaO,{\rm{ }}FeO,{\rm{ }}CuO\) B. \(C{O_2},{\rm{ }}S{O_3},{\rm{ }}N{a_2}O,{\rm{ }}N{O_2}\) C. \(S{O_2},{\rm{ }}{P_2}{O_5},{\rm{ }}C{O_2},{\rm{ }}{N_2}{O_5}\) D. \(C{O_2},{\rm{ }}S{O_2},{\rm{ }}CuO,{\rm{ }}{P_2}{O_5}\) Phương pháp giải Oxit axit là hợp chất của phi kim với oxi Lời giải chi tiết Đáp án C Câu 3: Khí nào sau đây có màu vàng lục? A. \(C{O_2}\) B. \(C{l_2}\) C. \({H_2}\) D. \(S{O_2}\) Lời giải chi tiết Khí có màu vàng lục là khí Cl2 Đáp án B Câu 4: Trong các dãy chất sau, dãy nào thỏa mãn điều kiện tất cả các chất đều phản ứng với dung dịch \(HCl?\) A. \(Cu,{\rm{ }}BaO,{\rm{ }}Ca{\left( {OH} \right)_2},{\rm{ }}NaN{O_3}\) B. Qùy tím, \(CuO,{\rm{ }}Ba{\left( {OH} \right)_2},{\rm{ }}AgN{O_3},{\rm{ }}Zn\) C. Quỳ tím, \(AgN{O_3},{\rm{ }}Zn,{\rm{ }}NO,{\rm{ }}CaO\) D. Quỳ tím, \(CuO,{\rm{ }}AgN{O_3},{\rm{ }}Cu\) Phương pháp giải Dựa vào tính chất hóa học của dung dịch axit HCl Lời giải chi tiết Đáp án B Câu 5: Có các chất bột để riêng biệt là: \(Cu,{\rm{ }}Al,{\rm{ }}A{l_2}{O_3},{\rm{ }}F{e_2}{O_3}.\) Chỉ dùng thêm 1 chất nào trong số các chất cho dưới đây để phân biệt chúng? A. Dung dịch \(CuS{O_4}\) B. Dung dịch AgNO3 C. Dung dịch \({H_2}S{O_{4\;}}\) loãng D. Dung dịch \(NaCl\) Phương pháp giải Dựa vào tính chất của kim loại và oxit kim loại Lời giải chi tiết Dùng dung dịch H2SO4 vì Cu không phản ứng với dd H2SO4 => Nhận biết được Cu Al phản ứng với dd H2SO4 sinh ra khí H2 => Nhân biết được Al Al2O3 phản ứng với dung dịch H2SO4 tạo dung dịch trong suốt Fe2O3 phản ứng với dung dịch H2SO4 tạo dung dịch màu nâu đỏ của muối sắt (III) Đáp án C Câu 6: Thể tích dung dịch \(HCl\) 2M cần dùng để hoà tan vừa đủ 16,8 gam bột \(Fe\) là: A. 0.2 lít B. 0,1 lít C. 0,25 lít D. 0,3 lít Phương pháp giải Dựa vào phản ứng của sắt và dung dịch HCl Lời giải chi tiết n Fe = 16,8 : 56 = 0,3 mol Fe + 2HCl \( \to \) FeCl2 + H2 0,3 0,6 V HCl = 0,6 : 2 = 0,3 lít Đáp án D
Câu 7: Trong số các cặp chất sau, cặp nào có phản ứng xảy ra giữa các chất? A. Dung dịch \(NaCl\) + dung dịch \(KN{O_3}\) B. Dung dịch \(BaC{l_2}\;\) + dung dịch \(HN{O_3}\) C. Dung dịch \(N{a_2}S\) + dung dịch HCl D. Dung dịch \(BaC{l_2}\;\) và dung dịch \(NaN{O_3}\) Phương pháp giải Dung dịch phản ứng với nhau tạo kết tủa hoặc chất khí Lời giải chi tiết Na2S + 2HCl \( \to \) NaCl + H2S Câu 8: Phát biểu nào dưới đây là đúng? A. Thép là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2 – 5%. B. Gang là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2 – 5%. C. Nguyên liệu để sản xuất thép là quặng sắt tự nhiên (manhetit, hematit…), than cốc, không khí giàu oxi và một số phụ gia khác. D. Các khung cửa sổ làm bằng thép (để lâu trong không khí ẩm) không bị ăn mòn. Phương pháp giải Dựa vào khái niệm của hợp kim gang, thép Lời giải chi tiết Đáp án B Câu 9: Trong công nghiệp, nhôm được điều chế theo cách nào? A. Điện phân nóng chảy \(A{l_2}{O_3}\;\) có xúc tác B. Cho \(Fe\) tác dụng với \(A{l_2}{O_3}\) C. Điện phân dung dịch muối nhôm D. Dùng than chì để khử \(A{l_2}{O_3}\;\) ở nhiệt độ cao Lời giải chi tiết Điện phân nóng chảy Al2O3 có xúc tác criolit Đáp án A Câu 10: Phát biểu nào dưới đây là không đúng? A. Phần lớn các nguyên tố phi kim không dẫn điện, dẫn nhiệt, có nhiệt độ nóng chảy, nhiệt độ sôi thấp. B. Ở điều kiện thường, phi kim tồn tại ở cả 3 trạng thái: rắn, lỏng, khí. C. Kim loại có tính dẻo, dẫn điện, dẫn nhiệt tốt, có ánh kim. D. Hợp kim của sắt với đồng và một số nguyên tố khác như mangan, sắt, silic được dùng trong công nghiệp chế tạo máy bay. Lời giải chi tiết Hợp kim của nhôm và lithi được dùng trong công nghiệp chế tọa máy bay Đáp án D Câu 11: Nhôm không tác dụng được với chất nào dưới đây? A. Dung dịch \(HCl\) B. Dung dịch \(NaOH\) C. Dung dịch \(KN{O_3}\) D. Dung dịch \(CuS{O_4}\) Phương pháp giải Al không tác dụng với dung dịch muối của kim loại đứng trước Al Lời giải chi tiết Đáp án C Câu 12: Dẫn 8,96 lít khí \(C{O_2}\;\) (đktc) vào dung dịch \(Ca{\left( {OH} \right)_2}\;\) dư. Sau phản ứng thu được m gam kết tủa. Giá trị của m là: A. 20,0g B. 40,0g C. 30,0g D. 15,0 g Phương pháp giải Dựa vào phản ứng của khí CO2 với dung dịch Ca(OH)2 Lời giải chi tiết n CO2 = 0,4 mol CO2 + Ca(OH)2 \( \to \) CaCO3 + H2O 0,4 0,4 m CaCO3 = 0,4.100 = 40g Đáp án B Câu 13: Oxit nào dưới đây, khi tan trong nước cho dung dịch làm qùy tím hóa xanh? A. \(CuO\) B. \({P_2}{O_5}\) C. \(MgO\) D. \(N{a_2}O\) Phương pháp giải Oxit bazo của kim loại kiềm tan trong nước tạo dung dịch bazo làm quỳ tím hóa xanh Lời giải chi tiết Đáp án D Câu 14: Chọn dãy chất mà tất cả các bazơ đều bị nhiệt phân trong các dãy sau: A. \(Ca{\left( {OH} \right)_2},{\rm{ }}KOH,{\rm{ }}Fe{\left( {OH} \right)_3},{\rm{ }}Zn{\left( {OH} \right)_2}\) B. \(Fe{\left( {OH} \right)_2},{\rm{ }}Pb{\left( {OH} \right)_2},{\rm{ }}Cu{\left( {OH} \right)_2}\) C. \(Mg{\left( {OH} \right)_2},{\rm{ }}Cu{\left( {OH} \right)_2},{\rm{ }}NaOH\) D. \(KOH,{\rm{ }}Cu{\left( {OH} \right)_2},{\rm{ }}NaOH,{\rm{ }}Ba{\left( {OH} \right)_2}\) Phương pháp giải Hidroxit của kim loại đứng sau Mg bị nhiệt phân Lời giải chi tiết Đáp án B Câu 15: Nhôm, sắt không tác dụng được với chất nào sau đây? A. Axit \(HN{O_3}\) đặc nguội B. Lưu huỳnh C. Khí oxi D. Khí clo Phương pháp giải Al bị thụ động trong HNO3 đặc, nguội Lời giải chi tiết Đáp án A Câu 16: Hoà tan hoàn toàn m gam \(Al\) trong dung dịch \(NaOH\) dư. Sau phản ứng thu được 5,04 lít khí \({H_2}\;\)(đktc). Giá trị của m là: A. 6,075g B. 4,05g C. 8,1g D. 2,025g Phương pháp giải Dựa vào phản ứng của Al với dung dịch NaOH Lời giải chi tiết n H2 = 5,04 : 22, 4 = 0,225 mol Al + NaOH + H2O \( \to \) NaAlO2 + 3/2 H2 0,225 n Al = 0,225 : 3/2 = 0,15 mol => m Al = 0,15 . 27 = 4,05g Đáp án B Câu 17: Có thể phân biệt hai mẫu bột kim loại \(Al\) và \(Fe\) (để trong các lọ riêng biệt) bằng hóa chất nào dưới đây? A. Dung dịch \(AgN{O_3}\) B. Dung dịch \(CuS{O_4}\) C. Dung dịch \(HCl\) D. Dung dịch \(NaOH\) Phương pháp giải Dựa vào tính chất hóa học khác nhau của Al và Fe Lời giải chi tiết Al có phản ứng với dung dịch NaOH Đáp án D Câu 18: Khử hoàn toàn 32 gam \(F{e_2}{O_3}\;\) cần V lít CO (đktc). Giá trị của V là: A. 13,44 lít B. 6,72 lít C. 8,96 lít D. 26,88 lít Phương pháp giải Dựa vào phản ứng khử Fe2O3 của CO Lời giải chi tiết n Fe2O3 = 32 : 160 = 0,2 mol Fe2O3 + 3CO \( \to \) 2Fe + 3CO2 0,2 0,6 V CO2 = 0,6.22,4 = 13,44 lít Đáp án A Câu 19: Dãy chất nào trong các dãy sau thỏa mãn điều kiện các chất đều có phản ứng với dung dịch NaOH? A. \(Al,{\rm{ }}C{O_2},{\rm{ }}S{O_2},{\rm{ }}Ba{\left( {OH} \right)_2}\) B. \(C{O_2},{\rm{ }}S{O_2},{\rm{ }}CuS{O_4},{\rm{ }}Fe\) C. \(C{O_2},{\rm{ }}CuS{O_4},{\rm{ }}S{O_2},{\rm{ }}{H_3}P{O_4}\) D. \(KOH,{\rm{ }}C{O_2},{\rm{ }}S{O_2},{\rm{ }}CuS{O_4}\) Lời giải chi tiết Đáp án C Câu 20: 200 ml dung dịch \(HCl\) 0,2M tác dụng vừa đủ với dung dịch \(AgN{O_3}.\) Khối lượng kết tủa thu được sau phản ứng là: A. 5,74g B. 28,7g C. 2,87g D. 57,4g Phương pháp giải Dựa vào phản ứng của HCl với dung dịch AgNO3 Lời giải chi tiết HCl + AgNO3 \( \to \)AgCl + HNO3 0,04 0,04 m AgCl = 0,04 . 143 = 5,74g Đáp án A II. TỰ LUẬN Bài 1: (2 điểm) Viết các phương trình hóa học thực hiện chuỗi biến hóa sau: Al2O3 Al Al2(SO4)3 Al(OH)3 Al2O3 Lời giải chi tiết
Bài 2: (2 điểm) Chọn chất thích hợp điền vào sơ đồ phản ứng và lập phương trình hóa học: 1) BaCO3 + ? BaCl2 + ? + ? 2) Cl2 + ? NaCl + NaClO + ? 3) Cu(OH)2 + ? CuSO4 + ? 4) P2O5 + ? K3PO4 + ? Lời giải chi tiết 1) BaCO3 + 2HCl BaCl2 + CO2\( \uparrow \) + H2O 2) Cl2 + 2NaOH NaCl + NaClO + H2O 3) Cu(OH)2 + H2SO4 CuSO4 + 2H2O 4) P2O5 + 6KOH 2K3PO4 + 3H2O Bài 3: (3 điểm) 1) Nêu hiện tượng và viết phương trình phản ứng khi cho đinh sắt vào dung dịch CuSO4. 2) Nhận biết các dung dịch mất nhãn sau: H2SO4, NaCl, NaOH, AgNO3. 3) Axit Clohidric trong dạ dày người có vai trò quan trọng đối với quá trình trao đổi chất của cơ thể. Nhưng đôi khi ta có cảm giác đầy hơi và ợ chua (nhất là sau khi ăn) là do một trong các nguyên nhân là axit ở dạ dày đã tác động ngược lên vùng thực quản. Uống thuốc kháng axit có thể làm giảm cảm giác này). Một viên thuốc kháng axit có chứa bazo như NaOH, Mg(OH)2,… Em hãy cho biết tác dụng của thuốc kháng axit và viết phương trình hóa học minh họa. Lời giải chi tiết 1) w Hiện tượng: Đinh sắt tan bớt, có chất rắn màu đỏ bám trên đinh sắt và dung dịch có màu xanh lam nhạt màu dần. w Phương trình hóa học: Fe + CuSO4 FeSO4 + Cu\( \downarrow \) 2) w Trích mỗi dung dịch một ít ra làm mẫu thử: w Cho quỳ tím vào các mẫu thử trên ta thấy: - Mẫu thử nào làm quỳ tím hóa đỏ là dung dịch H2SO4 - Mẫu thử nào làm quỳ tím hóa xanh là dung dịch NaOH - Mẫu thử nào không làm đổi màu quỳ tím là dung dịch NaCl và dung dịch AgNO3 w Tiếp tục cho dung dịch HCl vào các mẫu thử chứa dung dịch NaCl và dung dịch AgNO3 ta thấy: - Mẫu thử nào có xuất hiện kết tủa trắng là dung dịch AgNO3 HCl + AgNO3 AgCl\( \downarrow \) + HNO3 - Mẫu thử nào không thấy có hiện tượng gì là dung dịch NaCl 3) w Tác dụng: làm giảm lượng axit trong dạ dày vì axit trong dạ dày khi gặp thuốc chứa bazơ sẽ tạo ra muối và nước. w Phương trình hóa học: HCl + NaOH NaCl + H2O 2HCl + Mg(OH)2 MgCl2 + H2O Bài 4: (2 điểm) Cho 20 gam hỗn hợp X gồm \(CuO\) và \(F{e_2}{O_3}\) tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của \(CuO\) và \(F{e_2}{O_3}\) trong hỗn hợp X lần lượt là bao nhiêu %? Lời giải chi tiết Gọi số mol CuO và Fe2O3 lần lượt là x, y mol CuO + 2 HCl CuCl2 + H2O x " 2x Fe2O3 + 6HCl 2FeCl3 + 3 H2O y " 6y Ta có hệ: \(\left\{ \begin{array}{l}80x + 160y = 20\\2x + 6y = 0,2 \times 3,5\end{array} \right. \Rightarrow x = 0,05;{\rm{ }}y = 0,1\) \(\% {m_{CuO}} = 20\% \;;\;\;\% {m_{F{e_2}{O_3}}} = 80\% \)
|














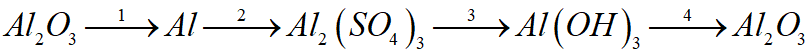







Danh sách bình luận