Đề thi học kì 1 Hóa 9 - Đề số 7Tải vềCho 22,4 gam sắt tác dụng với 6,72 lít khí clo (đktc), phản ứng xảy ra hoàn toàn thu được cất rắn có khối lượng là bao nhiêu? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
Đề bài I. TRẮC NGHIỆM Câu 1: Cho 22,4 gam sắt tác dụng với 6,72 lít khí clo (đktc), phản ứng xảy ra hoàn toàn thu được cất rắn có khối lượng là bao nhiêu? A. 43,7 gam. B. 38,1 gam C. 48,75 gam. D. 32,5 gam. Câu 2: Oxit nào sau đây là oxit axit? A. MgO. B. \({\rm{A}}{{\rm{l}}_{^{\rm{2}}}}{{\rm{O}}_{\rm{3}}}\) C. \({\rm{S}}{{\rm{O}}_{\rm{2}}}\) D. \({\rm{NO}}\) Câu 3: Chất nào sau đây có thể được làm khô bằng canxi oxit? A. \({\rm{S}}{{\rm{O}}_2}\) B. \({{\rm{H}}_{\rm{2}}}\) C. \({\rm{HCl}}\) D. \({\rm{C}}{{\rm{O}}_{\rm{2}}}\) Câu 4: Chất nào sau đây không phản ứng với dung dịch \({{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\) loãng? A. \({\rm{Al}}\) B. \({\rm{Ag}}\) C. \({\rm{CuO}}\) D. \({\rm{Fe}}\) Câu 5: Oxit nào sau đây phản ứng với nước ở điều kiện thường? A. \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) B. \({\rm{CuO}}\). C. \({\rm{N}}{{\rm{a}}_2}{\rm{O}}\) D. \({\rm{MgO}}\) Câu 6: Dung dịch HCl không tác dụng với chất nào sau đây? A. CuO. B. Ag. C. NaOH. D. \({\rm{AgN}}{{\rm{O}}_3}\) Câu 7: Hóa chất nào sau đây dùng để khử chua đất trong nông nghiệp? A. \({\rm{CaC}}{{\rm{O}}_3}\). B. \({\rm{MgC}}{{\rm{O}}_3}\) C. \({\rm{NaCl}}\) D. \({\rm{CaO}}\) Câu 8: Hòa tan hoàn toàn 5,6 gam Fe cần dùng \({\rm{V}}({\rm{ml}})\) dung dịch \({\rm{HCl}}\,\,2{\rm{M}}\). Giá tri của \({\rm{V}}\) cần tìm là: A. 0,1. B. 100. C. 50. D. 300 Câu 9: Trong công nghiệp người ta điều chế nhôm bằng cách A. khừ \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) bằng khí CO. B. khử \({\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}\) bằng khí \({{\rm{H}}_2}\) C. dùng Na tác dụng với dung dịch \({\rm{AlC}}{{\rm{l}}_3}\). D. điện phân nóng chảy \({\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}\)/criolit. Câu 10: Cặp chất nào sau đây cùng tồn tại trong một dung dịch? A. \({\rm{KCl,NaOH}}\) B. \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4},{\rm{KOH}}\) C. \({\rm{BaC}}{{\rm{l}}_2},{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\) D. \({\rm{NaCl}},{\rm{AgN}}{{\rm{O}}_3}\) Câu 11: Bazơ nào sau đây không bị phân hủy bởi nhiệt? A. \({\rm{Mg(OH}}{{\rm{)}}_{\rm{2}}}\) B. \({\rm{Cu}}{({\rm{OH}})_2}\) C. \({\rm{NaOH}}\) D. \({\rm{Fe}}{\left( {{\rm{OH}}} \right)_{\rm{3}}}\) Câu 12: Dãy nguyên tố nào sau đây xếp theo chiều tăng dần tính kim loại? A. \({\rm{Fe}},{\rm{Zn}},{\rm{Al}},{\rm{Mg}},{\rm{Na}}\). B. \({\rm{Zn}},{\rm{Fe}},{\rm{Mg}},{\rm{Al}},{\rm{Na}}\) C. \({\rm{Na}},{\rm{Mg}},{\rm{Al}},{\rm{Zn}},{\rm{Fe}}\) D. \({\rm{Fe}},{\rm{Zn}},{\rm{Na}},{\rm{Al}},{\rm{Mg}}\) Câu 13: Dãy chất gồm các oxit bazơ là: A. \({\rm{CuO, NO, MgO, CaO}}\) B. \({\rm{CuO, CaO, MgO, N}}{{\rm{a}}_{\rm{2}}}{\rm{O}}\) C. \({\rm{CaO, C}}{{\rm{O}}_{\rm{2}}}{\rm{, }}{{\rm{K}}_{\rm{2}}}{\rm{O, N}}{{\rm{a}}_{\rm{2}}}{\rm{O}}\) D. \({{\rm{K}}_{\rm{2}}}{\rm{O, FeO, }}{{\rm{P}}_{\rm{2}}}{{\rm{O}}_{\rm{5}}}{\rm{, M}}{{\rm{n}}_{\rm{2}}}{{\rm{O}}_{\rm{7}}}\) Câu 14: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit? A. \({\rm{C}}{{\rm{O}}_{\rm{2}}}\) B. \({\rm{S}}{{\rm{O}}_{\rm{2}}}\) C. \({{\rm{N}}_{\rm{2}}}\) D. \({{\rm{O}}_{\rm{3}}}\) Câu 15: Cho 0,1 mol kim loại kẽm vào dung dịch \({\rm{HCl}}\) dư. Khối lượng muối thu được là: A. 20,4 B. 1,36 g C. 13,6 g D. 27,2 g Câu 16: Phản ứng nào dưới đây là phản ứng trao đổi? A. \({\rm{2Na + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{2NaOH + }}{{\rm{H}}_{\rm{2}}}\) B. \({\rm{BaO + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Ba}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}\) C. \({\rm{Zn + }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{ ZnS}}{{\rm{O}}_{\rm{4}}}{\rm{\; + }}{{\rm{H}}_{\rm{2}}}\) D. \({\rm{BaC}}{{\rm{l}}_{\rm{2}}}{\rm{\; + }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{\;}} \to {\rm{ BaS}}{{\rm{O}}_{\rm{4}}}{\rm{\; + 2HCl}}\) Câu 17: Khi thả một cây đinh sắt sạch vào dung dịch \({\rm{CuS}}{{\rm{O}}_{\rm{4}}}\) loãng, có hiện tượng sau: A. Sủi bọt khí, màu xanh của dung dịch nhạt dần. B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần. C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu. D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần Câu 18: Có một mẫu \({\rm{Fe}}\) bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với: A. Dung dịch \({\rm{NaOH}}\) dư B. Dung dịch \({{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\) loãng C. Dung dịch \({\rm{HCl}}\) dư D. Dung dịch \({\rm{HN}}{{\rm{O}}_{\rm{3}}}{\rm{\;}}\)loãng Câu 19: Dãy phi kim tác dụng với oxi tạo thành oxit axit là: A. \({\rm{S, C, P}}\) B. \({\rm{S, C, C}}{{\rm{l}}_{\rm{2}}}\) C. \({\rm{C, P, B}}{{\rm{r}}_{\rm{2}}}\) D. \({\rm{C, C}}{{\rm{l}}_{\rm{2}}}{\rm{, B}}{{\rm{r}}_{\rm{2}}}\) Câu 20: X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65%. X là nguyên tố: A. C B. S C. N D. P
II. TỰ LUẬN Câu 1:( 2,5đ) Hoàn thành chuçi phản ứng hóa học sau? Câu 2: (1,5đ) Có 3 lọ đựng các dung dịch bị mất nhãn sau: HCl, H2SO4, NaOH. Bằng phương pháp hoá học hãy nhận biết các dung dịch trên. Viết phương trình hoá học. Câu 3: (3đ) Cho 30g hỗn hợp hai kim loại sắt và đồng tác dụng với dd HCl dư. Sau khi phản ứng xong thu được chất rắn A và 6,72l khí (ở đktc) Viết phương trình phản ứng hóa học xảy ra. Tính thành phần trăm theo khối lượng của hỗn hợp ban đầu. Đáp án Hướng dẫn lời giải chi tiết Thực hiện: Ban chuyên môn của Loigiaihay Phần trắc nghiệm
I. TRẮC NGHIỆM Câu 1: Cho 22,4 gam sắt tác dụng với 6,72 lít khí clo (đktc), phản ứng xảy ra hoàn toàn thu được cất rắn có khối lượng là bao nhiêu? A. 43,7 gam. B. 38,1 gam C. 48,75 gam. D. 32,5 gam. Phương pháp giải Áp dụng định luật bảo toàn khối lượng Lời giải chi tiết m Fe + m Cl2 = m muối => m muối = 22,4 + 0,3 . 71 = 43,7g Đáp án A Câu 2: Oxit nào sau đây là oxit axit? A. MgO. B. \({\rm{A}}{{\rm{l}}_{^{\rm{2}}}}{{\rm{O}}_{\rm{3}}}\) C. \({\rm{S}}{{\rm{O}}_{\rm{2}}}\) D. \({\rm{NO}}\) Phương pháp giải Dựa vào khái niệm của oxit axit Lời giải chi tiết Đáp án C Câu 3: Chất nào sau đây có thể được làm khô bằng canxi oxit? A. \({\rm{S}}{{\rm{O}}_2}\) B. \({{\rm{H}}_{\rm{2}}}\) C. \({\rm{HCl}}\) D. \({\rm{C}}{{\rm{O}}_{\rm{2}}}\) Phương pháp giải Canxi oxit có thể làm khô các khí với nguyên tắc không tham gia phản ứng với chất đó. Lời giải chi tiết H2 không phản ứng với canxi oxit nên có thể làm khô được Đáp án B Câu 4: Chất nào sau đây không phản ứng với dung dịch \({{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\) loãng? A. \({\rm{Al}}\) B. \({\rm{Ag}}\) C. \({\rm{CuO}}\) D. \({\rm{Fe}}\) Phương pháp giải H2SO4 loãng không phản ứng với kim loại đứng sau H Lời giải chi tiết Đáp án B Câu 5: Oxit nào sau đây phản ứng với nước ở điều kiện thường? A. \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) B. \({\rm{CuO}}\). C. \({\rm{N}}{{\rm{a}}_2}{\rm{O}}\) D. \({\rm{MgO}}\) Phương pháp giải Các oxit bazo của kim loại kiềm và kiềm thổ trừ Be và Mg tan được trong nước Lời giải chi tiết Đáp án C Câu 6: Dung dịch HCl không tác dụng với chất nào sau đây? A. CuO. B. Ag. C. NaOH. D. \({\rm{AgN}}{{\rm{O}}_3}\) Phương pháp giải HCl không phản ứng với kim loại đứng sau H Lời giải chi tiết Đáp án B Câu 7: Hóa chất nào sau đây dùng để khử chua đất trong nông nghiệp? A. \({\rm{CaC}}{{\rm{O}}_3}\). B. \({\rm{MgC}}{{\rm{O}}_3}\) C. \({\rm{NaCl}}\) D. \({\rm{CaO}}\) Phương pháp giải Đất bị chua là đất có lượng axit dư thừa vì vậy cần chất có tính bazo để trung hòa lượng axit Lời giải chi tiết Đáp án D Câu 8: Hòa tan hoàn toàn 5,6 gam Fe cần dùng \({\rm{V}}({\rm{ml}})\) dung dịch \({\rm{HCl}}\,\,2{\rm{M}}\). Giá tri của \({\rm{V}}\) cần tìm là: A. 0,1. B. 100. C. 50. D. 300 Phương pháp giải Dựa vào phản ứng giữa Fe và HCl Lời giải chi tiết n Fe = 5,6 : 56 = 0,1 mol Fe + 2HCl \( \to \)FeCl2 + H2 n HCl = 2 n Fe = 0,2 mol => V HCl = 0,2 : 2 = 100ml Đáp án B Câu 9: Trong công nghiệp người ta điều chế nhôm bằng cách A. khừ \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) bằng khí CO. B. khử \({\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}\) bằng khí \({{\rm{H}}_2}\) C. dùng Na tác dụng với dung dịch \({\rm{AlC}}{{\rm{l}}_3}\). D. điện phân nóng chảy \({\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}\)/criolit. Phương pháp giải Dựa vào kiến thức về điều chế nhôm Lời giải chi tiết Điện phân nóng chảy Al2O3 với xúc tác criolit Đáp án D Câu 10: Cặp chất nào sau đây cùng tồn tại trong một dung dịch? A. \({\rm{KCl,NaOH}}\) B. \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4},{\rm{KOH}}\) C. \({\rm{BaC}}{{\rm{l}}_2},{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\) D. \({\rm{NaCl}},{\rm{AgN}}{{\rm{O}}_3}\) Phương pháp giải Cặp chất tồn tại trong cùng một dung dịch khi không phản ứng với nhau tạo chất kết tủa hoặc bay hơi Lời giải chi tiết Đáp án A Câu 11: Bazơ nào sau đây không bị phân hủy bởi nhiệt? A. \({\rm{Mg(OH}}{{\rm{)}}_{\rm{2}}}\) B. \({\rm{Cu}}{({\rm{OH}})_2}\) C. \({\rm{NaOH}}\) D. \({\rm{Fe}}{\left( {{\rm{OH}}} \right)_{\rm{3}}}\) Phương pháp giải Bazo của kim loại kiềm và kiềm thổ bền bởi nhiệt Lời giải chi tiết Đáp án C Câu 12: Dãy nguyên tố nào sau đây xếp theo chiều tăng dần tính kim loại? A. \({\rm{Fe}},{\rm{Zn}},{\rm{Al}},{\rm{Mg}},{\rm{Na}}\). B. \({\rm{Zn}},{\rm{Fe}},{\rm{Mg}},{\rm{Al}},{\rm{Na}}\) C. \({\rm{Na}},{\rm{Mg}},{\rm{Al}},{\rm{Zn}},{\rm{Fe}}\) D. \({\rm{Fe}},{\rm{Zn}},{\rm{Na}},{\rm{Al}},{\rm{Mg}}\) Phương pháp giải Dựa vào dãy hoạt động kim loại Lời giải chi tiết Đáp án A Câu 13: Dãy chất gồm các oxit bazơ là: A. \({\rm{CuO, NO, MgO, CaO}}\) B. \({\rm{CuO, CaO, MgO, N}}{{\rm{a}}_{\rm{2}}}{\rm{O}}\) C. \({\rm{CaO, C}}{{\rm{O}}_{\rm{2}}}{\rm{, }}{{\rm{K}}_{\rm{2}}}{\rm{O, N}}{{\rm{a}}_{\rm{2}}}{\rm{O}}\) D. \({{\rm{K}}_{\rm{2}}}{\rm{O, FeO, }}{{\rm{P}}_{\rm{2}}}{{\rm{O}}_{\rm{5}}}{\rm{, M}}{{\rm{n}}_{\rm{2}}}{{\rm{O}}_{\rm{7}}}\) Phương pháp giải Oxit bazo là hợp chất của kim loại và oxi Lời giải chi tiết Đáp án B Câu 14: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit? A. \({\rm{C}}{{\rm{O}}_{\rm{2}}}\) B. \({\rm{S}}{{\rm{O}}_{\rm{2}}}\) C. \({{\rm{N}}_{\rm{2}}}\) D. \({{\rm{O}}_{\rm{3}}}\) Lời giải chi tiết SO2 và NO2 là oxit axit nguyên nhân chính gây mưa axit Đáp án B Câu 15: Cho 0,1 mol kim loại kẽm vào dung dịch \({\rm{HCl}}\) dư. Khối lượng muối thu được là: A. 20,4 B. 1,36 g C. 13,6 g D. 27,2 g Phương pháp giải Dựa vào phản ứng của kẽm và dung dịch HCl Lời giải chi tiết Zn + 2HCl \( \to \) ZnCl2 + H2 0,1 0,1 m muối = 0,1 . 136 = 13,6g Đáp án C Câu 16: Phản ứng nào dưới đây là phản ứng trao đổi? A. \({\rm{2Na + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{2NaOH + }}{{\rm{H}}_{\rm{2}}}\) B. \({\rm{BaO + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Ba}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}\) C. \({\rm{Zn + }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{ ZnS}}{{\rm{O}}_{\rm{4}}}{\rm{\; + }}{{\rm{H}}_{\rm{2}}}\) D. \({\rm{BaC}}{{\rm{l}}_{\rm{2}}}{\rm{\; + }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{\;}} \to {\rm{ BaS}}{{\rm{O}}_{\rm{4}}}{\rm{\; + 2HCl}}\) Lời giải chi tiết Đáp án D Câu 17: Khi thả một cây đinh sắt sạch vào dung dịch \({\rm{CuS}}{{\rm{O}}_{\rm{4}}}\) loãng, có hiện tượng sau: A. Sủi bọt khí, màu xanh của dung dịch nhạt dần. B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần. C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu. D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần Phương pháp giải Fe có thể đẩy được Cu ra khỏi dung dịch muối Lời giải chi tiết Có một lớp đồng màu đỏ phủ lên đinh sắt, mày xanh của dung dịch nhạt dần Đáp án D Câu 18: Có một mẫu \({\rm{Fe}}\) bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với: A. Dung dịch \({\rm{NaOH}}\) dư B. Dung dịch \({{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\) loãng C. Dung dịch \({\rm{HCl}}\) dư D. Dung dịch \({\rm{HN}}{{\rm{O}}_{\rm{3}}}{\rm{\;}}\)loãng Phương pháp giải Cho hỗn hợp vào dung dịch chỉ tác dụng với Al mà không phản ứng với Fe Lời giải chi tiết Al có thể phản ứng với dung dịch bazo và axit nên cho mẫu Fe lẫn nhôm vào dung dịch NaOH Đáp án A Câu 19: Dãy phi kim tác dụng với oxi tạo thành oxit axit là: A. \({\rm{S, C, P}}\) B. \({\rm{S, C, C}}{{\rm{l}}_{\rm{2}}}\) C. \({\rm{C, P, B}}{{\rm{r}}_{\rm{2}}}\) D. \({\rm{C, C}}{{\rm{l}}_{\rm{2}}}{\rm{, B}}{{\rm{r}}_{\rm{2}}}\) Lời giải chi tiết S, C, P khi tác dụng với oxi tạo ra SO2, CO2, P2O5 là các oxit axit Đáp án A Câu 20: X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65%. X là nguyên tố: A. C B. S C. N D. P Phương pháp giải Dựa vào % khối l ượng của hidro để xác định nguyên tố Lời giải chi tiết Gọi công thức tổng quát là XH3 %H = \(\frac{{1.3}}{{x + 3}}.100 = 17,65\% \to X = 14(N)\) Đáp án C
II. TỰ LUẬN Câu 1:( 2,5đ) Hoàn thành chuçi phản ứng hóa học sau? Lời giải chi tiết (1) 2Fe + 3Cl2 → 2FeCl3 (2) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (3) 2Fe(OH)3 → Fe2O3 + 3H2O (4) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O (5) Fe2(SO4)3 + 3BaCl2→ 3BaSO4 + 2FeCl3
Câu 2: (1,5đ) Có 3 lọ đựng các dung dịch bị mất nhãn sau: HCl, H2SO4, NaOH. Bằng phương pháp hoá học hãy nhận biết các dung dịch trên. Viết phương trình hoá học. Lời giải chi tiết Lấy mỗi chất một ít ra làm thí nghiệm, đánh số thưc tự. Nhỏ mỗi chất trên vào quỳ tím, nếu quỳ tím chuyển màu đỏ là HCl, H2SO4, màu xanh là NaOH. Nhận biết 2 axit bằng cách cho tác dụng với BaCl2 dung dịch nào phản ứng xuất hiện chất không tan màu trắng là H2SO4 , còn lại là HCl. PTHH: H2SO4 + BaCl2 → BaSO4 + 2HCl Câu 3: (3đ) Cho 30g hỗn hợp hai kim loại sắt và đồng tác dụng với dd HCl dư. Sau khi phản ứng xong thu được chất rắn A và 6,72l khí (ở đktc) Viết phương trình phản ứng hóa học xảy ra. Tính thành phần trăm theo khối lượng của hỗn hợp ban đầu. Lời giải chi tiết nH2 = 6,72:22,4 = 0,3 mol PTHH: Fe + 2HCl → FeCl2 + H2 Theo PT 1 mol : 1 mol Theo đb 0,3 mol : 0,3 mol mFe = 0,3.56 = 16,8 g %Fe = 16,8 x 100 : 30 = 56 % %Cu = 100 – 56 = 44%
|














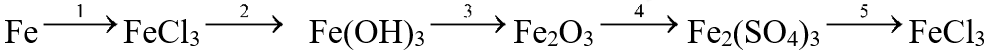






Danh sách bình luận