Đề thi giữa kì 2 Hóa 12 - Đề số 3Đề bài
Câu 1 :
Cấu hình electron của Ni (Z = 28) là
Câu 2 :
Đốt cháy hoàn toàn bột crom trong oxi (dư) thu được 4,56 gam một oxit (duy nhất). Khối lượng crom bị đốt cháy là
Câu 3 :
Điện phân một dung dịch gồm a mol CuSO4 và b mol NaCl. Nếu b > 2a mà ở catot chưa có khí thoát ra thì dung dịch sau điện phân chứa
Câu 4 :
Các kim loại nào sau đây luôn được bảo vệ trong môi trường không khí, nước nhờ lớp màng oxit?
Câu 5 :
Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
Câu 6 :
So với nguyên tử canxi, nguyên tử kali có
Câu 7 :
Dùng m gam Al để khử hết 1,6 gam Fe2O3 đến khi phản ứng hoàn toàn, sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 0,672 lít khí (đktc). Tính m?
Câu 8 :
Hoà tan hoàn toàn 3 kim loại Zn, Fe, Cu bằng dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn không tan là Cu. Các chất tan có trong dung dịch sau phản ứng là
Câu 9 :
Để hoàn tan hoàn toàn 9,6 gam Cu cần dùng 500 ml dung dịch HNO3 (lấy dư 25% so với lượng cần thiết), thu được khí NO duy nhất. Nồng độ mol của dung dịch HNO3 đã dùng là
Câu 10 :
Hỗn hợp X chứa một oxit sắt; 0,02 mol Cr2O3 và 0,04 mol Al. Thực hiện phản ứng nhiệt nhôm hỗn hợp X sau một thời gian thu được hỗn hợp chất rắn Y. Chia Y thành 2 phần bằng nhau. Phần 1 tác dụng với H2SO4 đặc, nóng dư thu được 0,896 lít SO2 (đktc, sản phẩm khử duy nhất). Phần 2 tác dụng vừa đủ với 250 ml dung dịch HCl 1M thu được dung dịch Z và 0,336 lít khí H2 (đktc). Dung dịch Z tác dụng tối đa với z mol NaOH thu được 6,6 gam hỗn hợp kết tủa. Biết các phản ứng xảy ra trong môi trường không có oxi. Giá trị của z gần nhất với
Câu 11 :
Khi điện phân điện cực trơ có màng ngăn dung dịch hỗn hợp gồm NaCl và CuSO4 đến khi NaCl và CuSO4 đều hết nếu dung dịch sau điện phân hoà tan được Fe và sinh khí thì dung dịch sau điện phân chắc chắn chứa
Câu 12 :
Cho Al đến dư vào dung dịch gồm NO3-, Cu2+, Fe3+, Ag+. Số phản ứng xảy ra (không kể phản ứng của Al với H2O) là
Câu 13 :
Cho hỗn hợp bột gồm 0,56 gam Fe và 0,65 gam Zn vào V ml dung dịch AgNO3 0,1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được chất rắn có khối lượng tăng 2,31 gam so với ban đầu. Giá trị của V là
Câu 14 :
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy điện hoá : Fe3+/Fe2+ đứng trước Ag+/Ag)
Câu 15 :
lon Mg2+ bị khử trong trường hợp
Câu 16 :
Chọn X, Y, Z, T, E theo đúng trật tự tương ứng sơ đồ sau : X → Y → Z → T → E
Câu 17 :
Chọn phát biểu sai:
Câu 18 :
Nhiệt phân hoàn toàn 34,65 gam hỗn hợp gồm KNO3 và Cu(NO3)2, thu được hỗn hợp khí X có tỉ khối so với khí hiđro bằng 18,8. Khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Câu 19 :
Từ hai muối X và Y thực hiện các phản ứng sau: X → X1 + CO2 X1 + H2O → X2 X2 + Y → X + Y1 + H 2O X2 + 2Y → X + Y2 + H2O Hai muối X, Y tương ứng là
Câu 20 :
Hòa tan 5,9 gam hỗn hợp X gồm K và Ca vào nước dư, sau phản ứng thu được 2,24 lít khí H2. Khối lượng Ca có trong hỗn hợp X là
Câu 21 :
Kim loại nào sau đây bị thụ động hóa với dung dịch axit sunfuric đặc nguội?
Câu 22 :
Cho m gam K tan hết vào 100 ml dung dịch gồm (H2SO4 1M và HCl 2M) thu được 5,6 lít khí H2 (ở đktc). Cô cạn dung dịch sau phản ứng khối lượng chất rắn thu được là
Câu 23 :
Ion kim loại nào sau đây không bị Zn khử thành kim loại ?
Câu 24 :
Hỗn hợp bột X gồm BaCO3, Fe(OH)2, Al(OH)3, Fe2O3 . Nung X trong không khí đến khối lượng không đối được hỗn hợp rắn A. Cho A vào nước dư khuấy đều được dung dịch B chứa 2 chất tan và phần không tan C. Cho khí CO dư qua bình chứa C nung nóng được hỗn hợp rắn E (Cho các phản ứng xảy ra hoàn toàn). E có thể chứa tối đa sản phẩm là
Câu 25 :
Cho lá Mg vào dung dịch HCl, có khí thoát ra. Thêm vài giọt X vào thì tốc độ thoát khí lớn hơn. X là?
Câu 26 :
Khi cho mẫu Zn vào bình đựng dung dịch X, thì thấy khối lượng thanh Zn trong giảm đi (giả thiết kim loại sinh ra bám hết trên thanh Zn). Dung dịch X là:
Câu 27 :
Cho 12,04 gam hỗn hợp rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,42 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa NH4+) và 0,045 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát ra 0,0075 mol NO (sản phẩm khử duy nhất của N+5), đồng thời thu được 70,8 gam kết tủa. Phần trăm khối lượng Fe trong hỗn hợp X có giá trị gần nhấtvới giá trị nào sau đây?
Câu 28 :
Hòa tan hoàn toàn x mol Fe vào dung dịch chứa y mol Fe2(SO4)3 và z mol H2SO4, thu được dung dịch chỉ chứa một chất tan duy nhất. Biểu thức liên hệ giữa x, y và z là
Câu 29 :
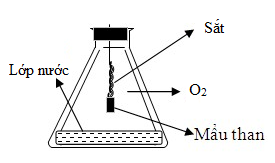
Phản ứng của Fe với O2 như hình vẽ
Cho các phát biểu sau đây: (a) Vai trò của mẩu than để làm mồi cung cấp nhiệt cho phản ứng. (b) Phản ứng tỏa nhiều nhiệt làm đầu dây sắt nóng chảy có thể thành cục tròn. (c) Vai trò của lớp nước ở đáy bình là để tránh vỡ bình. (d) Phản ứng cháy sáng, có các tia lửa bắn ra từ dây sắt. Số phát biểu sai là
Câu 30 :
Hòa tan hết a mol FeCO3 vào dung dịch HCl (lấy dư 10% so với lượng cần dùng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào dung dịch X thu được b gam kết tủa. Biết sản phẩm khử của N+5 là khí NO duy nhất, các phản ứng đều xảy ra hoàn toàn. Biểu thức về mối quan hệ giữa a và b là
Câu 31 :
Ở trạng thái cơ bản, nguyên tử Al (Z = 13) có số electron lớp ngoài cùng là
Câu 32 :
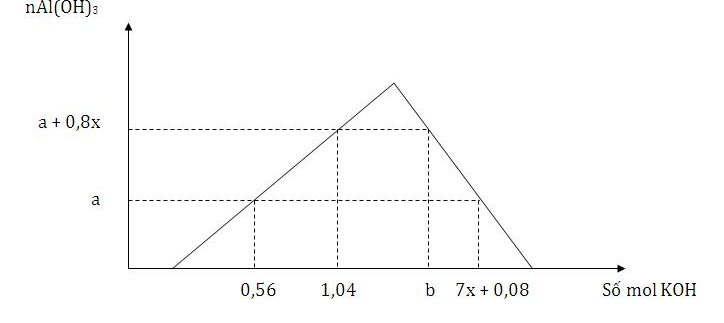
Cho từ từ đến dư dung dịch KOH vào dung dịch hỗn hợp x mol HNO3 và y mol Al(NO3)3, kết quả thí nghiệm được biểu diễn trên đồ thị sau Tỉ lệ của b : a có giá trị là
Câu 33 :
Phương pháp thường được áp dụng để chống ăn mòn kim loại là
Câu 34 :
Đun 0,04 mol hỗn hợp gồm hơi nước và khí CO2 qua cacbon nung đỏ, thu được 0,07 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng 20 gam hỗn hợp gồm Fe2O3 và CuO (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là
Câu 35 :
Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3 vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2 bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Câu 36 :
Khi nung hỗn hợp các chất Fe(NO3)2, Fe(OH)3 và FeCO3 trong không khí đến khối lượng không đổi, thu được một chất rắn là
Câu 37 :
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng ( dư),thu được dung dịch X. Trong các chất: NaOH, Cu, KNO3, KMnO4, BaCl2, Cl2, Al, NaCl, số chất có khả năng phản ứng được với dung dịch X là
Câu 38 :
Loại quặng sắt dùng để sản xuất gang thường chứa từ 30 - 95% oxit sắt và phải
Câu 39 :
Chất nào sau đây được dùng để làm mềm nước cứng vĩnh cửu?
Câu 40 :
Ở điều kiện thường, kim loại nào sau đây không tan được trong dung dịch NaOH?
Lời giải và đáp án
Câu 1 :
Cấu hình electron của Ni (Z = 28) là
Đáp án : A Phương pháp giải :
Xem lại lí thuyết một số kim loại khác Lời giải chi tiết :
Cấu hình electron của Ni là [Ar]3d84s2
Câu 2 :
Đốt cháy hoàn toàn bột crom trong oxi (dư) thu được 4,56 gam một oxit (duy nhất). Khối lượng crom bị đốt cháy là
Đáp án : B Phương pháp giải :
Cr tác dụng với O2 lên số oxi hóa +3 Lời giải chi tiết :
${n}_{C{{\text{r}}_{2}}{{\text{O}}_{3}}}=\frac{4,56}{152}=0,03(mol)$ 4Cr + 3O2 → 2Cr2O3 0,06 0,03 => mCr = 0,06.52 = 3,12 (g)
Câu 3 :
Điện phân một dung dịch gồm a mol CuSO4 và b mol NaCl. Nếu b > 2a mà ở catot chưa có khí thoát ra thì dung dịch sau điện phân chứa
Đáp án : D Phương pháp giải :
xem lại lí thuyết điện phân hỗn hợp Lời giải chi tiết :
Catot (-) Cu2+, Na+, H2O Anot (+) SO42- , Cl-, H2O (1) Cu2+ + 2e → Cu (1) 2Cl- → Cl2 + 2e a → 2a → a b → b/2 → b Vì catot chưa có khí thoát ra và b>2a => Dung dịch sau điện phân chứa: Na+, SO42-, Cu2+, Cl-.
Câu 4 :
Các kim loại nào sau đây luôn được bảo vệ trong môi trường không khí, nước nhờ lớp màng oxit?
Đáp án : C Phương pháp giải :
Xem lại lí thuyết crom và hợp chất Lời giải chi tiết :
Các kim loại luôn được bảo vệ trong môi trường không khí, nước nhờ lớp màng oxit là Al và Cr
Câu 5 :
Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
Đáp án : C Phương pháp giải :
+) nOH > 2nCO2=> OH‑ dư => nCO3 = nCO2 = 0,015 mol Và nOH- dư = nOH- ban đầu – nOH- phản ứng = nOH- ban đầu -$2{n_{CO_3^{2 - }}}$ +) mrắn = mNa + mK + mCO3 + mOH dư Lời giải chi tiết :
nCO2 = 0,015 mol; nOH = nNaOH + nKOH = 0,04 mol > 2nCO2 => OH‑ dư => nCO3 = nCO2 = 0,015 mol Và nOH- dư = nOH- ban đầu – nOH- phản ứng = nOH- ban đầu -$2{n_{CO_3^{2 - }}}$= 0,01 mol => mrắn = mNa + mK + mCO3 + mOH dư = 2,31 gam
Câu 6 :
So với nguyên tử canxi, nguyên tử kali có
Đáp án : B Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
So với nguyên tử canxi, nguyên tử K có bán kính lớn hơn và độ âm điện nhỏ hơn
Câu 7 :
Dùng m gam Al để khử hết 1,6 gam Fe2O3 đến khi phản ứng hoàn toàn, sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 0,672 lít khí (đktc). Tính m?
Đáp án : A Phương pháp giải :
${n_{Al}}$dư$ = \,\,\frac{2}{3}{n_{{H_2}}} = 0,02\,\,mol$ Fe2O3 + 2Al $\xrightarrow{{{t^o}}}$ 2Fe + Al2O3 0,01 → 0,02 → mAl = m = (0,02 + 0,02).27 = 1,08 gam Lời giải chi tiết :
${n_{F{e_2}{O_3}}} = 0,01\,\,mol;\,\,{n_{{H_2}}} = 0,03\,\,mol$ ${n_{Al}}$dư$ = \,\,\frac{2}{3}{n_{{H_2}}} = 0,02\,\,mol$ Fe2O3 + 2Al $\xrightarrow{{{t^o}}}$ 2Fe + Al2O3 0,01 → 0,02 → mAl = m = (0,02 + 0,02).27 = 1,08 gam
Câu 8 :
Hoà tan hoàn toàn 3 kim loại Zn, Fe, Cu bằng dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn không tan là Cu. Các chất tan có trong dung dịch sau phản ứng là
Đáp án : D Lời giải chi tiết :
Sau phản ứng thu được chất rắn không tan là Cu → trong dung dịch không còn muối Fe(NO3)3
Câu 9 :
Để hoàn tan hoàn toàn 9,6 gam Cu cần dùng 500 ml dung dịch HNO3 (lấy dư 25% so với lượng cần thiết), thu được khí NO duy nhất. Nồng độ mol của dung dịch HNO3 đã dùng là
Đáp án : C Phương pháp giải :
Bảo toàn e: 2nCu = 3nNO +) nHNO3 phản ứng = 4nNO +) HNO3 lấy dư 25% => nHNO3 ban đầu = 0,4.1,25 Lời giải chi tiết :
nCu = 0,15 mol Bảo toàn e: 2nCu = 3nNO => nNO = 0,1 mol => nHNO3 phản ứng = 4nNO = 4.0,1 = 0,4 mol HNO3 lấy dư 25% => nHNO3 ban đầu = 0,4.1,25 = 0,5 mol => CM HNO3 = 0,5 / 0,5 = 1M
Câu 10 :
Hỗn hợp X chứa một oxit sắt; 0,02 mol Cr2O3 và 0,04 mol Al. Thực hiện phản ứng nhiệt nhôm hỗn hợp X sau một thời gian thu được hỗn hợp chất rắn Y. Chia Y thành 2 phần bằng nhau. Phần 1 tác dụng với H2SO4 đặc, nóng dư thu được 0,896 lít SO2 (đktc, sản phẩm khử duy nhất). Phần 2 tác dụng vừa đủ với 250 ml dung dịch HCl 1M thu được dung dịch Z và 0,336 lít khí H2 (đktc). Dung dịch Z tác dụng tối đa với z mol NaOH thu được 6,6 gam hỗn hợp kết tủa. Biết các phản ứng xảy ra trong môi trường không có oxi. Giá trị của z gần nhất với
Đáp án : D Lời giải chi tiết :
Phần 1 : H2SO4 nhận e, Al và FexOy cho e Bảo toàn e : 2.nSO2 = 3nAl + ne cho oxit sắt => ne cho oxit sắt = 2.0,04 – 0,02.3 = 0,02 Ta thấy : nếu oxit sắt là FeO thì nFeO = ne cho oxit sắt Nếu oxit sắt là Fe2O3 thì không cho e Nếu oxit sắt là Fe3O4 thì nFe3O4 = ne cho oxit sắt => nFexOy = 0,02 mol Phần 2 : Bảo toàn nguyên tố H : ${{n}_{HCl}}=2{{n}_{{{H}_{2}}}}+2{{n}_{{{H}_{2}}O}}\to \,\,{{n}_{{{H}_{2}}O}}=\frac{0,25-2.0,015}{2}=0,11\,\,mol$ Bảo toàn nguyên tố O : nO trong oxit sắt + $3{{n}_{C{{\text{r}}_{2}}{{O}_{3}}}}={{n}_{{{H}_{2}}O}}$=> nO trong oxit sắt = 0,11 – 3.0,01 = 0,08 mol => y = $\frac{{{n}_{O\,\,trong\,\text{ox}it}}}{{{n}_{F{{e}_{x}}{{O}_{y}}}}}=\frac{0,08}{0,02}=4$ → oxit sắt là Fe3O4 Vì dung dịch Z phản ứng tối đa với NaOH nên kết tủa Al(OH)3 và Cr(OH)3 đều tan hết → dung dịch tạo thành chứa : $N{{a}^{+}}\,\,(z\text{ }mol);\text{ }C{{l}^{-}}\,\,(0,25\,\,mol);\text{ }AlO_{2}^{-}\text{ (0,02}\,\,\text{mol); }CrO_{2}^{-}\text{ (a}\,\,\text{mol)}$ Bảo toàn điện tích : z = 0,25 + 0,02 + a (1) Bảo toàn Cr : $2{{n}_{C{{\text{r}}_{2}}{{O}_{3}}}}={{n}_{C\text{r}O_{2}^{-}}}+{{n}_{\text{Cr}{{(OH)}_{2}}}}\to {{n}_{C\text{r}{{(OH)}_{2}}}}=2.0,01-a=0,02-a$ Bảo toàn Fe : nFe trong kết tủa = 3.nFe3O4 = 0,06 => mkết tủa = mCr + mFe + mOH → mOH = 6,6 – 52.(0,02 – a) – 0,06.56 = 2,2 +52a $=>\,\,{{n}_{OH}}=\frac{2,2+52a}{17}\,\,mol$ => nNaOH = nOH trong kết tủa + 4.nAl(OH)3 + 4.nCr(OH)3 => z $=\frac{2,2+52a}{17}\,+\text{ }4.0,02\text{ }+\text{ }4a\text{ }\left( 2 \right)$ Giải hệ (1), (2) → z = 0,28; a = 0,01
Câu 11 :
Khi điện phân điện cực trơ có màng ngăn dung dịch hỗn hợp gồm NaCl và CuSO4 đến khi NaCl và CuSO4 đều hết nếu dung dịch sau điện phân hoà tan được Fe và sinh khí thì dung dịch sau điện phân chắc chắn chứa
Đáp án : D Lời giải chi tiết :
Ta thấy khi điện phân hết NaCl và CuSO4 thì chỉ có Cu2+ và Cl- bị điện phân hết tạo Cu và Cl2 .Mà dung dịch sau điện phân hòa tan được Fe và sinh khí => dung dịch sau điện phân chứa axit => dung dịch chắc chắn chứa H2SO4 (vì SO42- không bị điện phân)
Câu 12 :
Cho Al đến dư vào dung dịch gồm NO3-, Cu2+, Fe3+, Ag+. Số phản ứng xảy ra (không kể phản ứng của Al với H2O) là
Đáp án : A Phương pháp giải :
xem lại lí thuyết nhôm Lời giải chi tiết :
Al + 3Ag+ → Al3+ + Ag Al + 3Fe3+ → Al3+ + 3Fe2+ 2Al + 3Cu2+ → 2Al3+ + 3Cu 2Al + 3Fe2+ → 2Al3+ + 3Fe
Câu 13 :
Cho hỗn hợp bột gồm 0,56 gam Fe và 0,65 gam Zn vào V ml dung dịch AgNO3 0,1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được chất rắn có khối lượng tăng 2,31 gam so với ban đầu. Giá trị của V là
Đáp án : C Phương pháp giải :
+) Giả sử Ag+ phản ứng hết với Zn2+ và Fe2+ => ne cho tối đa = 0,01.2 + 0,01.2 = 0,04 mol => nAg+ = 0,04mol => m tăng = 3,11g > 2,31g => Ag+ hết, kim loại dư +) Giả sử Ag+ phản ứng hết với Zn2+ Zn + 2Ag+ → 2Ag + Zn2+ => m tăng = 1,51g < 2,31 => Vẫn còn phản ứng Fe + 2Ag+ → Fe2+ + 2Ag x 2x 2x => m tăng = 2,31 – 1,51 = >x => nAg+ => V Lời giải chi tiết :
nFe = 0,01mol; nZn = 0,01mol => n e cho tối đa = 0,01.2 + 0,01.2 = 0,04 mol => nAg+ = 0,04mol => m tăng = 0,04 . 108 – (0,56 + 0,65) = 3,11g > 2,31g => Ag+ hết, kim loại dư Zn + 2Ag+ → 2Ag + Zn2+ 0,01 0,02 0,02 => m tăng = 0,02 . 108 – 0,01 . 65 = 1,51g < 2,31 => còn phản ứng Fe + 2Ag+ → Fe2+ + 2Ag x 2x 2x => m tăng = 2,31 – 1,51 = 108 . 2x – 56x => x = 0,005 => nAg+ = 0,03mol => V = 0,3lít = 300 ml
Câu 14 :
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy điện hoá : Fe3+/Fe2+ đứng trước Ag+/Ag)
Đáp án : C Phương pháp giải :
Sử dụng dãy điện hóa Lời giải chi tiết :
X là kim loại phản ứng được với dung dịch H2SO4 → X có tính khử mạnh hơn H+ trong dãy điện hóa → loại đáp án A và B Y là kim loại tác dụng được với dung dịch Fe(NO3)3 → Y có tính khử mạnh hơn Fe3+ trong dãy điện hóa → loại đáp án D Phương trình phản ứng : Fe + H2SO4 → FeSO4 + H2 Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Câu 15 :
lon Mg2+ bị khử trong trường hợp
Đáp án : B Lời giải chi tiết :
lon Mg2+ bị khử trong trường hợp : Điện phân MgCl2 nóng chảy.
Câu 16 :
Chọn X, Y, Z, T, E theo đúng trật tự tương ứng sơ đồ sau : X → Y → Z → T → E
Đáp án : D Phương pháp giải :
xem lại lí thuyết hợp chất nhôm Lời giải chi tiết :
Trật tự đúng là: AlCl3 →NaAlO2 →Al(OH)3 →Al2O3→Al2(SO4)3. A, B sai vì từ NaAlO2 không tạo trực tiếp được Al2O3 C sai vì từ AlCl3 không điều chế trực tiếp được ra Al2O3
Câu 17 :
Chọn phát biểu sai:
Đáp án : D Phương pháp giải :
Xem lại lí thuyết crom và hợp chất Lời giải chi tiết :
Phát biểu sai là: Cr(OH)2 là chất rắn màu trắng xanh Vì Cr(OH)2 là chất rắn màu vàng
Câu 18 :
Nhiệt phân hoàn toàn 34,65 gam hỗn hợp gồm KNO3 và Cu(NO3)2, thu được hỗn hợp khí X có tỉ khối so với khí hiđro bằng 18,8. Khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Đáp án : A Phương pháp giải :
$\left\{\begin{gathered}101{\text{x}}+188y=34,65 \hfill \\\frac{{(0,5{\text{x}} + 0,5y).32 + 2y.46}}{{0,5{\text{x}} + 0,5y + 2y}} = 18,8.2 \hfill \\ \end{gathered} \right.$ Lời giải chi tiết :
2KNO3 → 2KNO2 + O2 x → 0,5x 2Cu(NO3)2 → 2CuO + 4NO2 + O2 y → 2y → 0,5y Ta có hệ phương trình: $\left\{ \begin{gathered} 101{\text{x}} + 188y = 34,65 \hfill \\ \frac{{(0,5{\text{x}} + 0,5y).32 + 2y.46}}{{0,5{\text{x}} + 0,5y + 2y}} = 18,8.2 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered} x = 0,25 \hfill \\ y = 0,05 \hfill \\ \end{gathered} \right.$ => mCu(NO3)2 = 0,05.188 = 9,4 gam Chú ý
lấy nhầm số mol KNO3 => chọn nhầm D
Câu 19 :
Từ hai muối X và Y thực hiện các phản ứng sau: X → X1 + CO2 X1 + H2O → X2 X2 + Y → X + Y1 + H 2O X2 + 2Y → X + Y2 + H2O Hai muối X, Y tương ứng là
Đáp án : C Lời giải chi tiết :
X là CaCO3, Y là NaHCO3. CaCO3 $\xrightarrow{{{t^ \circ }}}$ CaO + CO2↑ X X1 CaO + H2O $\xrightarrow{{}}$ Ca(OH)2 X2 Ca(OH)2 + NaHCO3 $\xrightarrow{{}}$ CaCO3 + NaOH + H2O Y Y1 Ca(OH)2 + 2NaHCO3 $\xrightarrow{{}}$ CaCO3 + Na2CO3 + 2H2O Y Y2
Câu 20 :
Hòa tan 5,9 gam hỗn hợp X gồm K và Ca vào nước dư, sau phản ứng thu được 2,24 lít khí H2. Khối lượng Ca có trong hỗn hợp X là
Đáp án : B Phương pháp giải :
Bảo toàn electron: nK + 2nCa = 2nH2 Lời giải chi tiết :
Gọi nK = x mol; nCa = y mol => mhỗn hợp = 39x + 40y = 5,9 (1) Bảo toàn electron: nK + 2nCa = 2nH2 => x + 2y = 0,1.2 (2) Từ (1), (2) => x = 0,1; y = 0,05 => mca = 2 gam
Câu 21 :
Kim loại nào sau đây bị thụ động hóa với dung dịch axit sunfuric đặc nguội?
Đáp án : D Lời giải chi tiết :
Al, Fe, Cr không tác dụng với H2SO4 đặc nguội và HNO3 đặc nguội (xem lại lí thuyết chung về kim loại)
Câu 22 :
Cho m gam K tan hết vào 100 ml dung dịch gồm (H2SO4 1M và HCl 2M) thu được 5,6 lít khí H2 (ở đktc). Cô cạn dung dịch sau phản ứng khối lượng chất rắn thu được là
Đáp án : B Phương pháp giải :
+) nH2 = 0,4 mol >\({1 \over 2}{n_{{H^ + }}}\)=> sau khi phản ứng với axit, K phản ứng với nước sinh ra H2 2K + 2H+ → 2K+ + H2 2K + H2O → 2KOH + H2 +) mcrắn khan = \({m_{{K^ + }}}\)trong muối +\({m_{C{l^ - }}} + {m_{SO_4^{2 - }}} + {m_{KOH}}\) Lời giải chi tiết :
nH2SO4 = 0,1 mol; nHCl = 0,2 mol=> nH+ = 0,1.2 + 0,2 = 0,4 nH2 = 0,25 mol >\({1 \over 2}{n_{{H^ + }}}\)=>sau khi phản ứng với axit, K phản ứng với nước sinh ra H2 2K+ 2H+ → 2K+ + H2 0,4 ← 0,4 → 0,4 → 0,2 2K+ H2O → 2KOH + H2 0,1 ←0,1 ← 0,05 => mcrắn khan = \({m_{{K^ + }}}\)trong muối +\({m_{C{l^ - }}} + {m_{SO_4^{2 - }}} + {m_{KOH}}\)= 0,4.39 + 0,1.96 + 0,2.35,5 + 0,1.56 = 37,9 gam
Câu 23 :
Ion kim loại nào sau đây không bị Zn khử thành kim loại ?
Đáp án : D Phương pháp giải :
xem lại lí thuyết điều chế kim loại Lời giải chi tiết :
Các ion kim loại nào sau đây không bị Zn khử là những kim loại đứng trước Zn: Al3+.
Câu 24 :
Hỗn hợp bột X gồm BaCO3, Fe(OH)2, Al(OH)3, Fe2O3 . Nung X trong không khí đến khối lượng không đối được hỗn hợp rắn A. Cho A vào nước dư khuấy đều được dung dịch B chứa 2 chất tan và phần không tan C. Cho khí CO dư qua bình chứa C nung nóng được hỗn hợp rắn E (Cho các phản ứng xảy ra hoàn toàn). E có thể chứa tối đa sản phẩm là
Đáp án : C Phương pháp giải :
xem lại lí thuyết điều chế kim loại Lời giải chi tiết :
Câu 25 :
Cho lá Mg vào dung dịch HCl, có khí thoát ra. Thêm vài giọt X vào thì tốc độ thoát khí lớn hơn. X là?
Đáp án : B Lời giải chi tiết :
Khi thêm vài giọt FeCl2 vào dung dịch sẽ hình thành cặp pin điện hóa Mg-Fe làm cho khí thoát ra nhanh hơn
Câu 26 :
Khi cho mẫu Zn vào bình đựng dung dịch X, thì thấy khối lượng thanh Zn trong giảm đi (giả thiết kim loại sinh ra bám hết trên thanh Zn). Dung dịch X là:
Đáp án : A Phương pháp giải :
tăng giảm khối lượng Lời giải chi tiết :
Khối lượng thanh Zn giảm => khối lượng kim loại tạo ra nhỏ hơn Zn => loại B vì Mkim loại > MZn Loại C, D vì Zn không đẩy được Ba2+ và Na+
Câu 27 :
Cho 12,04 gam hỗn hợp rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,42 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa NH4+) và 0,045 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát ra 0,0075 mol NO (sản phẩm khử duy nhất của N+5), đồng thời thu được 70,8 gam kết tủa. Phần trăm khối lượng Fe trong hỗn hợp X có giá trị gần nhấtvới giá trị nào sau đây?
Đáp án : A Phương pháp giải :
Bảo toàn electron Bảo toàn điện tích Bảo toàn nguyên tố Fe, H, O +) Phần kết tủa có AgCl => nAg +) Bảo toàn electron: nFe2+ = nAg + 3 nNO +) nH+ dư = 4.nNO Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X => mX = PT (1) Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết. +) Bảo toàn điện tích => nFe3+ +) Bảo toàn Fe => PT (2) Bảo toàn H => nH2O Bảo toàn O: 4. nFe3O4 + 6 nFe(NO3)2 + 3 nHNO3 = nZ + nH2O => PT (3) Giải hệ (1),(2),(3) => a; b; c Lời giải chi tiết :
Phần kết tủa có nAgCl = 0,42 => nAg = 0,0975 Bảo toàn electron: nFe2+ = nAg + 3 nNO = 0,12 nNO = 0,0075 => nH+ dư = 4.nNO = 0,03 Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X => mX = 56a + 232b + 180c = 12,04 (1) Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết. Vậy Y chứa Fe2+ (0,12 mol), H+ (0,03 mol), Cl- (0,42 mol), Fe3+ Bảo toàn điện tích => nFe3+ = 0,05 Bảo toàn Fe => a + 3b + c = 0,05 + 0,12 (2) Bảo toàn H => nH2O = 0,215 Bảo toàn O: 4. nFe3O4 + 6 nFe(NO3)2 + 3 nHNO3 = nZ + nH2O => 4b + 6c + 0,04.3 = 0,215 + 0,045 (3) Giải hệ (1),(2),(3) => a = 0,1 mol; b = 0,02 mol; c = 0,01 mol => %mFe = 46,51%
Câu 28 :
Hòa tan hoàn toàn x mol Fe vào dung dịch chứa y mol Fe2(SO4)3 và z mol H2SO4, thu được dung dịch chỉ chứa một chất tan duy nhất. Biểu thức liên hệ giữa x, y và z là
Đáp án : A Phương pháp giải :
Sử dụng phương pháp bảo toàn e Lời giải chi tiết :
Dung dịch chỉ chứa một chất tan duy nhất là muối FeSO4 \(\eqalign{ Bảo toàn electron: 2x = 2y +2z => x = y + z
Câu 29 :
Phản ứng của Fe với O2 như hình vẽ
Cho các phát biểu sau đây: (a) Vai trò của mẩu than để làm mồi cung cấp nhiệt cho phản ứng. (b) Phản ứng tỏa nhiều nhiệt làm đầu dây sắt nóng chảy có thể thành cục tròn. (c) Vai trò của lớp nước ở đáy bình là để tránh vỡ bình. (d) Phản ứng cháy sáng, có các tia lửa bắn ra từ dây sắt. Số phát biểu sai là
Đáp án : B Phương pháp giải :
Dựa vào kiến thức phản ứng đốt cháy của Fe với O2 Lời giải chi tiết :
Tất cả các đáp án đều đúng → có 0 phát biểu sai
Câu 30 :
Hòa tan hết a mol FeCO3 vào dung dịch HCl (lấy dư 10% so với lượng cần dùng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào dung dịch X thu được b gam kết tủa. Biết sản phẩm khử của N+5 là khí NO duy nhất, các phản ứng đều xảy ra hoàn toàn. Biểu thức về mối quan hệ giữa a và b là
Đáp án : B Phương pháp giải :
FeCO3 + 2HCl → FeCl2 + H2O + CO2 3Fe+2 + NO3- + 4H+ → 3Fe+3 + 2H2O + NO Fe+2 + Ag+ → Fe+3 + Ag Ag+ + Cl- → AgCl Lời giải chi tiết :
FeCO3 + 2HCl → FeCl2 + H2O + CO2 a 2a a HCl lấy dư 10% nên X có nHCl dư = 0,2a mol → nCl- = 2a + 0,2a = 2,2a mol nFe2+ = a mol; nH+ = 0,2 mol X + AgNO3 thì 3Fe+2 + NO3- + 4H+ → 3Fe+3 + 2H2O + NO 0,15a 0,2a Fe+2 + Ag+ → Fe+3 + Ag 0,85a 0,85a Ag+ + Cl- → AgCl 2,2a 2,2a mol → mkết tủa = mAg + mAgCl = 0,85a. 108 + 2,2a.143,5 = 407,5a = b
Câu 31 :
Ở trạng thái cơ bản, nguyên tử Al (Z = 13) có số electron lớp ngoài cùng là
Đáp án : C Phương pháp giải :
Viết cấu hình e của Al từ đó → tìm e lớp ngoài cùng Lời giải chi tiết :
Al có cấu hình e là 1s22s22p63s23p1 nên lớp ngoài cùng có 3e
Câu 32 :
Cho từ từ đến dư dung dịch KOH vào dung dịch hỗn hợp x mol HNO3 và y mol Al(NO3)3, kết quả thí nghiệm được biểu diễn trên đồ thị sau Tỉ lệ của b : a có giá trị là
Đáp án : D Phương pháp giải :
Thứ tự xảy ra phản ứng KOH + HNO3 → KNO3 + H2O 3KOH + Al(NO3)3 → 3KNO3 + Al(OH)3 KOH + Al(OH)3 → KAlO2 + 2H2O Xét số mol KOH tại các thời điểm Lời giải chi tiết :
KOH + HNO3 → KNO3 + H2O 3KOH + Al(NO3)3 → 3KNO3 + Al(OH)3 KOH + Al(OH)3 → KAlO2 + 2H2O Xét tại các thời điểm +) có 0,56 mol KOH thì chỉ xảy ra 2 phản ứng đầu → nKOH = nHNO3 + 3nAl(OH)3 = x + 3a = 0,56 mol +) có 1,04 mol KOH thì chỉ có 2 phản ứng đầu xảy ra → nKOH = nHNO3 + 3nAl(OH)3 = x + 3(a + 0,8x ) =1,04 → x = 0,2 mol và a = 0,12 mol +) tại thời điểm b mol KOH thì xảy ra cả 3 phản ứng và thu được nAl(OH)3 = a + 0,8x = 0,28 mol → nKOH = nHNO3 + 3nAl(NO3)3 + nAl(OH)3 bị hòa tan = x + 3y + (y – 0,28) =0,2 + 4y – 0,28 = 4y – 0,08 (mol) = b(1) +) tại thời điểm (7x + 0,08) mol KOH hay 1,48 mol KOH thì nAl(OH)3 = 0,12 mol và cả 3 phản ứng xảy ra → nKOH = nHNO3 + 3nAl(NO3)3 + nAl(OH)3 bị hòa tan = x + 3y + (y – 0,12) = 4y + 0,08 = 1,48 → y = 0,35 (2) Từ (1) và (2) suy ra b = 1,32 mol → b : a = 1,32 : 0,12 = 11
Câu 33 :
Phương pháp thường được áp dụng để chống ăn mòn kim loại là
Đáp án : A Lời giải chi tiết :
Các phương pháp bảo vệ kim loại không bị ăn mòn là: + Phương pháp bảo vệ bề mặt. + Phương pháp điện hóa.
Câu 34 :
Đun 0,04 mol hỗn hợp gồm hơi nước và khí CO2 qua cacbon nung đỏ, thu được 0,07 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng 20 gam hỗn hợp gồm Fe2O3 và CuO (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là
Đáp án : C Phương pháp giải :
Sử dụng định luật bảo toàn khối lượng và bảo toàn nguyên tố để giải bài toán Lời giải chi tiết :
\(0,04\left( {mol} \right)X\left\{ \begin{array}{l}{H_2}O\\C{O_2}\end{array} \right. + C \to 0,07\left( {mol} \right)\left\{ \begin{array}{l}CO\\{H_2}\\C{O_2}\end{array} \right. + 30\left( g \right)\left\{ \begin{array}{l}F{{\rm{e}}_2}{O_3}\\CuO\end{array} \right. \to {m_{chat\,ran}} = ?\) Nhận thấy, C là nguyên nhân làm cho số mol hỗn hợp khí tăng lên => nC = 0,07 - 0,04 = 0,03 mol Sau khi cho Y tác dụng với Fe2O3, CuO dư tạo thành H2O, CO2 nên ta có thể coi hỗn hợp Y gồm {H2O, CO2, C} như vậy ta thấy chỉ có C có phản ứng: C + 2O → CO2 => nO(pư) = 2nC = 0,06 mol => m chất rắn = mFe2O3, CuO - mO(pư) = 20 - 0,06.16 = 19,04 gam
Câu 35 :
Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3 vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2 bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Đáp án : B Phương pháp giải :
- Tính lượng khí Cl2, O2 sinh ra sau quá trình điện phân - Áp dụng định luật bảo toàn e, bảo toàn nguyên tố => nCuSO4 ban đầu => m Lời giải chi tiết :
Khí tại anot gồm nCl2 = 0,15 mol; nO2 = 0,05 mol => Bảo toàn nguyên tố Cl => nFeCl3 = 0,1 mol => Dung dịch sau phản ứng có chứa Cu2+ và Fe2+ => Tại catot chỉ có chứa kim loại Cu =>Sau điện phân dung dịch gồm: nCuSO4 = nFeSO4 = 0,1 (mol) và H2SO4 = x (mol) Bảo toàn nguyên tố S => nCuSO4 (ban đầu) = nS = 0,2 +x => nCu ở catot = 0,1 + x (mol) Áp dụng định luật bảo toàn => nFe3+ + 2 * nCu (catot) = 2 nCl2 + 4nO2 => 0,1 + 2 * (0,1 +x) = 0,5 => x = 0,1 (mol) m = nCuSO4 (ban đầu) + nFeCl3 = 0,3 * 160 + 0,1 * 162,5 = 64,25 (gam)
Câu 36 :
Khi nung hỗn hợp các chất Fe(NO3)2, Fe(OH)3 và FeCO3 trong không khí đến khối lượng không đổi, thu được một chất rắn là
Đáp án : D Phương pháp giải :
Dựa vào tính chất của các hợp chất của sắt, viết phương trình phản ứng và kết luận. Lời giải chi tiết :
4Fe(NO3)2 \(\xrightarrow{{{t^o}}}\) 2Fe2O3 + 8NO2 + O2 2Fe(OH)3 \(\xrightarrow{{{t^o}}}\) Fe2O3 + 3H2O 4FeCO3 + O2 \(\xrightarrow{{{t^o}}}\) 2Fe2O3 + 4CO2 Vậy chất rắn thu được là Fe2O3.
Câu 37 :
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng ( dư),thu được dung dịch X. Trong các chất: NaOH, Cu, KNO3, KMnO4, BaCl2, Cl2, Al, NaCl, số chất có khả năng phản ứng được với dung dịch X là
Đáp án : C Phương pháp giải :
NO3- trong môi trường H+ có tính oxi hóa giống hệt với HNO3 Lời giải chi tiết :
Fe3O4 + 3H2SO4 dư → FeSO4 + Fe2(SO4)3 + 3H2O Vậy dd X thu được có: Fe2+, Fe3+ và H+ dư, SO42- => dd X tác dụng được với các chất: NaOH, Cu, KNO3, KMnO4, BaCl2, Cl2, Al => có 7 chất Dưới đây là phương trình minh họa đại diện phản ứng xảy ra với từng chất ( các phương trình còn lại hs tự viết) Fe2+ + OH- → Fe(OH)2↓ 2Fe3+ + Cu → Cu2+ + 2Fe2+ 3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O 3Fe2+ + MnO4- + 4H+ → 3Fe+3 + MnO2↓ + 2H2O SO42- + Ba2+ → BaSO4↓ Fe2+ + Cl2 → Fe3+ + 2Cl- Fe2+ + Al → Al3+ + Fe↓
Câu 38 :
Loại quặng sắt dùng để sản xuất gang thường chứa từ 30 - 95% oxit sắt và phải
Đáp án : D Phương pháp giải :
Dựa vào lý thuyết về quá trình sản xuất gang Lời giải chi tiết :
Loại quặng sắt dùng để sản xuất gang thường chứa từ 30 – 95% oxit sắt và phải chứa rất ít photpho, lưu huỳnh
Câu 39 :
Chất nào sau đây được dùng để làm mềm nước cứng vĩnh cửu?
Đáp án : D Phương pháp giải :
Để làm mềm nước cứng vĩnh cửu ta cần dùng chất có khả năng kết tủa hết Ca2+, Mg2+ ⟹ chất phù hợp Lời giải chi tiết :
Để làm mềm nước cứng vĩnh cửu ta cần dùng chất có khả năng kết tủa hết Ca2+, Mg2+ ⟹ chọn Na2CO3 Ca2+ + CO32- → CaCO3 ↓ Mg2+ + CO32- → MgCO3 ↓
Câu 40 :
Ở điều kiện thường, kim loại nào sau đây không tan được trong dung dịch NaOH?
Đáp án : D Phương pháp giải :
Dựa vào tính chất hóa học kim loại kiềm, Al và Fe được học trong sgk hóa 12 Lời giải chi tiết :
Na và K tan được trong nước có trong dd NaOH PTHH: 2Na + 2H2O → 2NaOH + H2 ; K + H2O → 2KOH + H2 Al tan được trong dd NaOH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ Fe không tan được trong dd NaOH |














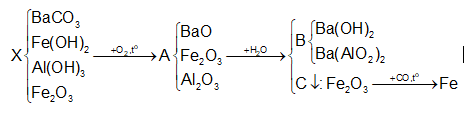






Danh sách bình luận