Đề thi giữa kì 2 Hóa 12 - Đề số 2Đề bài
Câu 1 :
Nước cứng là nước chứa nhiều:
Câu 2 :
Cho dòng điện một chiều có cường độ 16A đi qua nhôm oxit nóng chảy trong 3 giờ. Khối lượng Al thoát ra ở catot là
Câu 3 :
“Ăn mòn kim loại” là sự phá huỷ kim loại do:
Câu 4 :
Cho 10 gam một kim loại kiềm thổ M tác dụng hết với nước thoát ra 5,6 lít khí (đktc). Kim loại kiềm thổ đó là
Câu 5 :
Cho sắt tác dụng với dung dịch H2SO4 đặc, nóng, sau phản ứng thu được dung dịch muối và sản phẩm khử X. X không thể là
Câu 6 :
Kim loại nào sau đây có khả năng tạo ra màng oxit bảo vệ để không bị oxi hóa ngoài không khí ẩm ?
Câu 7 :
Cho Cu dư tác dụng với dung dịch Fe(NO3)3 được dung dịch X. Cho AgNO3 dư tác dụng với dung dịch X thu được dung dịch Y. Cho Fe dư tác dụng với dung dịch Y thu được hỗn hợp kim loại Z. Tổng số phương trình hóa học xảy ra là
Câu 8 :
Cho nhôm tan hoàn toàn trong dung dịch HNO3 loãng, nóng thu được khí N2O. Sau khi đã cân bằng, tỉ lệ giữa số nguyên tử Al bị oxi hoá và số phân tử HNO3 bị khử (các số nguyên, tối giản) là:
Câu 9 :
Phương trình điện phân dung dịch CuSO4 với điện cực trơ là
Câu 10 :
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03mol Cr2O3; 0,04mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều thu được hỗn hợp chất rắn Y. Chia Y thành 2 phần bằng nhau. Phần I phản ứng vừa đủ với 400ml dung dịch NaOH 0,1M (loãng). Phần II phản ứng với dung dịch HCl loãng, nóng (dư) thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. % khối lượng Cr2O3 đã phản ứng là:
Câu 11 :
Cho hỗn hợp bột gồm 0,27 gam Al và 0,672 gam Fe vào 600 ml dung dịch AgNO3 0,1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag)
Câu 12 :
Công thức của phèn chua là :
Câu 13 :
X là kim loại thuộc nhóm IIA. Cho 1,7 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,672 lít khí H2 (ở đktc). Mặt khác, khi cho 1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc). Kim loại X là
Câu 14 :
Chỉ dùng thêm thuốc thử nào dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch: H2SO4, BaCl2, Na2SO4 ?
Câu 15 :
Một cốc nước có chứa các ion Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl- (0,02 mol), $HCO_3^ - $(0,1 mol), SO42- (0,01 mol). Đun sôi cốc trên đến khi các phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc
Câu 16 :
Cho các kim loại: Na, Ca, Al, Fe, Cu, Ag. Bằng phương pháp điện phân có thể điều chế được bao nhiêu kim loại trong số các kim loại ở trên ?
Câu 17 :
Điện phân dung dịch chứa AgNO3 với điện cực trơ trong thời gian t (s), cường độ dòng điện 2A thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau phản ứng xảy ra hoàn toàn thu được 0,336 gam hỗn hợp kim loại; 0,112 lít hỗn hợp khí Z (đktc) gồm NO và N2O có tỉ khối đối với H2 là 19,2 và dung dịch Y chứa 3,04 gam muối. Cho toàn bộ hỗn hợp bột kim loại trên tác dụng với dung dịch HCl dư thu được 0,112 lit khí H2 (đktc). Giá trị của t là :
Câu 18 :
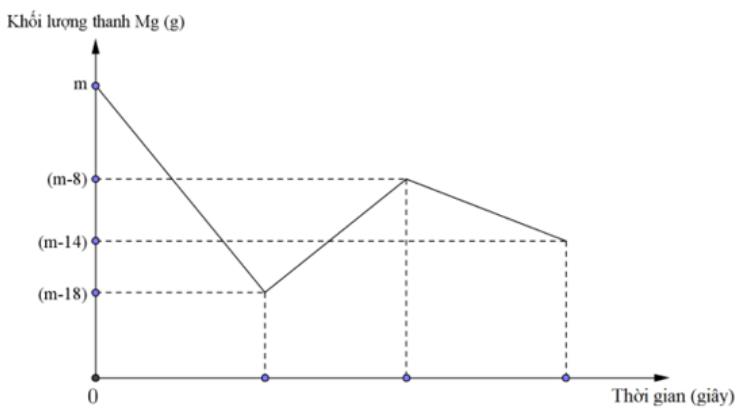
Khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol HCl ta có đồ thị biểu diễn sự phụ thuộc của khối lượng Mg vào thời gian phản ứng được biểu diễn như hình vẽ dưới đây: Sau khi phản ứng xảy ra hoàn toàn, rút thanh Mg ra, thu được NO là sản phẩm khử duy nhất của N+5. Tỉ lệ a : b là
Câu 19 :
Cho các cặp oxi hóa - khử được sắp xếp theo thứ tự tăng dần tính oxi hóa của các ion kim loại: Al3+/Al; Fe2+/Fe; Sn2+/Sn; Cu2+/Cu. Tiến hành các thí nghiệm sau: (a) Cho sắt vào dung dịch đồng(II) sunfat. (b) Cho đồng vào dung dịch nhôm sunfat. (c) Cho thiếc vào dung dịch đồng(II) sunfat. (d) Cho thiếc vào dung dịch sắt(II) sunfat. Trong các thí nghiệm trên, những thí nghiệm có xảy ra phản ứng là
Câu 20 :
Khẳng định nào sau đây là đúng ?
Câu 21 :
Nước cứng toàn phần là nước chứa?
Câu 22 :
Hấp thụ hoàn toàn 22,4 lít khí CO2 (đktc) vào dung dịch chứa y mol Ba(OH)2, x mol KOH, x mol NaOH. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 81,1 gam muối và 39,4 gam kết tủa. Bỏ qua sự thủy phân của các ion. Tỉ lệ x : y có thể là
Câu 23 :
Một hỗn hợp X gồm Al và Fe2O3. Thực hiện phản ứng nhiệt nhôm hoàn toàn X thu được chất rắn A. A tác dụng với dung dịch NaOH dư thu được 6,72 lít H2 (đktc) và chất rắn B. Cho B tác dụng với H2SO4 loãng dư sinh ra 6,72 lít khí (đktc). Khối lượng hỗn hợp X đã dùng là
Câu 24 :
Một cốc nước có chứa các ion: Na+ (0,1 mol), Mg2+ (0,1 mol), Ca2+ (0,2 mol), Cl- (0,2 mol),HCO3- (0,2 mol) và SO42- (0,15 mol). Đun sôi cốc nước trên cho đến khi các phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc
Câu 25 :
Cho 4 kim loại Al, Fe, Mg, Cu và 4 dung dịch ZnSO4, AgNO3, CuCl2. Số kim loại khử được cả 3 dung dịch đã cho là
Câu 26 :
Cho các kim loại sau: Mg, Al, Cu, Cr, Ag. Số kim loại nào không tác dụng được với O2?
Câu 27 :
Để điều chế K người ta có thể dùng phương pháp nào
Câu 28 :
Hòa tan hết hỗn hợp X gồm 6,72 gam Fe ; 5,4 gam Al và 10,8 gam Ag tác dụng với H2SO4 đặc nóng dư chỉ thoát ra khí SO2 (sản phẩm khử duy nhất của S). Số mol H2SO4 đã tham gia phản ứng là
Câu 29 :
Cho 7,2 gam Mg tác dụng với 100 ml dung dịch X chứa Zn(NO3)2 1M và Cu(NO3)2 2M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
Câu 30 :
Cho 300 ml dung dịch chưa đồng thời Ba(OH)2 1M và NaOH 1,5M vào 150 ml dung dịch chứa đồng thời AlCl3 1M và Al2(SO4)3 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. giá trị của m là
Câu 31 :
Kim loại Na không tác dụng được với chất nào dưới đây?
Câu 32 :
Khi điện phân dung dịch CuCl2, ở catot xảy ra
Câu 33 :
Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) V lít dung dịch X chứa đồng thời R(NO3)2 0,45M (R là kim loại hóa trị không đổi) và NaCl 0,4M trong thời gian t giây, thu được 6,72 lít hỗn hợp khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 400 ml dung dịch chứa KOH 0,75M và NaOH 0,5M không sinh ra kết tủa. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của V là
Câu 34 :
Để bảo quản natri, người ta phải ngâm natri trong
Câu 35 :
Nhỏ từ từ 62,5 ml dung dịch hỗn hợp Na2CO3 0,08M và KHCO3 0,12M vào 125 ml dung dịch HCl 0,1M và khuấy đều. Sau các phản ứng, thu được V ml khí CO2(đktc). Giá trị của V là
Câu 36 :
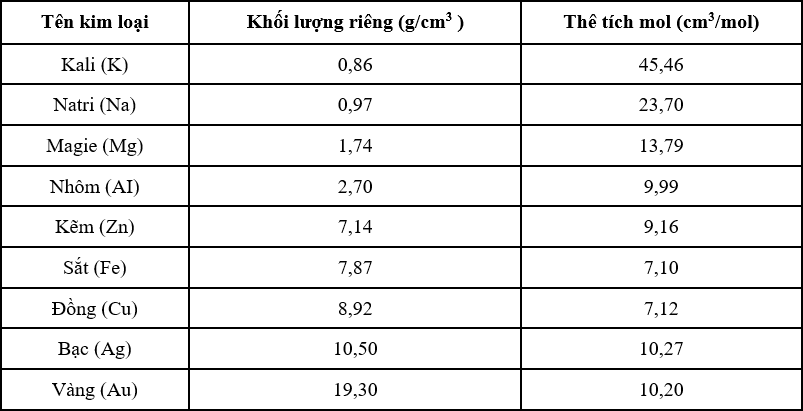
Dựa vào khối lượng riêng của kim loại, hãy tính thể tích mol kim loại và ghi kết quả vào bảng sau:
Chọn phát biểu không đúng trong các phát biểu sau:
Câu 37 :
Phản ứng giữa các cặp chất nào sau đây không tạo ra kim loại?
Câu 38 :
Cho hỗn hợp Fe và Zn tác dụng với dung dịch hỗn hợp chứa 0,01 mol HCl và 0,05 mol H2SO4. Sau phản ứng thu được chất rắn X, dung dịch Y và khí Z. Cho khí Z đi qua CuO dư, đun nóng thu được m gam Cu. Giá trị của m là
Câu 39 :
Khử hoàn toàn m gam Fe2O3 cần vừa đủ 4,704 lít khí CO (đktc). Giá trị của m là
Câu 40 :
Thổi từ từ khí CO2 đến dư vào dung dịch chứa 0,12 mol Ca(OH)2 . Sự phụ thuộc của số mol kết tủa thu được vào số mol CO2 phản ứng được biểu điễn theo đồ thị sau:
Mối quan hệ của a và b là:
Lời giải và đáp án
Câu 1 :
Nước cứng là nước chứa nhiều:
Đáp án : D Lời giải chi tiết :
Nước cứng là nước chứa nhiều ion Ca2+ , Mg2+
Câu 2 :
Cho dòng điện một chiều có cường độ 16A đi qua nhôm oxit nóng chảy trong 3 giờ. Khối lượng Al thoát ra ở catot là
Đáp án : D Phương pháp giải :
Sử dụng công thức $m=\frac{A.I.t}{n.F}$ Lời giải chi tiết :
Sử dụng công thức $m=\frac{A.I.t}{n.F}=\frac{27.16.3.60.60}{3.96500}=16,1\,\,gam$
Câu 3 :
“Ăn mòn kim loại” là sự phá huỷ kim loại do:
Đáp án : A Lời giải chi tiết :
“Ăn mòn kim loại” là sự phá huỷ kim loại do tác dụng hoá học của môi trường xung quanh.
Câu 4 :
Cho 10 gam một kim loại kiềm thổ M tác dụng hết với nước thoát ra 5,6 lít khí (đktc). Kim loại kiềm thổ đó là
Đáp án : C Phương pháp giải :
Bảo toàn e: 2nM = 2nH2 Lời giải chi tiết :
nH2 = 0,25 mol Bảo toàn e: 2nM = 2nH2 => nM = 0,25 mol => M = 10 / 0,25 = 40 => M là Ca
Câu 5 :
Cho sắt tác dụng với dung dịch H2SO4 đặc, nóng, sau phản ứng thu được dung dịch muối và sản phẩm khử X. X không thể là
Đáp án : C Lời giải chi tiết :
Các sản phẩm khử của H2SO4 đặc là H2S, S, SO2 (xem lại phần lí thuyết kim loại tác dụng với axit có tính oxi hóa) => X không thể là SO3
Câu 6 :
Kim loại nào sau đây có khả năng tạo ra màng oxit bảo vệ để không bị oxi hóa ngoài không khí ẩm ?
Đáp án : A Lời giải chi tiết :
Al khi phản ứng với oxi (hoặc nước) trong không khí tạo lớp màng oxit mỏng Al2O3 bảo vệ bề mặt (SGK 12 cơ bản – trang 121)
Câu 7 :
Cho Cu dư tác dụng với dung dịch Fe(NO3)3 được dung dịch X. Cho AgNO3 dư tác dụng với dung dịch X thu được dung dịch Y. Cho Fe dư tác dụng với dung dịch Y thu được hỗn hợp kim loại Z. Tổng số phương trình hóa học xảy ra là
Đáp án : B Phương pháp giải :
Viết các PTHH xảy ra, chú ý chất dùng dư để xét các muối trong dung dịch Lời giải chi tiết :
Phương trình phản ứng : (1) Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2 Dung dịch X chứa Cu(NO3)2 và Fe(NO3)2 (2) Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag Dung dịch Y chứa Cu(NO3)2, Fe(NO3)3 và AgNO3 dư Cho Fe dư tác dụng với dung dịch Y thu được hỗn hợp kim loại Z → Z gồm Ag, Cu và Fe dư (3) Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (4) Fe + 2Fe(NO3)3 → 3Fe(NO3)2 (5) Fe + Cu(NO3)2 → Fe(NO3)2 + Cu → có 5 phản ứng hóa học xảy ra
Câu 8 :
Cho nhôm tan hoàn toàn trong dung dịch HNO3 loãng, nóng thu được khí N2O. Sau khi đã cân bằng, tỉ lệ giữa số nguyên tử Al bị oxi hoá và số phân tử HNO3 bị khử (các số nguyên, tối giản) là:
Đáp án : D Lời giải chi tiết :
$8\overset{0}{\mathop{Al}}\,\text{ }+\text{ 3}0H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\text{8}\overset{+3}{\mathop{Al}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{}{{\overset{+1}{\mathop{3N}}\,}_{2}}O+\text{ 15}{{H}_{2}}O$ $\begin{align} & 8\text{x} \\ & \\ & 3\text{x} \\ \end{align}$$\,\,\left| \begin{align} & \overset{0}{\mathop{Al}}\,\to \overset{+3}{\mathop{Al}}\,+3e \\ & \overset{+5}{\mathop{2N}}\,+8e\to {{\overset{+1}{\mathop{N}}\,}_{2}}O \\ \end{align} \right.$ => số nguyên tử Al bị oxi hóa là 8 => Số phân tử HNO3 bị khử là 3.2 = 6
Câu 9 :
Phương trình điện phân dung dịch CuSO4 với điện cực trơ là
Đáp án : D Lời giải chi tiết :
Phương trình điện phân dung dịch CuSO4: 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Câu 10 :
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03mol Cr2O3; 0,04mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều thu được hỗn hợp chất rắn Y. Chia Y thành 2 phần bằng nhau. Phần I phản ứng vừa đủ với 400ml dung dịch NaOH 0,1M (loãng). Phần II phản ứng với dung dịch HCl loãng, nóng (dư) thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. % khối lượng Cr2O3 đã phản ứng là:
Đáp án : A Phương pháp giải :
+) nNaOH = 2nAl2O3 + nAl dư = nAl ban đầu +) Số mol e trao đổi của phần II là ne (II) = 2nH2 = 2nCr + 2nFe + 3nAl dư +) Bảo toàn e : 3nAl – 2ne (II) = nCr = 0,04 → %Cr2O3 phản ứng = 0,02.100% / 0,03 Lời giải chi tiết :
- Chất rắn thu được sau phản ứng nhiệt nhôm chỉ có Al2O3 và Al còn dư (nếu có) tham gia phản ứng với NaOH: Al2O3 + 2NaOH → 2NaAlO2 + H2O Al + NaOH + H2O → NaAlO2 + 3/2H2 nNaOH = 2nAl2O3 + nAl dư = nAl ban đầu → a = 2nNaOH = 0,08mol (vì ½ Y chỉ phản ứng với 0,04 mol NaOH). - Nhận thấy trong phản ứng nhiệt nhôm, Al nhường e cho Cr2O3 và FeO. Hỗn hợp rắn sau phản ứng cho tác dụng với HCl loãng nóng dư thì Cr chuyển thành Cr2+; Fe chuyển thành Fe2+; Al chuyển thành Al3+; FeO chuyển thành Fe2+; Cr2O3 chuyển thành Cr3+; Al2O3 chuyển thành Al3+. Số mol e trao đổi của phần II là ne (II) = 2nH2 = 2nCr + 2nFe + 3nAl dư = 0,1 mol. - Bảo toàn e : 3nAl – 2ne (II) = nCr = 0,04 → nCr2O3 phản ứng = 1/2.nCr = 0,02 → %Cr2O3 phản ứng = 0,02.100% / 0,03 = 66,67%
Câu 11 :
Cho hỗn hợp bột gồm 0,27 gam Al và 0,672 gam Fe vào 600 ml dung dịch AgNO3 0,1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag)
Đáp án : A Phương pháp giải :
Ta thấy: ne Al cho tối đa < ne Ag nhận tối đa = 0,06 < ne Al cho tối đa + ne Fe cho tối đa tạo Fe3+ = 0,096 => Al phản ứng hết, Fe phản ứng hết với Ag+ tạo thành Fe3+ và Fe2+ => Ag+ tạo hết thành kết tủa Chất rắn thu được gồm Ag Lời giải chi tiết :
nAl = 0,01 mol; nFe = 0,012 mol; nAgNO3 = 0,06 mol ne Ag nhận tối đa = 0,06 mol ne Al cho tối đa = 0,01.3 = 0,03 mol ne Fe cho tối đa tạo Fe3+ = 0,012.3 = 0,036 mol Ta thấy: ne Al cho tối đa < ne Ag nhận tối đa = 0,06 < ne Al cho tối đa + ne Fe cho tối đa tạo Fe3+ = 0,066 => Al phản ứng hết, Fe phản ứng hết với Ag+ tạo thành Fe3+ và Fe2+ => Ag+ tạo hết thành kết tủa Chất rắn thu được gồm Ag => mAg = 0,06.108 = 6,48 gam
Câu 12 :
Công thức của phèn chua là :
Đáp án : A Lời giải chi tiết :
Công thức của phèn chua là : K2SO4.Al2(SO4)3.24H2O
Câu 13 :
X là kim loại thuộc nhóm IIA. Cho 1,7 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,672 lít khí H2 (ở đktc). Mặt khác, khi cho 1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc). Kim loại X là
Đáp án : B Phương pháp giải :
+) Gọi M là kí hiệu chung của 2 kim loại X và Zn +) M + 2HCl → MCl2 + H2 $ \to {\bar M_M} = \frac{{1,7}}{{0,03}} = 56,67$ Vì MZn = 65 > 56,67 => MX < 56,67 +) X + H2SO4 → XSO4 + H2 $ \to {n_X} = \frac{{1,9}}{{{M_X}}} = {n_{{H_2}}}\;\, \to \,\,\frac{{1,9}}{{{M_X}}} < 0,05$ => MX > 38 => kim loại X là Ca Lời giải chi tiết :
Gọi M là kí hiệu chung của 2 kim loại X và Zn a là số mol của M M + 2HCl → MCl2 + H2 => nH2 = 0,03 mol = a $ \to {\bar M_M} = \frac{{1,7}}{{0,03}} = 56,67$ Vì MZn = 65 > 56,67 => MX < 56,67 X + H2SO4 → XSO4 + H2 $\to {{n}_{X}}=\frac{1,9}{{{M}_{X}}}={{n}_{{{H}_{2}}}}\ \,\to \,\,\frac{1,9}{{{M}_{X}}}<0,05$ => MX > 38 Ta có: 38 < MX < 56,67 => kim loại X là Ca
Câu 14 :
Chỉ dùng thêm thuốc thử nào dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch: H2SO4, BaCl2, Na2SO4 ?
Đáp án : D Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
- dùng quỳ tím
- dùng bột kẽm
- dùng Na2CO3
Câu 15 :
Một cốc nước có chứa các ion Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl- (0,02 mol), $HCO_3^ - $(0,1 mol), SO42- (0,01 mol). Đun sôi cốc trên đến khi các phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc
Đáp án : B Phương pháp giải :
xem lại lí thuyết nước cứng Lời giải chi tiết :
Đun sôi nước xảy ra phản ứng: $2HCO_3^ - \xrightarrow{{{t^o}}}CO_3^{2 - } + {H_2}O$ $0,1\;\;\;\;\; \to \;\;\;0,05$ $C{a^{2 + }} + CO_3^{2 - } \to CaC{{\text{O}}_3}$ $0,04 \to \,0,04$ $M{g^{2 + }} + CO_3^{2 - } \to MgC{{\text{O}}_3}$ $0,01 \leftarrow 0,01$ => dung dịch sau đun nóng gồm Na+ (0,02 mol), Mg2+ (0,01 mol), Cl- (0,02 mol), SO42- (0,01 mol) => nước còn lại trong cốc có tính cứng vĩnh cửu
Câu 16 :
Cho các kim loại: Na, Ca, Al, Fe, Cu, Ag. Bằng phương pháp điện phân có thể điều chế được bao nhiêu kim loại trong số các kim loại ở trên ?
Đáp án : D Lời giải chi tiết :
Bằng phương pháp điện phân có thể điều chế được tất cả các kim loại trên. - phương pháp điện phân nóng chảy: Na, Ca, Al - phương pháp điện phân dung dịch: Fe, Cu, Ag
Câu 17 :
Điện phân dung dịch chứa AgNO3 với điện cực trơ trong thời gian t (s), cường độ dòng điện 2A thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau phản ứng xảy ra hoàn toàn thu được 0,336 gam hỗn hợp kim loại; 0,112 lít hỗn hợp khí Z (đktc) gồm NO và N2O có tỉ khối đối với H2 là 19,2 và dung dịch Y chứa 3,04 gam muối. Cho toàn bộ hỗn hợp bột kim loại trên tác dụng với dung dịch HCl dư thu được 0,112 lit khí H2 (đktc). Giá trị của t là :
Đáp án : C Phương pháp giải :
- Bảo toàn e - Định luật Faraday : ne.F = It +) Mg + X thu được hỗn hợp kim loại => Ag+ chưa điện phân hết +) Hỗn hợp kim loại + HCl => nMg = nH2 => nAg +) Tính số mol NO và N2O Gọi \({{n}_{N{{H}_{4}}N{{O}_{3}}}}=x\text{ }mol\) Bảo toàn e : \({{n}_{Mg{{\left( N{{O}_{3}} \right)}_{2}}}}={{n}_{Mg+HN{{O}_{3}}}}+{{n}_{Mg+A{{g}^{+}}}}~=\frac{1}{2}.\left( 3{{n}_{NO}}+8{{n}_{{{N}_{2}}O}}+8{{n}_{N{{H}_{4}}N{{O}_{3}}}} \right)+\frac{1}{2}.{{n}_{Ag}}\) => tính số mol muối Mg(NO3)2 +) Từ mmuối \(={{m}_{Mg{{\left( N{{O}_{3}} \right)}_{2}}}}+{{m}_{N{{H}_{4}}N{{O}_{3}}}}\Rightarrow x\) +) \({{n}_{{{H}^{+}}(X)}}=4{{n}_{NO}}+10{{n}_{{{N}_{2}}O}}+10{{n}_{N{{H}_{4}}N{{O}_{3}}}}={{n}_{e}}\) +) Định luật Faraday : ne.F = It => t Lời giải chi tiết :
Khi điện phân AgNO3 : Catot : Ag+ + 1e → Ag Anot : 2H2O → 4H+ + 4e + O2 Mg + X thu được hỗn hợp kim loại => Ag+ chưa điện phân hết - Hỗn hợp kim loại + HCl => nMg = nH2 = 0,005 mol => nAg = 0,002 mol Hỗn hợp khí là sản phẩm khử của Mg với H+ và NO3- (Mg dư) \({{n}_{NO}}+{{n}_{{{N}_{2}}O}}\) = 0,005 mol \({{m}_{NO}}+{{m}_{{{N}_{2}}O}}~\)= 2.19,2.0,005 = 0,192 gam => nNO = 0,002 và \({{n}_{{{N}_{2}}O}}\)= 0,003 mol Gọi \({{n}_{N{{H}_{4}}N{{O}_{3}}}}=x\text{ }mol\) Bảo toàn e : \({{n}_{Mg{{\left( N{{O}_{3}} \right)}_{2}}}}={{n}_{Mg+HN{{O}_{3}}}}+{{n}_{Mg+A{{g}^{+}}}}~=\frac{1}{2}.\left( 3{{n}_{NO}}+8{{n}_{{{N}_{2}}O}}+8{{n}_{N{{H}_{4}}N{{O}_{3}}}} \right)+\frac{1}{2}.{{n}_{Ag}}\) \(=\frac{1}{2}\left( 3.0,002+8.0,003+8x \right)+\frac{1}{2}.0,002=0,016+4x\) => mmuối \(={{m}_{Mg{{\left( N{{O}_{3}} \right)}_{2}}}}+{{m}_{N{{H}_{4}}N{{O}_{3}}}}=148.\left( 0,016+4x \right)+80x=3,04\,gam\) => x = 0,001 mol => \({{n}_{{{H}^{+}}(X)}}=4{{n}_{NO}}+10{{n}_{{{N}_{2}}O}}+10{{n}_{N{{H}_{4}}N{{O}_{3}}}}=0,048\text{ }mol={{n}_{e}}\) Định luật Faraday : ne.F = It => t = 2316 (s)
Câu 18 :
Khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol HCl ta có đồ thị biểu diễn sự phụ thuộc của khối lượng Mg vào thời gian phản ứng được biểu diễn như hình vẽ dưới đây: Sau khi phản ứng xảy ra hoàn toàn, rút thanh Mg ra, thu được NO là sản phẩm khử duy nhất của N+5. Tỉ lệ a : b là
Đáp án : A Phương pháp giải :
Đoạn 1: Khối lượng Mg giảm 18 gam (0,75 mol) 3Mg + 8H+ + 2NO3- → 3Mg2+ + 2NO + 4H2O => số mol H+ phản ứng với Mg và NO3- (1) Đoạn 2: Khối lượng Mg tăng 18 – 8 = 10 gam +) Sử dụng tăng giảm khối lượng => a Đoạn 3: Khối lượng Mg giảm 14 – 8 = 6 gam => nMg = 0,25 mol Mg + 2H+ → Mg2+ + H2 => số mol H+ phản ứng với Mg tạo H2 (2) => b = nH+ (1) + nH+ (2) => a : b Lời giải chi tiết :
Đoạn 1: Khối lượng Mg giảm 18 gam (0,75 mol) 3Mg + 8H+ + 2NO3- → 3Mg2+ + 2NO + 4H2O 0,75 → 2 Đoạn 2: Khối lượng Mg tăng 18 – 8 = 10 gam Mg + Cu2+ → Mg2+ + Cu a a a ∆m = 64a – 24a = 10 => a = 0,25 Đoạn 3: Khối lượng Mg giảm 14 – 8 = 6 gam => nMg = 0,25 mol Mg + 2H+ → Mg2+ + H2 0,25 → 0,5 Vậy nH+ = b = 2 + 0,5 = 2,5 => a : b = 1 : 10
Câu 19 :
Cho các cặp oxi hóa - khử được sắp xếp theo thứ tự tăng dần tính oxi hóa của các ion kim loại: Al3+/Al; Fe2+/Fe; Sn2+/Sn; Cu2+/Cu. Tiến hành các thí nghiệm sau: (a) Cho sắt vào dung dịch đồng(II) sunfat. (b) Cho đồng vào dung dịch nhôm sunfat. (c) Cho thiếc vào dung dịch đồng(II) sunfat. (d) Cho thiếc vào dung dịch sắt(II) sunfat. Trong các thí nghiệm trên, những thí nghiệm có xảy ra phản ứng là
Đáp án : C Lời giải chi tiết :
Vì $\dfrac{{C{u^{2 + }}}}{{Cu}}$ đứng sau $\dfrac{{A{l^{3 + }}}}{{Al}}$ → (b) không phản ứng Cặp $\dfrac{{S{n^{2 + }}}}{{Sn}}$ đứng sau $\dfrac{{F{e^{2 + }}}}{{Fe}}$→ (d) không phản ứng → A, B, D sai C đúng vì (a) Fe + CuSO4 $\xrightarrow{{}}$ FeSO4 + Cu↓ (c) Sn + CuSO4 $\xrightarrow{{}}$ SnSO4 +Cu↓
Câu 20 :
Khẳng định nào sau đây là đúng ?
Đáp án : D Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Mg và Be không phản ứng với nước ở điều kiện thường B sai. Đi từ đầu nhóm IIA đến cuối nhóm theo chiều tăng dần điện tính hạt nhân tính kim loại (tính khử) tăng dần => Kim loại mạnh nhất là Ra; yếu nhất là Be. => A sai, D đúng. Nhóm Kim loại kiềm có tính khử mạnh nhất => C sai.
Câu 21 :
Nước cứng toàn phần là nước chứa?
Đáp án : D Phương pháp giải :
xem lại lí thuyết nước cứng Lời giải chi tiết :
Nước cứng toàn phần là nước chứa Mg2+, Ca2+, Cl-, SO42-, HCO3- .
Câu 22 :
Hấp thụ hoàn toàn 22,4 lít khí CO2 (đktc) vào dung dịch chứa y mol Ba(OH)2, x mol KOH, x mol NaOH. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 81,1 gam muối và 39,4 gam kết tủa. Bỏ qua sự thủy phân của các ion. Tỉ lệ x : y có thể là
Đáp án : D Lời giải chi tiết :
nCO2 = 1 mol; nBaCO3 = 0,2 mol Giả sử muối chứa Ba(HCO3)2 => dung dịch thu được gồm K+ (x mol); Na+ (x mol); Ba2+ và HCO3- (a mol) Bảo toàn điện tích: nBa2+ = 0,5a – 0,5x – 0,5x= 0,5a -x Bảo toàn nguyên tố C: nCO2 = nHCO3 + nBaCO3 => 1 = a + 0,2 => a = 0,8 (1) Bảo toàn nguyên tố Ba: nBa(OH)2 = nBa2+ + nBaCO3 => y = 0,5a – x + 0,2 (2) mmuối = mK+ + mNa+ + mBa2+ + mHCO3- => 39x + 23x + 137.(0,5a - x) + 61a = 81,1 (3) Từ (1), (2) và (3) => a = 0,8; x = 0,3; y = 0,3 => x : y = 1 : 1
Câu 23 :
Một hỗn hợp X gồm Al và Fe2O3. Thực hiện phản ứng nhiệt nhôm hoàn toàn X thu được chất rắn A. A tác dụng với dung dịch NaOH dư thu được 6,72 lít H2 (đktc) và chất rắn B. Cho B tác dụng với H2SO4 loãng dư sinh ra 6,72 lít khí (đktc). Khối lượng hỗn hợp X đã dùng là
Đáp án : C Phương pháp giải :
B tác dụng với H2SO4 → nFe =\({n_{{H_2}}}\) = 0,3mol →\({n_{A{l_2}{O_3}}} = {n_{F{e_2}{O_3}}} = {n_{Fe}}/2\) Bảo toàn khối lượng : m = mAl2O3 + mFe + mAl Lời giải chi tiết :
A tác dụng với NaOH sinh ra khí H2 → Al dư → hỗn hợp A gồm Al2O3, Fe và Al dư nAl dư =\(\frac{2}{3}{n_{{H_2}}}\) = 0,2 mol Chất rắn B là Fe Fe + H2SO4 → H2 0,3 0,3 Mà \({n_{A{l_2}{O_3}}} = {n_{F{e_2}{O_3}}} = {n_{Fe}}/2\)= 0,15 mol Bảo toàn khối lượng : m = mAl2O3 + mFe + mAl = 0,15.102 + 0,3. 56 + 0,2. 27= 37,5
Câu 24 :
Một cốc nước có chứa các ion: Na+ (0,1 mol), Mg2+ (0,1 mol), Ca2+ (0,2 mol), Cl- (0,2 mol),HCO3- (0,2 mol) và SO42- (0,15 mol). Đun sôi cốc nước trên cho đến khi các phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc
Đáp án : B Lời giải chi tiết :
$2HCO_3^ - \buildrel {{t^o}} \over 0,2 → 0,1 $Ca_{}^{2 + } + CO_3^{2 - } \to CaC{O_3} \downarrow $ 0,1$ \leftarrow $ 0,1 => Số mol Ca2+ dư là ${n_{C{a^{2 + }}}} = 0,1$ mol → Đun sôi cốc nước trên cho đến khi các phản ứng xảy ra hoàn toàn thì trong cốc còn Na+ , Mg2+ ,Ca2+ , Cl- và SO42- nên nước còn lại trong cốc là nước cứng vĩnh cửu.
Câu 25 :
Cho 4 kim loại Al, Fe, Mg, Cu và 4 dung dịch ZnSO4, AgNO3, CuCl2. Số kim loại khử được cả 3 dung dịch đã cho là
Đáp án : B Phương pháp giải :
KL mạnh đẩy KL yếu ra khỏi dung dịch muối của nó Lời giải chi tiết :
Mg, Al là kim loại mạnh hơn những kim loại trong muối → Mg,Al khử được cả 3 dung dịch muối Fe yếu hơn Zn => không khử được Zn2+ Cu không khử được Cu2+ và Zn2+
Câu 26 :
Cho các kim loại sau: Mg, Al, Cu, Cr, Ag. Số kim loại nào không tác dụng được với O2?
Đáp án : A Lời giải chi tiết :
Kim loại không tác dụng được với O2 là Ag
Câu 27 :
Để điều chế K người ta có thể dùng phương pháp nào
Đáp án : C Phương pháp giải :
xem lại lí thuyết điều chế kim loại Lời giải chi tiết :
Để điều chế K người ta dùng phương pháp điện phân nóng chảy muối và bazơ của Na =>điện phân nóng chảy KOH
Câu 28 :
Hòa tan hết hỗn hợp X gồm 6,72 gam Fe ; 5,4 gam Al và 10,8 gam Ag tác dụng với H2SO4 đặc nóng dư chỉ thoát ra khí SO2 (sản phẩm khử duy nhất của S). Số mol H2SO4 đã tham gia phản ứng là
Đáp án : B Phương pháp giải :
Ta có:\({n_{SO_4^{2 - }}} = {n_{S{O_2}}} = {{{n_{e{\rm{ }}cho}}} \over 2}\) Bảo toàn nguyên tố S:\({n_{{H_2}S{O_4}}} = {\rm{ }}{n_{S{O_2}}} + {\rm{ }}{n_{SO_4^{2 - }}}\) Lời giải chi tiết :
nFe = 0,12 mol; nAl = 0,2 mol; nAg = 0,1 mol Ta có:\({n_{SO_4^{2 - }}} = {n_{S{O_2}}} = {{{n_{e{\rm{ }}cho}}} \over 2} = {{0,12.3 + 0,2.3 + 0,1.1} \over 2} = 0,53\,\,mol\) Bảo toàn nguyên tố S: \({n_{{H_2}S{O_4}}} = {\rm{ }}{n_{S{O_2}}} + {\rm{ }}{n_{SO_4^{2 - }}}\) = 0,53.2 = 1,06 mol
Câu 29 :
Cho 7,2 gam Mg tác dụng với 100 ml dung dịch X chứa Zn(NO3)2 1M và Cu(NO3)2 2M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
Đáp án : B Phương pháp giải :
neMg cho tối đa = 0,3.2 = 0,6 mol ne Cu2+ nhận = 0,4 mol; ne Zn2+ nhận = 0,2 mol => ne nhận tối đa = 0,4 + 0,2 = 0,6 mol Ta thấy ne cho tối đa = ne nhận tối đa = 0,6 mol => Mg phản ứng vừa đủ với Cu2+ và Zn2+ Lời giải chi tiết :
nMg = 0,3 mol; nZn(NO3)2 = 0,1 mol; nCu(NO3)2 = 0,2 mol neMg cho tối đa = 0,3.2 = 0,6 mol ne Cu2+ nhận = 0,2.2 = 0,4 mol; ne Zn2+ nhận = 0,2 mol => ne nhận tối đa = 0,4 + 0,2 = 0,6 mol Ta thấy ne cho tối đa = ne nhận tối đa = 0,6 mol => Mg phản ứng vừa đủ với Cu2+ và Zn2+ => chất rắn thu được gồm Cu (0,2 mol) và Zn (0,1mol) => m = 19,3 gam
Câu 30 :
Cho 300 ml dung dịch chưa đồng thời Ba(OH)2 1M và NaOH 1,5M vào 150 ml dung dịch chứa đồng thời AlCl3 1M và Al2(SO4)3 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. giá trị của m là
Đáp án : C Phương pháp giải :
Lập tỉ lệ: + Nếu k ≤3 thì thu được kết tủa là Al(OH)3 Khi đó kết tủa thu được chứa Al(OH)3 và BaSO4 với nAl(OH)3 = 1/3 nOH- + Nếu 3 < k < 4 thì thu được Al(OH)3 và AlO2- Khi đó kết tủa thu được chứa Al(OH)3 và BaSO4 với nAl(OH)3 = 4nAl3+ - nOH- + Nếu k ≥ 4 thì thu được AlO2- Khi đó kết tủa thu được chỉ là BaSO4 Lời giải chi tiết :
nBa(OH)2 = 0,3.1 = 0,3 (mol) ; nNaOH = 0,3.1,5 = 0,45 (mol) => ∑nOH- = 2nBa(OH)2 + nNaOH = 0,3.2 + 0,45 = 1,05 (mol) nBa2+ = 0,3 (mol) nAlCl3= 0,15.1 = 0,15 (mol); nAl2(SO4)3 = 0,15.0,5 = 0,075 (mol) => ∑nAl3+ = nAlCl3 + 2nAl2(SO4)3 = 0,15 + 0,075.2 = 0,3 (mol) ; nso42- = 0,225 (mol) Ta có: \(3 < \frac{{{n_{O{H^ - }}}}}{{{n_{A{l^{3 + }}}}}} = \frac{{1,05}}{{0,3}} = 3,5 < 4\)=> tạo kết tủa Al(OH)3 và AlO2- nAl(OH)3 = 4nAl3+ - nOH- = 4.0,3 - 1,05 = 0,15 (mol) Vây sau phản ứng thu được kết tủa Al(OH)3: 0,15 mol và BaSO4 :0,225 (mol) => m↓ = 0,15.78 + 0,225.233 = 64,125 (g)
Câu 31 :
Kim loại Na không tác dụng được với chất nào dưới đây?
Đáp án : D Lời giải chi tiết :
Na không phản ứng với dầu hỏa do đó người ta bảo quản Na bằng cách ngâm trong dầu hỏa.
Câu 32 :
Khi điện phân dung dịch CuCl2, ở catot xảy ra
Đáp án : A Phương pháp giải :
Trong điện phân + Catot (cực -): cation dương đi về, xảy ra quá trình khử + Anot (cực +): anion âm đi về, xảy ra quá trình oxi hóa Lời giải chi tiết :
Khi điện phân dung dịch CuCl2, ở catot xảy ra : Cu+2 + 2e → Cu → xảy ra sự khử ion Cu2+
Câu 33 :
Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) V lít dung dịch X chứa đồng thời R(NO3)2 0,45M (R là kim loại hóa trị không đổi) và NaCl 0,4M trong thời gian t giây, thu được 6,72 lít hỗn hợp khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 400 ml dung dịch chứa KOH 0,75M và NaOH 0,5M không sinh ra kết tủa. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của V là
Đáp án : A Phương pháp giải :
Do Y tác dụng với kiềm nên R2+ có bị điện phân nR(NO3)2 = 0,45V mol; nNaCl = 0,4V mol *t giây: Thu được hỗn hợp khí ở anot nên Cl- bị điện phân hết, H2O đã bị điện phân nCl2 = 0,5nNaCl = 0,2V mol n khí = nCl2 + nO2 => nO2 = 0,3 – 0,2V (mol) => n e (t giây) = 2nCl2 + 4nO2 = 2.0,2V + 4(0,3-0,2V) = 1,2-0,4V (mol) *2t giây: n e (2t giây) = 2,4-0,8V Trong t giây tiếp theo nO2 sinh thêm = (1,2-0,4V)/4 = 0,3-0,1V (mol) => ∑nO2 = 0,6-0,3V (mol) DD Y phản ứng với NaOH và KOH không sinh ra kết tủa nên có các TH sau: - TH1: R2+ bị điện phân hết: ne ≥ 2nR2+ => 2,4-0,8V ≥ 2.0,45V => V ≤ 24/17 - TH2: R2+ điện phân chưa hết, OH- phản ứng với H+ và R2+ tạo R(OH)2 sau đó hòa tan R(OH)2 Lời giải chi tiết :
Do Y tác dụng với kiềm nên R2+ có bị điện phân nR(NO3)2 = 0,45V mol; nNaCl = 0,4V mol *t giây: Thu được hỗn hợp khí ở anot nên Cl- bị điện phân hết, H2O đã bị điện phân nCl2 = 0,5nNaCl = 0,2V mol n khí = nCl2 + nO2 => nO2 = 0,3 – 0,2V (mol) => n e (t giây) = 2nCl2 + 4nO2 = 2.0,2V + 4(0,3-0,2V) = 1,2-0,4V (mol) *2t giây: n e (2t giây) = 2,4-0,8V Trong t giây tiếp theo nO2 sinh thêm = (1,2-0,4V)/4 = 0,3-0,1V (mol) => ∑nO2 = 0,6-0,3V (mol) DD Y phản ứng với NaOH và KOH không sinh ra kết tủa nên có các TH sau: - TH1: R2+ bị điện phân hết: ne ≥ 2nR2+ => 2,4-0,8V ≥ 2.0,45V => V ≤ 24/17 Catot: R2+ + 2Cl- → R + Cl2 0,2V ← 0,4V R2+ + H2O → R + 2H+ + 0,5O2 0,25V → 0,5V H2O → H2 + O2 nOH- = nH+ => 0,5V = 0,5 => V = 1 (thỏa mãn) - TH2: R2+ điện phân chưa hết, OH- phản ứng với H+ và R2+ tạo R(OH)2 sau đó hòa tan R(OH)2 ne < 2nR2+ => 2,4-0,8V < 2.0,45V => V > 24/17 nR2+ bị đp = ne : 2 = 1,2-0,4V => nR2+ dư = 0,85V-1,2 nH+ = 4nO2 = 2,4-1,2V => nOH- = nH+ + 4nR2+ => 0,5 = 2,4-1,2V + 4(0,85V-1,2) => V = 1,318 (không thỏa mãn)
Câu 34 :
Để bảo quản natri, người ta phải ngâm natri trong
Đáp án : B Phương pháp giải :
Dựa vào kiến thức bảo quản kim loại kiềm Lời giải chi tiết :
Đáp án B Chú ý
Natri rất dễ phản ứng với nước ở nhiệt độ thường, do vậy để bảo quản natri, người ta phải ngâm chúng trong dầu hỏa. Đáp án B
Câu 35 :
Nhỏ từ từ 62,5 ml dung dịch hỗn hợp Na2CO3 0,08M và KHCO3 0,12M vào 125 ml dung dịch HCl 0,1M và khuấy đều. Sau các phản ứng, thu được V ml khí CO2(đktc). Giá trị của V là
Đáp án : A Phương pháp giải :
Khi cho từ từ dd hỗn hợp Na2CO3 và NaHCO3 vào dd HCl thì phản ứng xảy ra theo đúng tỉ lệ Na2CO3 và NaHCO3 ban đầu So sánh mol nH+ với 2nCO32- + nHCO3- để biết H+ phản ứng hết hay CO32-; HCO32- pư hết. Tính toán theo PTHH PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O NaHCO3 + HCl → NaCl + CO2↑ + H2O Lời giải chi tiết :
nNa2CO3 = 0,0625.0,08=0,005 (mol) ; nKHCO3 = 0,0625.0,12 = 0,0075 (mol) nHCl = 0,125.0,1 = 0,0125 (mol) Ta có:\({{{n_{N{a_2}C{O_3}}}} \over {{n_{KHC{O_3}}}}} = {{0,005} \over {0,0075}} = {2 \over 3}\) Khi cho từ từ dd hỗn hợp Na2CO3 và NaHCO3 vào dd HCl thì phản ứng xảy ra theo đúng tỉ lệ Na2CO3 và NaHCO3 ban đầu là 2:3 Ta thấy: nH+ = 0,0125 < 2nCO32- + nHCO3- = 0,0175 nên lượng H+ thiếu Đặt nNa2CO3 = 2a (mol); nNaHCO3 = 3a (mol) PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O 2a → 4a → 2a (mol) NaHCO3 + HCl → NaCl + CO2↑ + H2O 3a → 3a → 3a (mol) → ∑ nHCl = 7a = 0,0125 => a = 1/560 (mol) → VCO2(đktc) = 5a.22,4 = 5.1/560.22,4 = 0,2 (lít) = 200 (ml)
Câu 36 :
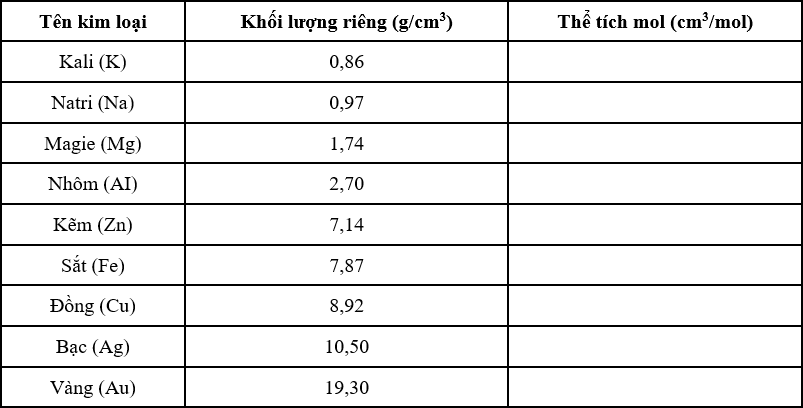
Dựa vào khối lượng riêng của kim loại, hãy tính thể tích mol kim loại và ghi kết quả vào bảng sau:
Chọn phát biểu không đúng trong các phát biểu sau:
Đáp án : B Phương pháp giải :
Xét 1 mol chất có m = M (g) Thể tích mol là: \(V = \frac{m}{D} \Leftrightarrow V = \frac{M}{D}\) Chú ý: Lấy giá trị M các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học. Lời giải chi tiết :
Xét 1 mol chất có m = M (g) Thể tích mol là: \(V = \frac{m}{D} \Leftrightarrow V = \frac{M}{D}\) Chú ý: Lấy giá trị M các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học. Áp dụng công thức để tính thể tích mol ta được kết quả như bảng sau:
Từ bảng kết quả trên ta thấy thể tích mol của Mg là 13,79 cm3 không phải là 19,73 cm3.
Câu 37 :
Phản ứng giữa các cặp chất nào sau đây không tạo ra kim loại?
Đáp án : D Phương pháp giải :
Dựa vào dãy hoạt động hóa học của kim loại, kim loại đứng trước đẩy kim loại đứng sau ra khỏi dung dịch muối. Lời giải chi tiết :
A. Fe + CuSO4 → FeSO4 + Cu↓ B. AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓ C. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓ D. Cu + 2FeCl3 → CuCl2 + 2FeCl2 => không thu được kim loại Chú ý
Vị trí của cặp Fe3+/Fe2+ trong dãy điện hóa học
Câu 38 :
Cho hỗn hợp Fe và Zn tác dụng với dung dịch hỗn hợp chứa 0,01 mol HCl và 0,05 mol H2SO4. Sau phản ứng thu được chất rắn X, dung dịch Y và khí Z. Cho khí Z đi qua CuO dư, đun nóng thu được m gam Cu. Giá trị của m là
Đáp án : B Phương pháp giải :
- Sau phản ứng thu được chất rắn → axit phản ứng hết - BTNT "H" → số mol hiđro → số mol Cu Lời giải chi tiết :
Sau phản ứng thu được chất rắn → axit phản ứng hết BTNT "H" \(n_{H^+}=n_{HCl}+2n_{H_2SO_4}=2n_{H_2}=0,01+2\times0,05=0.11mol\) → \(n_{H_2}=0,055mol\) \( CuO +H_2 \to Cu + H_2O\) \(n_{Cu}=n_{H_2}=0,055mol\) → \(m_{Cu}=3,52g\)
Câu 39 :
Khử hoàn toàn m gam Fe2O3 cần vừa đủ 4,704 lít khí CO (đktc). Giá trị của m là
Đáp án : C Phương pháp giải :
Bài toán khử oxit KL bằng CO: nCO = nO(oxit) Lời giải chi tiết :
Khi oxit bị khử bởi CO: nO(oxit) = nCO = 4,704/22,4 = 0,21 mol BTNT "O": 3nFe2O3 = nO(oxit) = 0,21 => nFe2O3 = 0,07 mol => m = 160.0,07 = 11,2 gam
Câu 40 :
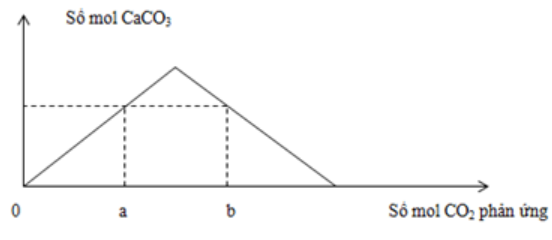
Thổi từ từ khí CO2 đến dư vào dung dịch chứa 0,12 mol Ca(OH)2 . Sự phụ thuộc của số mol kết tủa thu được vào số mol CO2 phản ứng được biểu điễn theo đồ thị sau:
Mối quan hệ của a và b là:
Đáp án : A Lời giải chi tiết :
Các phản ứng: Ca(OH)2 + CO2 → CaCO3 + H2O(1) CaCO3 + CO2 + H2O → Ca(HCO3)2(2) - Tại nCO2 = a (đồ thị đi lên) => Chỉ xảy ra phản ứng (1) => nCaCO3 = nCO2 = a - Tại nCO2 = b (đồ thị đi xuống): Kết tủa đã bị hòa tan một phần Sản phẩm lúc này gồm: CaCO3: a mol Ca(HCO3)2: 0,12 - a (BTNT "Ca") BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2 => b = a + 2(0,12 - a) => b = 0,24 - a |



















Danh sách bình luận