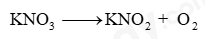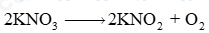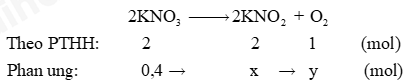Đề thi giữa kì 1 KHTN 8 Kết nối tri thức - Đề số 9Cho các phát biểu sau: (1) Không sử dụng hoá chất đựng trong đồĐề bài
I. Trắc nghiệm
Câu 1 :
Cho các phát biểu sau: (1) Không sử dụng hoá chất đựng trong đồ chứa không có nhãn hoặc nhãn mờ, mất chữ. (2) Trước khi sử dụng cần đọc cẩn nhận nhãn hoá chất và cần tìm hiểu kĩ các tính chất chất, các lưu ý, cảnh báo của mỗi loại hoá chất để thực hiện thí nghiệm an toàn. (3) Thực hiện thí nghiệm cẩn thận, không dùng tay trực tiếp lấy hoá chất. (4) Khi bị hoá chất dính vào người hoặc hoá chất bị đổ, tràn ra ngoài cần báo cáo với nhóm trưởng để được hướng dẫn xử lí. (5) Các hoá chất dùng xong còn thừa nên đổ trở lại bình chứa đúng với hoá chất đó để tiết kiệm. Số phát biểu đúng khi nói về quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm:
Câu 2 :
Khi có hỏa hoạn trong phòng thực hành cần xử lí theo cách nào sau đây:
Câu 4 :
Dùng nước mưa đun sôi rồi để nguội làm nước uống, lâu ngày thấy trong ấm có những cặn trắng. Biết rằng trong nước mưa có chứa nhiều muối Calcium hydrocarbonate. Muối này dễ bị nhiệt phân hủy sinh ra Calcium carbonate (là chất kết tủa trắng), khí carbon dioxide và nước. Hãy cho biết dấu hiệu có phản ứng xảy ra khi đun nước sôi rồi để nguội.
Câu 5 :
Trong 3 mol phân tử H2S chứa số phân tử là
Câu 6 :
Khối lượng của 0,15 mol Aluminium (Al) là
Câu 7 :
Thể tích của hỗn hợp khí gồm 0,15 mol O2, 0,25 mol H2 và 0,3 mol N2 ở điều kiện tiêu chuẩn là
Câu 8 :
Biết tỉ khối của khí B với khí oxygen là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Xác định khối lượng mol của khí A?
Câu 9 :
Nồng độ mol của dung dịch là
Câu 10 :
Hoà tan 15 gam sodium chloride (NaCl) vào 80 gam nước, nồng độ phần trăm của dung dịch thu được là
Câu 11 :
Trộn 4 lít dung dịch KCl 2M với 2 lít dung dịch KCl 5M. Tính nồng độ mol của dung dịch KCl sau khi trộn?
Câu 12 :
Cho 150 ml dung dịch H2SO4 22,44% (D = 1,31 g/ml). Tính số mol của H2SO4 có trong dung dịch?
Câu 13 :
Lập phương trình hóa học của kim loại iron tác dụng với dung dịch sulfuric acid biết sản phẩm là iron (II) sulfate và có khí hydrogen bay lên
Câu 14 :
Cho 2,4 gam magnessium (Mg) cháy trong không khí thu được 4 gam Magnessium oxide (MgO). Tính khối lượng khí oxygen đã phản ứng?
Câu 15 :
Cho Iron (Fe) tác dụng với 100,5 gam dung dịch hydrochloric acid (HCl) tạo ra 12,7 gam iron (II) chloride (FeCl2) và 0,2 gam khí hydrogen (H2).Tính khối lượng của iron đã tham gia phản ứng?
Câu 16 :
Cho luồng khí H2 dư đi qua ống thủy tinh chứa 20 gam bột CuO ở nhiệt độ cao theo phương trình phản ứng như sau: CuO + H2 \( \to \) Cu + H2O. Sau phản ứng thu được 12 gam Cu. Hiệu suất của phản ứng là:
Câu 17 :
Điền từ, cụm từ thích hợp hoàn thiện khái niệm về chất xúc tác: "Chất xúc tác là chất làm ...(1)... tốc độ phản ứng nhưng ...(2)... trong quá trình phản ứng"
Câu 18 :
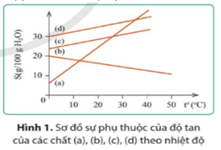
Đồ thị hình 1 biểu thị sự phụ thuộc của độ tan (S) của các chất (a), (b), (c) và (d) theo nhiệt độ (t°C). Ở 30°C, chất có độ tan nhỏ nhất là:
Câu 19 :
Phản ứng nào sau đây là phản ứng toả nhiệt
Câu 20 :
Các hiện tượng sau đây, hiện tượng nào có biến đổi vật lí 1. Hoà tan muối ăn vào nước ta được dung dịch muối ăn. 2. Nước bị bốc hơi khi trời nắng. 3. Cồn để trong lọ không kín bị bay hơi. 4. Nước bị đóng băng hai cực Trái đất. 5. Cho vôi sống CaO hoà tan vào nước.
Câu 21 :
Tính nồng độ mol của 350 ml dung dịch chứa 74,2 gam sodium carbonate (Na2CO3) là
Câu 22 :
Hòa tan 40 gam đường với nước, thu được dung dịch nước đường có nồng độ 20%. Khối lượng dung dịch nước đường thu được là:
Câu 23 :
Quá trình nào sau đây chỉ xảy ra biến đổi vật lí?
II. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Cho các phát biểu sau: (1) Không sử dụng hoá chất đựng trong đồ chứa không có nhãn hoặc nhãn mờ, mất chữ. (2) Trước khi sử dụng cần đọc cẩn nhận nhãn hoá chất và cần tìm hiểu kĩ các tính chất chất, các lưu ý, cảnh báo của mỗi loại hoá chất để thực hiện thí nghiệm an toàn. (3) Thực hiện thí nghiệm cẩn thận, không dùng tay trực tiếp lấy hoá chất. (4) Khi bị hoá chất dính vào người hoặc hoá chất bị đổ, tràn ra ngoài cần báo cáo với nhóm trưởng để được hướng dẫn xử lí. (5) Các hoá chất dùng xong còn thừa nên đổ trở lại bình chứa đúng với hoá chất đó để tiết kiệm. Số phát biểu đúng khi nói về quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm:
Đáp án : C Phương pháp giải :
Dựa vào an toàn trong phòng thực hành. Lời giải chi tiết :
(1), (2), (3), (4) là các bước an toàn trong phòng thực hành. Đáp án C
Câu 2 :
Khi có hỏa hoạn trong phòng thực hành cần xử lí theo cách nào sau đây:
Đáp án : A Phương pháp giải :
Dựa vào quy tắc phòng cháy chữa cháy. Lời giải chi tiết :
Khi có hỏa hoạn trong phòng thực hành cần bình tĩnh, sử dụng các biện pháp dập tắt ngọn lửa theo hướng dẫn của phòng thực hành như ngắt toàn bộ hệ thống điện, đưa toàn bộ các hóa chất, các chất dễ cháy ra khu vực an toàn… Đáp án A
Đáp án : B Phương pháp giải :
Dựa vào các dụng cụ trong phòng thực hành. Lời giải chi tiết :
Hình ảnh trên là ống hút nhỏ giọt dùng để lấy các hóa chất lỏng.
Câu 4 :
Dùng nước mưa đun sôi rồi để nguội làm nước uống, lâu ngày thấy trong ấm có những cặn trắng. Biết rằng trong nước mưa có chứa nhiều muối Calcium hydrocarbonate. Muối này dễ bị nhiệt phân hủy sinh ra Calcium carbonate (là chất kết tủa trắng), khí carbon dioxide và nước. Hãy cho biết dấu hiệu có phản ứng xảy ra khi đun nước sôi rồi để nguội.
Đáp án : A Phương pháp giải :
Dựa vào quá trình biến đổi hóa học. Lời giải chi tiết :
Dấu hiệu nhận biết là có chất kết tủa trắng xuất hiện. Đáp án A
Câu 5 :
Trong 3 mol phân tử H2S chứa số phân tử là
Đáp án : A Phương pháp giải :
Dựa vào 1 mol có chứa 6,022.1023 hạt. Lời giải chi tiết :
3 mol phân tử H2S có chứa số phân tử là: 3.6,022.1023 = 18,066.1023 Đáp án A
Câu 6 :
Khối lượng của 0,15 mol Aluminium (Al) là
Đáp án : A Phương pháp giải :
Dựa vào công thức tính khối lượng gam: m = n.M. Lời giải chi tiết :
m Al = 0,15.27 = 4,05gam Đáp án A
Câu 7 :
Thể tích của hỗn hợp khí gồm 0,15 mol O2, 0,25 mol H2 và 0,3 mol N2 ở điều kiện tiêu chuẩn là
Đáp án : A Phương pháp giải :
Dựa vào công thức tính thể tích ở điều kiện chuẩn: V = n.24,79 (L) Lời giải chi tiết :
V hỗn hợp khí = VO2 + V H2 + V N2 = 0,15.24,79 + 0,25.24,79 + 0,3.24,79 = 17,353L Đáp án A
Câu 8 :
Biết tỉ khối của khí B với khí oxygen là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Xác định khối lượng mol của khí A?
Đáp án : A Phương pháp giải :
Dựa vào tỉ khối của chất khí. Lời giải chi tiết :
Vì tỉ khối của chất B với khí oxygen là 0,5 \( \to \frac{{{M_B}}}{{{M_{{O_2}}}}} = 0,5 \to {M_B} = 0,5.32 = 16\) Vì tỉ khối của chất A đối với khí B là 2,125 \( \to \frac{{{M_A}}}{{{M_B}}} = 2,125 \to {M_A} = 2,125.16 = 34g/mol\) Đáp án A
Câu 9 :
Nồng độ mol của dung dịch là
Đáp án : A Phương pháp giải :
Dựa vào khái niệm nồng độ mol của dung dịch. Lời giải chi tiết :
Nồng độ mol của dung dịch là số mol chất tan có trong 1 lít dung dịch. Đáp án A
Câu 10 :
Hoà tan 15 gam sodium chloride (NaCl) vào 80 gam nước, nồng độ phần trăm của dung dịch thu được là
Đáp án : A Phương pháp giải :
Dựa vào công thức tính nồng độ phần trăm của dung dịch: C% = \(\frac{{{m_{c\tan }}}}{{{m_{{\rm{dd}}}}}}.100\) Lời giải chi tiết :
m dung dịch = m NaCl + m H2O = 15 + 80 = 95g C% = \(\frac{{{m_{c\tan }}}}{{{m_{{\rm{dd}}}}}}.100\)= \(\frac{{15}}{{95}}.100 = 15,8\% \)
Câu 11 :
Trộn 4 lít dung dịch KCl 2M với 2 lít dung dịch KCl 5M. Tính nồng độ mol của dung dịch KCl sau khi trộn?
Đáp án : A Phương pháp giải :
Dựa vào công thức tính nồng độ mol của dung dịch: CM = \(\frac{n}{V}\) Lời giải chi tiết :
n KCl (1) = 4.2 = 8 mol n KCl (2) = 2.5 = 10 mol CM = \(\frac{{8 + 10}}{{4 + 2}} = 3M\) Đáp án A
Câu 12 :
Cho 150 ml dung dịch H2SO4 22,44% (D = 1,31 g/ml). Tính số mol của H2SO4 có trong dung dịch?
Đáp án : A Phương pháp giải :
Dựa vào công thức tính C%. Lời giải chi tiết :
Ta có: m dung dịch H2SO4 = D.V = 150.1,31 = 196,5g m H2SO4 = 196,5.22,44% = 44,0946g n H2SO4 = \(\frac{{44,0946}}{{98}} = 0,45mol\) Đáp án A
Câu 13 :
Lập phương trình hóa học của kim loại iron tác dụng với dung dịch sulfuric acid biết sản phẩm là iron (II) sulfate và có khí hydrogen bay lên
Đáp án : A Phương pháp giải :
Dựa vào cách lập phương trình hóa học. Lời giải chi tiết :
Fe + H2SO4 → FeSO4 + H2 Đáp án A
Câu 14 :
Cho 2,4 gam magnessium (Mg) cháy trong không khí thu được 4 gam Magnessium oxide (MgO). Tính khối lượng khí oxygen đã phản ứng?
Đáp án : A Phương pháp giải :
Dựa vào số mol của Mg và MgO. Lời giải chi tiết :
n Mg = 2,4 : 24 = 0,1 mol n MgO = 4 : 40 = 0,1 mol 2Mg + O2 \( \to \)2MgO Theo phương trình hóa học: n O2 = \(\frac{1}{2}{n_{MgO}} = 0,1.\frac{1}{2} = 0,05mol\) m O2 = 0,05.32 = 1,6gam Đáp án A
Câu 15 :
Cho Iron (Fe) tác dụng với 100,5 gam dung dịch hydrochloric acid (HCl) tạo ra 12,7 gam iron (II) chloride (FeCl2) và 0,2 gam khí hydrogen (H2).Tính khối lượng của iron đã tham gia phản ứng?
Đáp án : A Phương pháp giải :
Dựa vào tính theo phương trình hóa học. Lời giải chi tiết :
n FeCl2 = 12,7 : 127 = 0,1 mol n H2 = 0,2 : 2 = 0,1 mol Fe + 2HCl \( \to \) FeCl2 + H2 Theo phương trình hóa học: n Fe = n H2 = 0,1 mol m Fe = 0,1.56 = 5,6 gam Đáp án A
Câu 16 :
Cho luồng khí H2 dư đi qua ống thủy tinh chứa 20 gam bột CuO ở nhiệt độ cao theo phương trình phản ứng như sau: CuO + H2 \( \to \) Cu + H2O. Sau phản ứng thu được 12 gam Cu. Hiệu suất của phản ứng là:
Đáp án : A Phương pháp giải :
Dựa vào công thức tính hiệu suất của phản ứng. Lời giải chi tiết :
n CuO = 20 : 80 = 0,25 mol n Cu = 12 : 64 = 0,1875 mol Theo phương trình phản ứng: n Cu = n CuO phản ứng = 0,1875 mol H% = \(\frac{{0,1875}}{{0,25}}.100 = 75\% \) Đáp án A
Câu 17 :
Điền từ, cụm từ thích hợp hoàn thiện khái niệm về chất xúc tác: "Chất xúc tác là chất làm ...(1)... tốc độ phản ứng nhưng ...(2)... trong quá trình phản ứng"
Đáp án : A Phương pháp giải :
Dựa vào khái niệm chất xúc tác. Lời giải chi tiết :
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị tiêu hao trong quá trình phản ứng. Đáp án A
Câu 18 :
Đồ thị hình 1 biểu thị sự phụ thuộc của độ tan (S) của các chất (a), (b), (c) và (d) theo nhiệt độ (t°C). Ở 30°C, chất có độ tan nhỏ nhất là:
Đáp án : A Phương pháp giải :
Dựa vào sơ đồ phụ thuộc của chất tan theo nhiệt độ. Lời giải chi tiết :
Khi tăng nhiệt độ, độ tan của chất (b) giảm dần. Đáp án A
Câu 19 :
Phản ứng nào sau đây là phản ứng toả nhiệt
Đáp án : A Phương pháp giải :
Dựa vào năng lượng của phản ứng. Lời giải chi tiết :
Phản ứng đốt cháy gas tỏa nhiệt mạnh nên là phản ứng tỏa nhiệt. Đáp án A
Câu 20 :
Các hiện tượng sau đây, hiện tượng nào có biến đổi vật lí 1. Hoà tan muối ăn vào nước ta được dung dịch muối ăn. 2. Nước bị bốc hơi khi trời nắng. 3. Cồn để trong lọ không kín bị bay hơi. 4. Nước bị đóng băng hai cực Trái đất. 5. Cho vôi sống CaO hoà tan vào nước.
Đáp án : A Phương pháp giải :
Quá trình biến đổi vật lí chỉ làm thay đổi về hình dạng, kích thước,…không có chất mới tạo thành. Lời giải chi tiết :
1, 2, 3, 4 là hiện tượng vật lí vì không có chất mới tạo thành. Đáp án A
Câu 21 :
Tính nồng độ mol của 350 ml dung dịch chứa 74,2 gam sodium carbonate (Na2CO3) là
Đáp án : A Phương pháp giải :
Dựa vào công thức tính nồng độ mol của chất. Lời giải chi tiết :
n Na2CO3 = 74,2 : 106 = 0,7 mol CM = \(\frac{{0,7}}{{0,35}} = 2M\) Đáp án A
Câu 22 :
Hòa tan 40 gam đường với nước, thu được dung dịch nước đường có nồng độ 20%. Khối lượng dung dịch nước đường thu được là:
Đáp án : C Phương pháp giải :
Dựa vào công thức tính nồng độ %. Lời giải chi tiết :
Khối lượng dung dịch nước đường thu được là: 40 : 20% = 200 gam Đáp án C
Câu 23 :
Quá trình nào sau đây chỉ xảy ra biến đổi vật lí?
Đáp án : B Phương pháp giải :
Dựa vào khái niệm về biến đổi vật lí và biến đổi hóa học. Lời giải chi tiết :
Quá trình thắp sáng bóng đèn dây tóc là biến đổi vật lí vì không tạo ra chất mới. Đáp án B
II. Tự luận
Lời giải chi tiết :
a) Cân bằng PTHH:
b) Số mol KNO2: \({\rm{x}}\,\,{\rm{ = }}\,\,\frac{{{\rm{0,4}}\,{\rm{.}}\,\,{\rm{2}}}}{{\rm{2}}}\,{\rm{ = }}\,\,{\rm{0,4}}\,\,{\rm{(mol)}}\,\); Số mol O2: \(y\, = \,\frac{{0,4\,{\rm{.}}\,\,1}}{2}\,\,{\rm{ = }}\,\,{\rm{0,2}}\,\,{\rm{(mol)}}\,.\) c) Số mol O2 \( = \,\frac{{4,958\,}}{{24,79}}\,\,{\rm{ = }}\,\,{\rm{0,2}}\,\,{\rm{(mol)}}\,\) => Số mol KNO3 = 0,2.2 = 0,4 mol. Khối lượng KNO2: \({\rm{0,4}}\,{\rm{.}}\,{\rm{122,5}}\,{\rm{ = }}\,49\,{\rm{(g)}}{\rm{.}}\) Phương pháp giải :
Dựa vào định luật bảo toàn khối lượng. Lời giải chi tiết :
n CaO = 2,8 : 56 = 0,05 mol CaO + H2O \( \to \)Ca(OH)2 0,05 \( \to \) 0,05 m Ca(OH)2 = 0,05 . 74 = 3,7g khối lượng nước = D.V = 1.400 = 400g Khối lượng dung dịch Ca(OH)2 là: 400 + 2,8 = 402,8g Phương pháp giải :
Dựa vào công thức tính thể tích ở điều kiện chuẩn. Lời giải chi tiết :
a) Gọi số mol Cl2 và O2 lần lượt là a và 2a mol. %VCl2 = \(\frac{a}{{a + 2{\rm{a}}}}.100 = 33,33\% \) %V O2 = 100 – 33,33% = 66,67% %m Cl2 = \(\frac{{a.71}}{{a.71 + 32.2{\rm{a}}}}.100 = 52,6\% \) %m O2 = 100 – 52,6 = 47,4% b) \({\bar M_{hh}} = \frac{{{m_{C{l_2}}} + {m_{{O_2}}}}}{{{n_{C{l_2}}} + {n_{{O_2}}}}} = \frac{{71.a + 32.2{\rm{a}}}}{{a + 2{\rm{a}}}} = 45g/mol\) Tỉ khối hỗn hợp A so với khí H2 là: \(\frac{{{M_A}}}{{{M_{{H_2}}}}} = \frac{{45}}{2} = 22,5\) c) nA = 7,437 : 24,79 = 0,3 mol Khối lượng A là: 0,3.45 = 13,5g Phương pháp giải :
Dựa vào công thức tính hiệu suất phản ứng. Lời giải chi tiết :
a) Bảo toàn khối lượng: m KClO3 = m chất rắn + m O2 \( \to \)m O2 = 50 – 38 = 12g n O2 = 12 : 32 = 0,375 mol 2KClO3 \( \to \)2KCl + 3O2 Theo phương trình hóa học: n KClO3 phản ứng = \(\frac{2}{3}{n_{{O_2}}} = \frac{2}{3}.0,375 = 0,25mol\) H% = \(\frac{{{m_{KClO{3_{p/u}}}}}}{{{m_{KClO{3_{b/dau}}}}}}.100 = \frac{{0,25.122,5}}{{50}}.100 = 61,25\% \) b) m KClO3 dư = 50 – 0,25.122,5 = 19,375g n KCl = n KClO3 phản ứng = 0,25 mol m KCl = 0,25.74,5 = 18,625g m O2 = 22g
|