Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 9Khí NH3 không thể hiện tính khử trong phản ứng nào sau đây?Đề bài
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Khí NH3 không thể hiện tính khử trong phản ứng nào sau đây?
Câu 2 :
Hệ cân bằng sau được thực hiện trong bình kín: CO(g) + H2O(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CO2(g) + H2(g) \({\Delta _r}H_{298}^o < 0\) Cân bằng trên chuyển dịch theo chiều thuận khi
Câu 3 :
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
Câu 4 :
Phát biểu nào sau đây không đúng?
Câu 5 :
Theo Bronsted, phát biểu nào dưới đây đúng?
Câu 6 :
Nhúng hai đũa thủy tinh vào bình đựng dung dịch HCl đặc và NH3 đặc, đưa hai đầu đũa lại gần nhau thấy xuất hiện khói trắng. Thành phần của khói trắng là
Câu 7 :
Các yếu tố ảnh hưởng đến cân bằng hóa học là
Câu 8 :
Dung dịch nào sau đây có pH > 7?
Câu 9 :
Nitric acid thường được sử dụng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng các kim loại trong quặng là do nitric acid có
Câu 10 :
Xét câu bằng: \(F{e_2}{O_3}(s) + 3CO(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2Fe(s) + 3C{O_2}(g)\). Biểu thức hằng số cân bằng của hệ là
Câu 11 :
Cho 7,437 lít N2 tác dụng với 12,395 lít H2, thu được 14,874 lít hỗn hợp khí. Hiệu suất của phản ứng là
Câu 12 :
Chất nào sau đây không phải chất điện li
Câu 13 :
Công thức tính pH là
Câu 14 :
Trộn 200ml dung dịch H2SO4 0,1375M với 300ml dung dịch NaOH 0,2M. Tính pH của dung dịch tạo thành
Câu 15 :
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1M. Để chuẩn độ 10ml dung dịch HCl này cần 20ml dung dịch NaOH. Giá trị nồng độ của dung dịch HCl trên là?
Câu 16 :
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do
Câu 17 :
Oxide phổ biến của nitrogen trong không khí là
Phần 2. Câu hỏi đúng, sai
Phản ứng trên là phản ứng thuận nghịch.
Đúng
Sai
Cl2, H2O là chất tham gia của phản ứng thuận.
Đúng
Sai
HCl, HClO là sản phẩm của phản ứng nghịch.
Đúng
Sai
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong điều kiện khác nhau.
Đúng
Sai
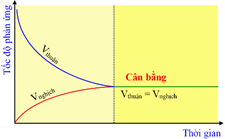
Đồ thị trên biểu diễn tốc độ của phản ứng một chiều phụ thuộc vào thời gian.
Đúng
Sai
Tại trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Đúng
Sai
Khi phản ứng thuận nghịch xảy ra thì tốc độ phản ứng thuận tăng dần còn tốc độ phản ứng nghịch giảm dần.
Đúng
Sai
Khi phản ứng đạt trạng thái cân bằng thì phản ứng thuận và phản ứng nghịch dừng lại.
Đúng
Sai
Câu 3 :
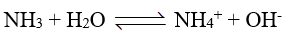
Xét tính chất hóa học của NH3. Khí NH3 tác dụng với nước theo phản ứng:
Đúng
Sai
Trong phản ứng của NH3 tác dụng với dung dịch HCl thì NH3 đóng vai trò làm chất oxi hóa.
Đúng
Sai
Trong phản ứng của NH3 tác dụng với O2 thì NH3 đóng vai trò làm chất khử.
Đúng
Sai
Phản ứng:
Đúng
Sai
Câu 4 :
Nitric acid là một chất có tính oxi hóa mạnh. Cu không tan trong dung dịch HCl nhưng tan trong dung dịch HNO3 loãng.
Đúng
Sai
Cho Al tác dụng với HNO3 đặc nguội thấy có khí màu nâu đỏ thoát ra.
Đúng
Sai
Vàng (Au) không tan được trong dung dịch HNO3 đặc nhưng có thể tan trong dung dịch nước cường toan (hỗn hợp HNO3 đặc và HCl tỉ lệ thể tích 1 : 3).
Đúng
Sai
Do có tính oxi hóa mạnh nên HNO3 thường dùng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng kim loại trong quặng.
Đúng
Sai
Phần 3. Trả lời ngắn
Lời giải và đáp án
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Khí NH3 không thể hiện tính khử trong phản ứng nào sau đây?
Đáp án : A Phương pháp giải :
Dựa vào tính chất hóa học của ammonia. Lời giải chi tiết :
Khí NH3 không thể hiện tính khử khi phản ứng với HCl, vì không thay đổi số oxi hóa. Đáp án A
Câu 2 :
Hệ cân bằng sau được thực hiện trong bình kín: CO(g) + H2O(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CO2(g) + H2(g) \({\Delta _r}H_{298}^o < 0\) Cân bằng trên chuyển dịch theo chiều thuận khi
Đáp án : B Phương pháp giải :
Dựa vào nguyên lí chuyển dịch cân bằng Le – Chatelier. Lời giải chi tiết :
Cân bằng trên chuyển dịch theo chiều thuận khi giảm nhiệt độ của hệ vì phản ứng tỏa nhiệt. Đáp án B
Câu 3 :
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
Đáp án : C Phương pháp giải :
Dựa vào chất điện li. Lời giải chi tiết :
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các ion trái dấu. Đáp án C
Câu 4 :
Phát biểu nào sau đây không đúng?
Đáp án : D Phương pháp giải :
Dựa vào cân bằng hóa học. Lời giải chi tiết :
D sai, vì cân bằng hóa học là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch và tại đó phản ứng vẫn tiếp tục xảy ra. Đáp án D
Câu 5 :
Theo Bronsted, phát biểu nào dưới đây đúng?
Đáp án : A Phương pháp giải :
Dựa vào thuyết acid – base của Lowry – Bronsted. Lời giải chi tiết :
Theo Bronsted, acid là chất có khả năng cho proton. Đáp án A
Câu 6 :
Nhúng hai đũa thủy tinh vào bình đựng dung dịch HCl đặc và NH3 đặc, đưa hai đầu đũa lại gần nhau thấy xuất hiện khói trắng. Thành phần của khói trắng là
Đáp án : B Phương pháp giải :
Dựa vào tính chất hóa học của ammonia. Lời giải chi tiết :
Khi NH3 đặc tác dụng với dung dịch HCl đặc, thu được muối NH4Cl. Đáp án B
Câu 7 :
Các yếu tố ảnh hưởng đến cân bằng hóa học là
Đáp án : D Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến cân bằng hóa học. Lời giải chi tiết :
Nồng độ, nhiệt độ và áp suất là các yếu tố ảnh hưởng đến cân bằng hóa học. Đáp án D
Câu 8 :
Dung dịch nào sau đây có pH > 7?
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về pH. Lời giải chi tiết :
NaOH là dung dịch base có pH > 7. Đáp án C
Câu 9 :
Nitric acid thường được sử dụng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng các kim loại trong quặng là do nitric acid có
Đáp án : D Phương pháp giải :
Dựa vào tính chất hóa học của nitric acid. Lời giải chi tiết :
Nitric acid có tính oxi hóa mạnh nên thường được sử dụng để phá mẫu quặng trong việc nghiên cứu. Đáp án D
Câu 10 :
Xét câu bằng: \(F{e_2}{O_3}(s) + 3CO(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2Fe(s) + 3C{O_2}(g)\). Biểu thức hằng số cân bằng của hệ là
Đáp án : B Phương pháp giải :
Dựa vào công thức tính hằng số cân bằng. Lời giải chi tiết :
Biểu thức cân bằng của phản ứng là: \({K_C} = \frac{{{{{\rm{[}}C{O_2}]}^3}}}{{{{{\rm{[}}CO]}^3}}}\) Đáp án B
Câu 11 :
Cho 7,437 lít N2 tác dụng với 12,395 lít H2, thu được 14,874 lít hỗn hợp khí. Hiệu suất của phản ứng là
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của nitrogen. Lời giải chi tiết :
n N2 = 7,437 : 24,79 = 0,3 mol n H2 = 12,395 : 24,79 = 0,5 mol n hỗn hợp khí = 14,874 : 24,79 = 0,6 mol N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2NH3 Trước phản ứng: 0,3 0,5 0 Phản ứng: a 3a 2a Sau phản ứng: 0,3 – a 0,5 – 3a 2a n hỗn hợp khí = n N2 dư + n H2 dư + n NH3 = 0,3 – a + 0,5 – 3a + 2a = 0,6 \( \to \)a = 0,1 mol H% = \(\frac{{{n_{H2tt}}}}{{{n_{H2lt}}}}.100 = \frac{{0,3}}{{0,5}}.100 = 60\% \) Đáp án C
Câu 12 :
Chất nào sau đây không phải chất điện li
Đáp án : D Phương pháp giải :
Dựa vào khái niệm về chất điện li. Lời giải chi tiết :
C6H12O6 không phải chất điện li. Đáp án D
Câu 13 :
Công thức tính pH là
Đáp án : B Phương pháp giải :
Dựa vào công thức tính pH. Lời giải chi tiết :
pH = = - lg[H+] Đáp án B
Câu 14 :
Trộn 200ml dung dịch H2SO4 0,1375M với 300ml dung dịch NaOH 0,2M. Tính pH của dung dịch tạo thành
Đáp án : D Phương pháp giải :
Dựa vào công thức tính pH. Lời giải chi tiết :
n H2SO4 = 0,2.0,1375 = 0,0275 mol\( \to \)n H+ = 0,0275.2 = 0,055 mol n NaOH = 0,3.0,2 = 0,06 mol H+ + OH- \( \to \) H2O 0,055 0,06 n H+ < n OH- \( \to \)OH – dư \( \to \)[OH-] dư = \(\frac{{0,06 - 0,055}}{{0,2 + 0,3}} = 0,01M\) pOH = -lg[OH-] = -lg[0,01] = 2 \( \to \)pH = 14 – 2 = 12 Đáp án D
Câu 15 :
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1M. Để chuẩn độ 10ml dung dịch HCl này cần 20ml dung dịch NaOH. Giá trị nồng độ của dung dịch HCl trên là?
Đáp án : C Phương pháp giải :
Dựa vào Phương pháp chuẩn độ. Lời giải chi tiết :
CM HCl = \(\frac{{20.0,1}}{{10}} = 0,2M\) Đáp án C
Câu 16 :
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do
Đáp án : D Phương pháp giải :
Dựa vào tính chất vật lí của nitric acid. Lời giải chi tiết :
Dung dịch HNO3 bị oxi hóa phân hủy 1 phần NO2, Khí NO2 hòa tan vào dung dịch nên HNO3 để lâu thường ngả sang màu vàng. Đáp án D
Câu 17 :
Oxide phổ biến của nitrogen trong không khí là
Đáp án : B Phương pháp giải :
Dựa vào các oxide phổ biến của nitrogen. Lời giải chi tiết :
NO và NO2 là oxide phổ biến của nitrogen trong không khí. Đáp án B
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của nitrogen. Lời giải chi tiết :
Nitrogen thể hiện tính khử và tính oxi hóa. Đáp án C
Phần 2. Câu hỏi đúng, sai
Phản ứng trên là phản ứng thuận nghịch.
Đúng
Sai
Cl2, H2O là chất tham gia của phản ứng thuận.
Đúng
Sai
HCl, HClO là sản phẩm của phản ứng nghịch.
Đúng
Sai
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong điều kiện khác nhau.
Đúng
Sai
Đáp án
Phản ứng trên là phản ứng thuận nghịch.
Đúng
Sai
Cl2, H2O là chất tham gia của phản ứng thuận.
Đúng
Sai
HCl, HClO là sản phẩm của phản ứng nghịch.
Đúng
Sai
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong điều kiện khác nhau.
Đúng
Sai
Phương pháp giải :
Dựa vào nguyên lí chuyển dịch cân bằng. Lời giải chi tiết :
a. Đúng. b. Đúng. c. Sai vì phản ứng nghịch (từ phải → trái) nên HCl, HClO là chất tham gia của phản ứng nghịch. d. Sai vì phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện. Đồ thị trên biểu diễn tốc độ của phản ứng một chiều phụ thuộc vào thời gian.
Đúng
Sai
Tại trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Đúng
Sai
Khi phản ứng thuận nghịch xảy ra thì tốc độ phản ứng thuận tăng dần còn tốc độ phản ứng nghịch giảm dần.
Đúng
Sai
Khi phản ứng đạt trạng thái cân bằng thì phản ứng thuận và phản ứng nghịch dừng lại.
Đúng
Sai
Đáp án
Đồ thị trên biểu diễn tốc độ của phản ứng một chiều phụ thuộc vào thời gian.
Đúng
Sai
Tại trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Đúng
Sai
Khi phản ứng thuận nghịch xảy ra thì tốc độ phản ứng thuận tăng dần còn tốc độ phản ứng nghịch giảm dần.
Đúng
Sai
Khi phản ứng đạt trạng thái cân bằng thì phản ứng thuận và phản ứng nghịch dừng lại.
Đúng
Sai
Phương pháp giải :
Dựa vào cân bằng hóa học
Câu 3 :
Xét tính chất hóa học của NH3. Khí NH3 tác dụng với nước theo phản ứng:
Đúng
Sai
Trong phản ứng của NH3 tác dụng với dung dịch HCl thì NH3 đóng vai trò làm chất oxi hóa.
Đúng
Sai
Trong phản ứng của NH3 tác dụng với O2 thì NH3 đóng vai trò làm chất khử.
Đúng
Sai
Phản ứng:
Đúng
Sai
Đáp án
Khí NH3 tác dụng với nước theo phản ứng:
Đúng
Sai
Trong phản ứng của NH3 tác dụng với dung dịch HCl thì NH3 đóng vai trò làm chất oxi hóa.
Đúng
Sai
Trong phản ứng của NH3 tác dụng với O2 thì NH3 đóng vai trò làm chất khử.
Đúng
Sai
Phản ứng:
Đúng
Sai
Phương pháp giải :
Dựa vào tính chất hóa học của ammonia. Lời giải chi tiết :
a. đúng b. sai, trong phản ứng của NH3 tác dụng với dung dịch HCl, NH3 đóng vai trò là base. c. đúng d. sai, phản ứng
Câu 4 :
Nitric acid là một chất có tính oxi hóa mạnh. Cu không tan trong dung dịch HCl nhưng tan trong dung dịch HNO3 loãng.
Đúng
Sai
Cho Al tác dụng với HNO3 đặc nguội thấy có khí màu nâu đỏ thoát ra.
Đúng
Sai
Vàng (Au) không tan được trong dung dịch HNO3 đặc nhưng có thể tan trong dung dịch nước cường toan (hỗn hợp HNO3 đặc và HCl tỉ lệ thể tích 1 : 3).
Đúng
Sai
Do có tính oxi hóa mạnh nên HNO3 thường dùng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng kim loại trong quặng.
Đúng
Sai
Đáp án
Cu không tan trong dung dịch HCl nhưng tan trong dung dịch HNO3 loãng.
Đúng
Sai
Cho Al tác dụng với HNO3 đặc nguội thấy có khí màu nâu đỏ thoát ra.
Đúng
Sai
Vàng (Au) không tan được trong dung dịch HNO3 đặc nhưng có thể tan trong dung dịch nước cường toan (hỗn hợp HNO3 đặc và HCl tỉ lệ thể tích 1 : 3).
Đúng
Sai
Do có tính oxi hóa mạnh nên HNO3 thường dùng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng kim loại trong quặng.
Đúng
Sai
Phương pháp giải :
Dựa vào tính chất hóa học của nitric acid. Lời giải chi tiết :
a. đúng b. sai, Al không tan trong HNO3 đặc nguội. c. đúng d. đúng
Phần 3. Trả lời ngắn
Phương pháp giải :
Dựa vào công thức tính pH. Lời giải chi tiết :
pH = - lg[H+] = 4,3 Phương pháp giải :
Dựa vào công thức tính hằng số cân bằng KC. Lời giải chi tiết :
\[{K_C} = \frac{{{{{\rm{[}}N{H_3}]}^2}}}{{{\rm{[}}{N_2}]{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{]}}}^3}}} = \frac{{0,{{68}^2}}}{{0,54.{{(0,18)}^3}}} = 146,8\] Phương pháp giải :
Dựa vào sơ đồ sản xuất nitric acid HNO3. Lời giải chi tiết :
Khối lượng dung dịch nitric acid 65% là: 58,716 : 65% = 90,33 tấn. Phương pháp giải :
Dựa vào cách pha loãng dung dịch. Lời giải chi tiết :
Gọi x (L) là thể tích nước cần cho vào dịch để thực hiện việc pha chế. pH= 3 \( \Rightarrow \)[H+] = 0,01 (M) \( \Rightarrow \) \({{\rm{n}}_{{{\rm{H}}^{\rm{ + }}}}}{\rm{ = }}{{\rm{n}}_{{\rm{HCl}}}}{\rm{ = 0,01 x 0,001 = 1}}{{\rm{0}}^{{\rm{ - 5}}}}{\rm{ (mol)}}{\rm{.}}\) pH= 4 \( \Rightarrow \)[H+] = 0,0001 (M) = \(\frac{{{{10}^{ - 5}}}}{{x + 0,01}} \Rightarrow x = 0,09{\rm{ (L) = 90 (mL)}}{\rm{.}}\) |















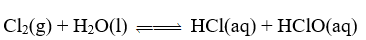
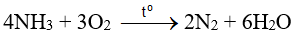 là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp.
là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp.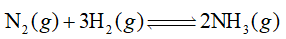
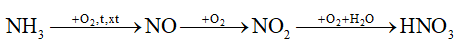
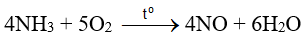 là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp
là giai đoạn trung gian trong quá trình điều chế nitric acid trong công nghiệp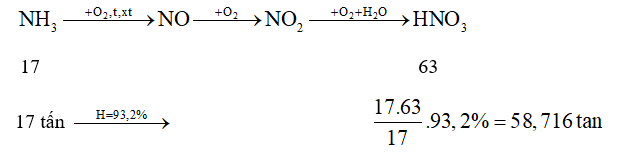






Danh sách bình luận