30 bài tập lý thuyết về phản ứng OXH Khử có lời giải (phần 3)Làm bàiQuảng cáo
Câu hỏi 1 : Quá trình nào sau đây là đúng
Đáp án: C Phương pháp giải: Lời giải chi tiết: Quá trình đúng là: \(\;\mathop S\limits^{ - 2} \; \to \mathop S\limits^0 + 2e\) Đáp án C Câu hỏi 2 : Cân bằng phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron: Zn + H2SO4 → ZnSO4 + S + H2O Phương pháp giải: Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng electron. Lời giải chi tiết:
\(\left. \begin{array}{l} 3Zn + 4H2SO4 → 3ZnSO4 + S + 4H2O Câu hỏi 3 : Cho phương trình hóa học sau: FeS2 + KNO3 + KHSO4 → Fe2(SO4)3 + K2SO4 + NO + H2O. Tổng hệ số (số nguyên, tối giản) của tất cả các chất phản ứng trong phương trình trên là
Đáp án: A Phương pháp giải: Giả sử ban đầu số oxi hóa của S là +6, cân bằng theo phương pháp thăng bằng electron. Lời giải chi tiết:
Tổng hệ số (số nguyên, tối giản) của tất cả các chất phản ứng trong phương trình trên là 2+10+8 = 20 Đáp án A Câu hỏi 4 : Cho dãy các chất sau: Na, SO2, FeO, N2, HCl. Số chất vừa có tính oxi hóa vừa có tính khử là
Đáp án: B Phương pháp giải: Những chất vừa có tính oxi hóa vừa có tính khử là những chất vừa có khả năng cho và nhận e. Lời giải chi tiết: Na: chỉ có tính khử SO2: S có số oxi hóa +4 là số oxi hóa trung gian => có tính khử và oxi hóa FeO: Fe có số oxi hóa +2 là số oxi hóa trung gian => có tính khử và oxi hóa N2: N có số oxi hóa 0 là số oxi hóa trung gian => có tính khử và oxi hóa HCl: H có số oxi hóa +1 có thể nhận e để lên 0, Cl có số oxi hóa -1 có thể cho e để lên mức oxi hóa cao hơn => có tính khử và oxi hóa Đáp án B Câu hỏi 5 : Cho phương trình hóa học của phản ứng: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu. Nhận xét nào sau đây về phản ứng trên là đúng?
Đáp án: D Phương pháp giải: Khử - cho, o - nhận (tức là chất khử là chất cho e, chất oxi hóa là chất nhận e). Lời giải chi tiết:
Al nhường e nên là chất khử Cu2+ nhận e nên là chất oxi hóa Đáp án D Câu hỏi 6 : Cho phản ứng: Cu + HNO3 → Cu(NO3)2 + NO + H2O. Sau khi cân bằng, tổng hệ số cân bằng tối giản các chất sản phẩm trong phản ứng là
Đáp án: C Phương pháp giải: Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng e. Lời giải chi tiết:
Vậy 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O Tổng hệ số cân bằng tối giản các chất sản phẩm trong phản ứng là: 3 + 2 + 4 = 9 Đáp án C Câu hỏi 7 : Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
Đáp án: D Phương pháp giải: Lời giải chi tiết: CuFeS2 → Cu+2 + Fe+3 + S+4 Vậy 1 phân tử CuFeS2 nhường 13e Đáp án D Câu hỏi 8 : Trong phản ứng : Cl2 + 2KBr → Br2 + 2KCl, nguyên tố clo…
Đáp án: A Phương pháp giải: - Xác định số oxi hóa của Cl trước và sau phản ứng - Xác định vai trò của Cl: + Chất nhường e là chất khử + Chất nhận e là chất oxi hóa Lời giải chi tiết: \(C{l_2} + 2e \to 2\mathop {Cl}\limits^{ - 1} \) Cl2 nhận e nên là chất oxi hóa (hay chất bị khử) Đáp án A Câu hỏi 9 : Thực hành thí nghiệm : nhỏ từng giọt dung dịch KMnO4 loãng vào ống nghiệm đựng dung dịch hỗn hợp FeSO4 và H2SO4 loãng, lắc nhẹ. Nêu hiện tượng xảy ra, viết và cân bằng phương trình hóa học để giải thích và cho biết vai trò của từng chất, trong phản ứng. Phương pháp giải: Lời giải chi tiết: Hiện tượng: Dung dịch thuốc tím bị nhạt màu dần. PTHH: 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O \(\mathop {Fe}\limits^{ + 2} - 1e \to \mathop {Fe}\limits^{ + 3} \) => FeSO4 là chất khử \(\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \) => KMnO4 là chất oxi hóa Câu hỏi 10 : Cho các phản ứng hóa học sau: aFeS + bHNO3 → cFe(NO3)3 + dH2SO4 + eNO + gH2O Trong đó a, b, c, d, e, g là các số nguyên tối giản. Giá trị b là
Đáp án: B Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron. Lời giải chi tiết: \(\begin{array}{l} FeS + 6HNO3 → Fe(NO3)3 + H2SO4 + 3NO + 2H2O Đáp án B Câu hỏi 11 : Cho phương trình hoá học: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O. Trong phương trình trên, tỉ lệ số phân tử HCl bị oxi hoá và số phân tử HCl làm môi trường (không oxi hoá - khử) là
Đáp án: D Phương pháp giải: Phân tử HCl bị oxi hóa tạo thành phân tử Cl2 => Số phân tử HCl bị oxi hóa => Số phân tử HCl môi trường Lời giải chi tiết: Phân tử HCl bị oxi hóa tạo thành phân tử Cl2 => Số phân tử HCl bị oxi hóa là 5.2 = 10 => Số phân tử HCl môi trường là 16-10 = 6 Vậy tỉ lệ số phân tử HCl bị oxi hoá và số phân tử HCl làm môi trường (không oxi hoá-khử) là 10:6 = 5:3 Đáp án D Câu hỏi 12 : Cho phản ứng: aFe3O4 + bHNO3 → cFe(NO3)3 + dNO + eH2O. Trong đó, a, b, c, d, e là các số nguyên tối giản. Tổng a, b, c, d, e bằng
Đáp án: B Phương pháp giải: Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng e. Lời giải chi tiết:
Vậy 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O a + b + c + d + e = 3 + 28 + 9 + 1 + 14 = 55 Đáp án B Câu hỏi 13 : Cho sơ đồ phản ứng: aKMnO4 + bKI + cH2SO4 → K2SO4 + MnSO4 + I2 + H2O Hệ số cân bằng a, b, c của các chất phản ứng lần lượt là:
Đáp án: B Phương pháp giải: Cân bằng phương trình hóa học theo phương pháp thăng bằng electron. Lời giải chi tiết: 2KMnO4 + 10KI + 8H2SO4 → 6K2SO4 + 2MnSO4 + 5I2 + 8H2O Vậy a = 2; b = 10; c = 8 Đáp án B Câu hỏi 14 : Ở phản ứng nào sau đây NH3 đóng vai trò là chất khử :
Đáp án: D Phương pháp giải: Ở phản ứng nào NH3 nhường e thì NH3 đóng vai trò là chất khử Lời giải chi tiết: \(2\mathop N\limits^{ - 3} {H_3} + 3CuO \to {\mathop N\limits^0 _2} + 3Cu + 3{H_2}\) Đáp án D Câu hỏi 15 : Cho phản ứng : 2Na + Cl2 → 2NaCl. Trong phản ứng này, nguyên tử natri
Đáp án: C Phương pháp giải: Chất khử là chất nhường e (bị oxi hóa), chất oxi hóa là chất nhận e (bị khử). Lời giải chi tiết: \(\mathop {Na}\limits^0 - 1e \to \mathop {Na}\limits^{ + 1} \) Na là chất khử hay chất bị oxi hóa Đáp án C Câu hỏi 16 : Cho phản ứng: Mg + H2SO4 → MgSO4 + S + H2O. Tổng hệ số cân bằng là:
Đáp án: D Phương pháp giải: Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Lời giải chi tiết:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O Tổng hệ số cân bằng là: 3 + 4 + 3 + 1 + 4 = 15 Đáp án D Câu hỏi 17 : Xét phản ứng sau: Al + HNO3 → Al(NO3)3 + N2O + H2O. Giả sử hệ số của Al, HNO3 là a và b. Biết hệ số các chất là số nguyên, nhỏ nhất. Giá trị a + b là
Đáp án: C Phương pháp giải: Cân bằng phản ứng bằng phương pháp thăng bằng electron. Lời giải chi tiết:
Al nhường e nên là chất khử, HNO3 nhận e nên HNO3 là chất oxi hóa. PTHH: 8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O Đáp án C Câu hỏi 18 : Cho phản ứng: SO2 + Br2 + 2H2O → H2SO4 + 2HBr.
Đáp án: D Phương pháp giải: HS ghi nhớ: “Khử - cho, o - nhận” + Chất khử là chất cho e (số oxi hóa tăng) + Chất oxi hóa là chất nhận e (số oxi hóa giảm) Lời giải chi tiết: Br02 + 2e → 2Br- => Br2 là chất oxi hóa Đáp án D Câu hỏi 19 : Thực hiện các thí nghiệm sau: (1) Cho kim loại K vào dung dịch HCl. (2) Đốt bột Al trong khí Cl2. (3) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường; (4) Cho NaOH vào dung dịch Mg(NO3)2. (5) Điện phân Al2O3 nóng chảy, có mặt Na3AlF6 với điện cực dương bằng than chì; (6) Cho FeCl2 tác dụng với dung dịch AgNO3dư. Số thí nghiệm có phản ứng oxi hoá – khử xảy ra là
Đáp án: C Phương pháp giải: Các phương trình có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng thì đó là pư oxi hóa khử. Lời giải chi tiết: \(\eqalign{ Trừ thí nghiệm (4) ra tất cả các thí nghiệm còn lại đều là pư oxh khử => có 5 thí nghiệm tất cả Đáp án C Câu hỏi 20 : Cho các chất sau: HCl, Cl2, S, SO2. Số chất vừa có tính khử vừa có tính oxi hóa là
Đáp án: C Phương pháp giải: Chất vừa có tính khử và vừa có tính oxi hóa là chất vừa có khả năng cho và nhận e (các chất này có mức oxi hóa trung gian) Lời giải chi tiết: Các chất vừa có tính khử vừa có tính oxi hóa là: HCl (H+ có thể nhận e tạo H2, Cl- có thể nhường e tạo Cl2) Cl2 (số oxi hóa của Cl là 0 => Cl2 có thể nhận e tạo Cl-, Cl2 có thể nhường e tạo Cl+1, Cl+3, Cl+5, Cl+7) S (số oxi hóa của S là 0 => S có thể nhận e tạo S-2, S có thể nhường e tạo S+4 và S+6) SO2 (số oxi hóa của S là +4 => SO2 có thể nhận e tạo S0, S-2, SO2 có thể nhường e tạo S+6) Vậy có 4 chất vừa là chất oxi hóa vừa là chất khử Đáp án C Câu hỏi 21 : Cho phản ứng sau: Cl2 + 2H2O + SO2 → 2HCl + H2SO4 Vai trò của Cl2 trong phản ứng trên là:
Đáp án: B Phương pháp giải: Dựa vào sự thay đổi số oxi hóa của Cl trong phản ứng để xác định vai trò của Cl2 trong phản ứng. Lời giải chi tiết: Số oxi hóa của Clo giảm từ 0 xuống -1 nên Cl2 là chất oxi hóa. Đáp án B Câu hỏi 22 : Cho các chất sau: CuO (1), Ag (2), FeO (3), Zn (4), Fe3O4 (5). Dung dịch H2SO4 đặc, nóng tác dụng với chất nào là phản ứng oxi hóa - khử?
Đáp án: C Phương pháp giải: Dựa vào tính chất của H2SO4 đặc và khái niệm phản ứng oxi hóa khử để trả lời. Lời giải chi tiết: CuO + H2SO4 → CuSO4 + H2O (1) 2Ag + 2H2SO4 đặc → Ag2SO4 + SO2 + 2H2O (2) 2FeO + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O (3) Zn + 2H2SO4 đặc → ZnSO4 + SO2 + 2H2O (4) 2Fe3O4 +10 H2SO4 đặc → 3Fe2(SO4)3 + SO2 + 10 H2O (5) Vậy dung dịch H2SO4 đặc, nóng tác dụng với chất 2, 3, 4, 5 là phản ứng oxi hóa - khử. Đáp án C Câu hỏi 23 : Cho phản ứng: a Al + b H2SO4 đặc, nóng → c Al2(SO4)3 + d SO2 + e H2O Tổng hệ số cân bằng của phương trình trên (a+b+c+d+e) là:
Đáp án: A Phương pháp giải: Cân bằng phương trình theo phương pháp thăng bằng electron để tìm tổng hệ số các chất. Lời giải chi tiết: 2Al + 6 H2SO4 đặc, nóng → Al2(SO4)3 + 3 SO2 + 6 H2O Vậy tổng hệ số cân bằng của phương trình trên (a+b+c+d+e) là: 18 Đáp án A Câu hỏi 24 : Có phương trình hóa học sau: Fe + CuSO4 → Cu + FeSO4. Phương trình nào dưới đây biểu thị sự oxi hóa cho phản ứng hóa học trên?
Đáp án: B Phương pháp giải: Sự oxi hóa là quá trình nhường electron. Sự khử là quá trình nhận electron. Lời giải chi tiết: Sự oxi hóa là quá trình nhường electron. Sự khử là quá trình nhận electron. Vậy sự oxi hóa của phản ứng hóa học trên là Fe→ Fe2+ + 2e. Đáp án B Câu hỏi 25 : Cho các phản ứng sau: (1) 4HCl + MnO2→ MnCl2 + Cl2 + 2H2O; (2) 2HCl + Fe→FeCl2 + H2; (3) 14HCl + K2Cr2O7→2KCl + 2CrCl3 + 3Cl2 + 7H2O (4) 6HCl + 2Al→ 2AlCl3 + 3H2 (5) 16HCl + 2KMnO4→2KCl + 2MnCl2 +5Cl2 + 8H2O Số phản ứng trong đó HCl thể hiện tính oxi hóa là:
Đáp án: A Phương pháp giải: Dựa vào đặc điểm: chất oxi hóa là chất có số oxi hóa giảm sau phản ứng, chất khử là chất có số oxi hóa tăng sau phản ứng. Lời giải chi tiết:
Chất oxi hóa là chất có số oxi hóa giảm sau phản ứng nên ở phản ứng (2) và (4) HCl thể hiện tính oxi hóa. Vậy có 2 phản ứng trong đó HCl thể hiện tính oxi hóa. Đáp án A Câu hỏi 26 : Cho các phản ứng : (1) SO3 + H2O → H2SO4; (2) CaCO3 + 2HCl→ CaCl2 + CO2 + H2O (3) C + H2O → CO + H2; (4) CO2 + Ca(OH)2→ CaCO3 + H2O (5) Ca + 2H2O→ Ca(OH)2 + H2; (6) 2KMnO4 →K2MnO4 + MnO2 + O2 (7) 2FeCl2 + Cl2→ 2FeCl3; (8) Na2SO3 + H2SO4→ Na2SO4 + SO2 + H2O Số phản ứng thuộc loại phản ứng oxi hóa khử là:
Đáp án: C Phương pháp giải: Dựa vào định nghĩa phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của 1 số nguyên tố. Lời giải chi tiết:
Ở các phản ứng (3), (5), (6), (7) có sự thay đổi số oxi hóa của 1 số nguyên tố nên đây là các phản ứng oxi hóa khử. Vậy có 4 phản ứng oxi hóa khử. Đáp án C Câu hỏi 27 : Cho các phản ứng: (1) NH4NO2 →N2 + 2H2O (2) 4KClO3→ KCl + 3KClO4 (3) KClO3 →KCl + 3/2 O2 (4) H2O2 →H2O + ½ O2 (5) 2KMnO4→ K2MnO4 + MnO2 + O2 (6) 2 C6H5-CHO + KOH→ C6H5COOK + C6H5-CH2-OH (7) SO2 + 2H2S → 3S+ 2H2O (8) Cu2O + H2SO4 →CuSO4 + Cu + H2O Số phản ứng thuộc loại tự oxi hóa - tự khử là:
Đáp án: B Phương pháp giải: Dựa vào định nghĩa phản ứng tự oxi hóa- tự khử: là phản ứng oxi hóa khử mà trong đó 1 nguyên tử vừa đóng vai trò chất khử vừa đóng vai trò chất oxi hóa. Lời giải chi tiết: Dựa vào định nghĩa phản ứng tự oxi hóa- tự khử: là phản ứng oxi hóa khử mà trong đó 1 nguyên tử vừa đóng vai trò chất khử vừa đóng vai trò chất oxi hóa. Vậy có tất cả có 4 phản ứng thuộc loại tự oxi hóa- tự khử. Đáp án B Câu hỏi 28 : Cho các chất: Fe2O3, Fe(OH)3, FeCl3, Fe2(SO4)3. Số chất trong dãy chỉ có tính oxi hóa là:
Đáp án: C Phương pháp giải: Dựa vào số oxi hóa của các nguyên tố: nếu nguyên tố đang ở trạng thái số oxi hóa thấp nhất thì sẽ thể hiện tính khử, nếu nguyên tố đang ở trạng thái số oxi hóa cao nhất thì sẽ thể hiện tính oxi hóa. Nếu nguyên tố đang ở trạng thái số oxi hóa trung gian thì vừa có tính khử vừa có tính oxi hóa. Lời giải chi tiết: Trong Fe2O3 thì Fe có số oxi hóa +3 là số oxi hóa cao nhất nên Fe2O3 chỉ có tính oxi hóa. Trong Fe(OH)3 thì Fe có số oxi hóa +3 là số oxi hóa cao nhất nên Fe(OH)3 chỉ có tính oxi hóa. Trong FeCl3 thì Fe có số oxi hóa +3 là số oxi hóa cao nhất nên FeCl3 có tính oxi hóa. Mặt khác Cl có số oxi hóa -1 là số oxi hóa thấp nhất của clo nên FeCl3 cũng có tính khử, Trong Fe2(SO4)3 thì Fe có số oxi hóa +3 là số oxi hóa cao nhất nên Fe2(SO4)3 chỉ có tính oxi hóa. Vậy có 3 chất chỉ có tính oxi hóa là Fe2O3, Fe(OH)3, Fe2(SO4)3. Đáp án C Câu hỏi 29 : Cho các chất và ion : HI, Cr2+, FeCl2, S2-, C. Số chất và ion trong dãy chỉ có tính khử là:
Đáp án: A Phương pháp giải: Dựa vào số oxi hóa của các nguyên tố: nếu nguyên tố đang ở trạng thái số oxi hóa thấp nhất thì sẽ thể hiện tính khử, nếu nguyên tố đang ở trạng thái số oxi hóa cao nhất thì sẽ thể hiện tính oxi hóa. Nếu nguyên tố đang ở trạng thái số oxi hóa trung gian thì vừa có tính khử vừa có tính oxi hóa. Lời giải chi tiết: Trong HI thì H có số oxi hóa +1 nên có thể hiện tính oxi hóa, còn I có số oxi hóa -1 nên có hiện tính khử. Trong ion Cr2+ nguyên tố Cr có số oxi hóa +2 là số oxi hóa trung gian nên Cr2+ vừa có tính khử vừa có tính oxi hóa. Trong FeCl2, nguyên tố Fe có số oxi hóa +2 là số oxi hóa trung gian nên FeCl2 vừa có tính khử vừa có tính oxi hóa. Trong ion S2-, nguyên tố S có số oxi hóa -2 là số oxi hóa thấp nhất nên S2- chỉ có tính khử. Nguyên tố C có số oxi hóa là 0, là số oxi hóa trung gian nên C vừa có tính khử vừa có tính oxi hóa. Vậy chỉ có 1 chất chỉ có tính khử là S2-. Đáp án A Câu hỏi 30 : Cho dãy các chất và ion: Zn, ZnO, Fe, FeO, S, SO2, SO3, N2, HBr, Cu2+, Br−. Số chất và ion có cả tính oxi hóa và tính khử là:
Đáp án: B Phương pháp giải: Dựa vào số oxi hóa của các nguyên tố: nếu nguyên tố đang ở trạng thái số oxi hóa thấp nhất thì sẽ thể hiện tính khử, nếu nguyên tố đang ở trạng thái số oxi hóa cao nhất thì sẽ thể hiện tính oxi hóa. Nếu nguyên tố đang ở trạng thái số oxi hóa trung gian thì vừa có tính khử vừa có tính oxi hóa. Lời giải chi tiết: \(\mathop {Zn}\limits^0 \)có số oxi hóa thấp nhất → Zn chỉ có tính khử Trong \(\mathop {Zn}\limits^{ + 2} \mathop O\limits^{ - 2} \) thì \(\mathop {Zn}\limits^{ + 2} \) có thể xuống số oxi hóa thấp hơn là 0, còn oxi số oxi hóa -2 không thể lên số oxi hóa cao hơn là 0 nên cả phân tử ZnO chỉ có tính oxi hóa. Fe có số oxi hóa bằng 0 là số oxi hóa thấp nhất của Fe nên Fe chỉ có tính khử. Trong FeO thì nguyên tố Fe có số oxi hóa +2 là số oxi hóa trung gian nên FeO vừa có tính oxi hóa vừa có tính khử. \(\mathop S\limits^0 \)có số oxi hóa trung gian, có thể lên số oxi hóa cao hơn là +4; +6; có thể xuống số oxi hóa thấp hơn là -2 nên S vừa có tính oxi hóa vừa có tính khử. \(\mathop S\limits^{ + 4} {O_2}\)thì nguyên tố S có số oxi hóa +4 là số oxi hóa trung gian nên SO2 vừa có tính oxi hóa vừa có tính khử. \(\mathop S\limits^{ + 6} {O_3}\)thì nguyên tố S có số oxi hóa +6 là số oxi hóa cao nhất nên SO3 chỉ có tính oxi hóa. Trong N2 thì nguyên tố N có số oxi hóa 0 là số oxi hóa trung gian nên N2 vừa có tính oxi hóa vừa có tính khử. Trong HBr, nguyên tố H có số oxi hóa +1 là số oxi hóa cao nhất nên có tính oxi hóa, nguyên tố Br có số oxi hóa -1 là số oxi hóa thấp nhất nên có tính khử. Do đó phân tử HBr vừa có tính khử vừa có tính oxi hóa. Trong Cu2+, nguyên tố Cu có số oxi hóa +2 là số oxi hóa cao nhất của Cu nên Cu2+ có tính oxi hóa. Trong Br−, nguyên tố Br có số oxi hóa -1 là số oxi hóa thấp nhất nên Br− chỉ có tính khử. Vậy các chất và ion vừa có tính khử vừa có tính oxi hóa là: FeO, S, SO2, N2, HBr (có 5 chất thỏa mãn). Đáp án B Quảng cáo
|














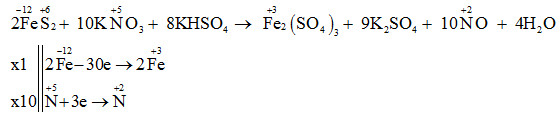
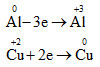
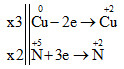
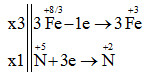
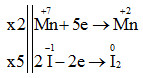
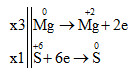
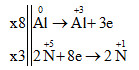
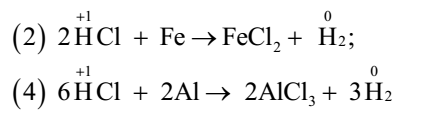
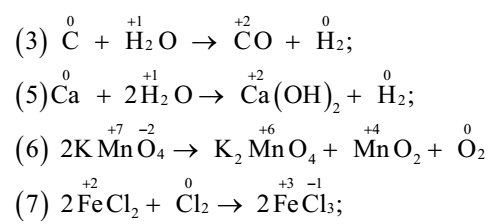
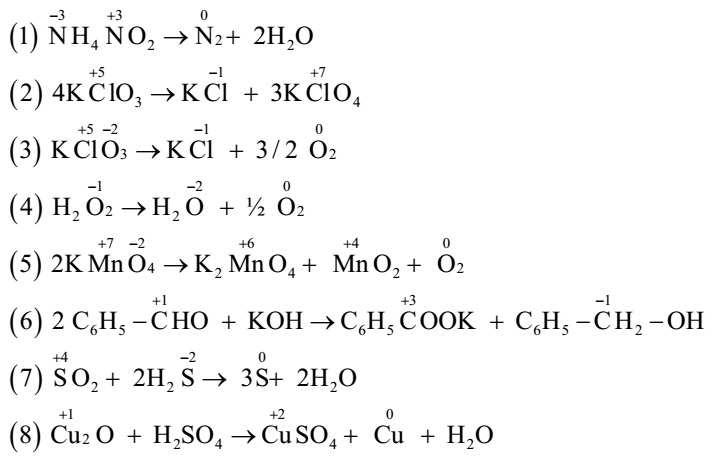 Vậy các phản ứng thuộc loại tự oxi hóa- tự khử là (2), (4), (6),(8).
Vậy các phản ứng thuộc loại tự oxi hóa- tự khử là (2), (4), (6),(8).








