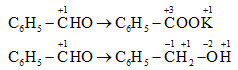30 bài tập lý thuyết về phản ứng OXH - Khử có lời giải (phần 1)Làm bàiQuảng cáo
Câu hỏi 1 : Một nguyên tử lưu huỳnh (S) chuyển thành ion sunfua (S2-) bằng cách:
Đáp án: C Phương pháp giải: Một nguyên tử trung hòa điện nhận thêm e để tạo thành ion âm, nhường e để tạo thành ion dương. Lời giải chi tiết: S + 2e → S2- Đáp án C Câu hỏi 2 : Trong phản ứng: Cl2 + KBr
Đáp án: B Phương pháp giải: - Chất khử (bị oxi hóa) là chất nhường e - Chất oxi hóa (bị khử) là chất nhận e Lời giải chi tiết: Cl2 + 2e → 2Cl- Ta thấy Cl2 là chất nhận e nên Cl2 là chất oxi hóa hay chất bị khử. Đáp án B Câu hỏi 3 : Trong phản ứng: Fe(OH)3 -> Fe2O3 + H2O. Nguyên tố sắt (Fe):
Đáp án: C Phương pháp giải: Xác định số oxi hóa của Fe trước và sau phản ứng từ đó xác định được vai trò của Fe trong phản ứng. Lời giải chi tiết: Số oxi hóa của Fe trước và sau phản ứng vẫn là +3 nên Fe không bị oxi hóa và không bị khử. Đáp án C Câu hỏi 4 : Trong phản ứng: Fe + HCl → FeCl2 + H2. Nguyên tố sắt (Fe):
Đáp án: A Phương pháp giải: Xác định số oxi hóa của Fe trước và sau phản ứng từ đó xác định được vai trò của Fe trong phản ứng. Ghi nhớ câu: “khử - cho, o - nhận” Lời giải chi tiết: Fe → Fe2+ + 2e => Fe nhường e => Chất khử (bị oxi hóa) Đáp án A Câu hỏi 5 : Trong phản ứng: Cl2 + KOH \(\overset{t^o}{\rightarrow}\) KCl + KClO3 + H2O. Nguyên tố clo (Cl):
Đáp án: D Phương pháp giải: Xác định số oxi hóa của nguyên tố Cl trước và sau phản ứng. Từ đó xác định được vai trò của nguyên tố Cl trong phản ứng. Lời giải chi tiết: \(\mathop {C{l_2}}\limits^0 + {\text{ }}KOH{\text{ }}\xrightarrow{{t^o}}{\text{K}}\mathop {Cl}\limits^{ - 1} {\text{ }} + {\text{ }}K\mathop {Cl}\limits^{ + 5} {O_3} + {\text{ }}{H_2}O\) Ta thấy: Cl nhận thêm e tạo Cl-1 và nhường e tạo Cl+5 => vừa là chất khử, vừa là chất oxi hóa Đáp án D Câu hỏi 6 : Nhận định chính xác về chất khử là:
Đáp án: B Phương pháp giải: Nắm được khái niệm chất khử và chất oxi hóa: - Chất khử là chất nhường e => số oxi hóa tăng - Chất oxi hóa là chất nhận e => số oxi hóa giảm Lời giải chi tiết: A sai vì chất khử là chất bị oxi hóa B đúng C sai vì chất khử nhường e nên có số oxi hóa tăng D sai vì chất khử là chất nhường e Đáp án B Câu hỏi 7 : Nhận định chưa chính xác về chất oxi hoá:
Đáp án: B Phương pháp giải: Nắm được khái niệm chất khử và chất oxi hóa: - Chất khử là chất nhường e => số oxi hóa tăng - Chất oxi hóa là chất nhận e => số oxi hóa giảm Lời giải chi tiết: A, C, D đúng B sai vì chất oxi hóa là chất nhận e => số oxi hóa giảm Đáp án B Câu hỏi 8 : Hệ số tối giản trong phản ứng: MnO2 + HCl -> MnCl2 + Cl2 + H2O là:
Đáp án: A Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng eletron. Lời giải chi tiết:
\(\begin{gathered} => MnO2 + 4HCl MnCl2 + Cl2 + 2H2O Đáp án A Câu hỏi 9 : Tổng hệ số nguyên, có tỉ lệ tối giản trong phương trình phản ứng: Cu + HNO3 → Cu(NO3)2 + NO + H2O là
Đáp án: C Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng eletron. Lời giải chi tiết:
\(\begin{gathered} => 3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O Đáp án C Câu hỏi 10 : Cho phương trình phản ứng: Cu + HNO3 -> Cu(NO3)2 + NO + H2O. Tỉ số giữa chất khử và chất oxi hoá là:
Đáp án: A Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng eletron. Lời giải chi tiết:
\(\begin{gathered} => 3Cu + 8HNO3 -> 3Cu(NO3)2 + 2NO + 4H2O Chất khử là chất nhường e => Cu Chất oxi hóa là chất nhận e => HNO3 Tỉ số giữa chất khử và chất oxi hoá = Cu : HNO3 = 3 : 8 Đáp án A Câu hỏi 11 : Cho phản ứng hoá học: Cl2 + KOH -> KCl + KClO3 + H2O. Tổng hệ số tối giản của phương trình là:
Đáp án: D Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng eletron. Lời giải chi tiết:
\(\begin{gathered} => 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O Đáp án D Câu hỏi 12 : Cho phản ứng hoá học: Cl2 + KOH -> KCl + KClO3 + H2O. Tỉ số giữa số nguyên tử clo (Cl) thể hiện tính khử với số nguyên tử clo (Cl) thể hiện tính oxi hoá là:
Đáp án: A Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng eletron. Lời giải chi tiết:
\(\begin{gathered} => 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O Số nguyên tử Cl thể hiện tính khử (số oxi hóa tăng) là 1 Số nguyên tử Cl thể hiện tính oxi hóa (số oxi hóa giảm) là 5 => Tỉ lệ là 1 : 5 Đáp án A Câu hỏi 13 : Cho phương trình phản ứng: aKMnO4 + bHCl -> KCl + MnCl2 + Cl2 + H2O. Giá trị tối giản của b là:
Đáp án: C Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng eletron. Lời giải chi tiết:
\(\begin{gathered} 2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 + 8H2O Đáp án C Câu hỏi 14 : Cho các nhận định sau: (1) Chất khử là chất nhường electron trong quá trình phản ứng. (2) Chất oxi hoá là chất nhận electron trong quá trình phản ứng. (3) Quá trình khử (sự khử) là quá trình nhường electron của chất khử. (4) Quá trình oxi hoá (sự oxi hoá) là quá trình nhận electron của chất oxi hoá. (5) Phản ứng oxi hoá khử là phản ứng xảy ra đồng thời cả sự khử lần sự oxi hoá. (6) Có phản ứng oxi hoá khử chỉ xảy ra quá trình khử hoặc chỉ xảy ra quá trình oxi hoá. Số nhận định chính xác là:
Đáp án: B Phương pháp giải: Khái niệm chất khử, chất oxi hóa, sự khử, sự oxi hóa: - Chất khử (bị oxi hóa) là chất cho electron => số oxi hóa tăng. - Chất oxi hóa (bị khử) là chất nhận eletron => số oxi hóa giảm. - Sự khử (quá trình khử) là quá trình nhận electron. - Sự oxi hóa (quá trình oxi hóa) là quá trình cho electron. Lời giải chi tiết: (1) Đúng (2) Đúng (3) Sai vì quá trình khử (sự khử) là quá trình thu electron (4) Sai vì quá trình oxi hoá (sự oxi hoá) là quá trình nhường electron (5) Đúng (6) Phản ứng oxi hoá khử là phản ứng xảy ra đồng thời cả sự khử lần sự oxi hoá. Đáp án B Câu hỏi 15 : Cho phương trình phản ứng hoá học: K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O. Tổng hệ số tối giản của phương trình là:
Đáp án: C Phương pháp giải: Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron: 1. Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi. 2. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. 3. Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron do chất oxi hóa nhận. 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học. Lời giải chi tiết: \(\begin{array}{l} => K2Cr2O7 + 14HCl 2KCl + 2CrCl3 + 3Cl2 + 7H2O Đáp án C Câu hỏi 16 : Cho các phản ứng sau: (1) MnO2 + HCl → MnCl2 + Cl2 + H2O. (2) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O. (3) Fe + HCl → FeCl2 + H2. (4) NaOH + HCl → NaCl + H2O. (5) SO2 + NaOH → Na2SO3 + H2O. (6) NO2 + NaOH → NaNO3 + NaNO2 + H2O. (7) Cu + HNO3 → Cu(NO3)2 + NO + H2O. (8) FeS + HNO3 → Fe(NO3)3 + SO2 + NO + H2O. (9) Cl2 + KOH → KCl + KClO3 + H2O. (10) FexOy + HNO3 → Fe(NO3)3 + NO2 + H2O. Số phản ứng oxi hoá khử là:
Đáp án: B Phương pháp giải: Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của nguyên tố. Lời giải chi tiết: Các phản ứng oxi hóa khử: (1),(2),(3),(6),(7),(8),(9),(10) Đáp án B Câu hỏi 17 : Cho phản ứng: KMnO4 + HCl -> KCl + MnCl2 + Cl2 + H2O. Tỉ số giữa số nguyên tử clo (Cl) tạo muối và tạo khí là:
Đáp án: A Phương pháp giải: - Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Phương pháp thăng bằng electron: 1. Xác định số oxi hóa của nhừng nguyên tố có số oxi hóa thay đổi. 2. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. 3. Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron do chất oxi hóa nhận. 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học. - Tính tỉ số giữa số nguyên tử clo (Cl) tạo muối và tạo khí: + Tạo muối: KCl và MnCl2 + Tạo khí: Cl2 Lời giải chi tiết:
\(\begin{array}{l} 2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 + 8H2O Số nguyên tử Cl tạo muối = số nguyên tử KCl + 2 số nguyên tử MnCl2 = 2 + 2.2 = 6 Số nguyên tử Cl tạo khí = 2 số nguyên tử Cl2 = 10 Tỉ số giữa số nguyên tử clo (Cl) tạo muối và tạo khí là: 6 : 10 = 3 : 5 Đáp án A Câu hỏi 18 : Cho phản ứng hoá học: aCl2 + bKOH -> KCl + KClO3 + H2O. Tổng hệ số tối giản của a và b là:
Đáp án: B Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron. Phương pháp thăng bằng electron: 1. Xác định số oxi hóa của nhừng nguyên tố có số oxi hóa thay đổi. 2. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. 3. Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron do chất oxi hóa nhận. 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học. Lời giải chi tiết:
\(\begin{array}{l} => 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O Đáp án B Câu hỏi 19 : Cho phản ứng hoá học: FeS + HNO3 Fe(NO3)3 + H2SO4 + NO + H2O. Tổng hệ số tối giản là:
Đáp án: D Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron: Phương pháp thăng bằng electron: 1. Xác định số oxi hóa của nhừng nguyên tố có số oxi hóa thay đổi. 2. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. 3. Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron do chất oxi hóa nhận. 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học. Lời giải chi tiết:
\(\begin{array}{l} => FeS + 6HNO3 Fe(NO3)3 + H2SO4 + 3NO + 2H2O Đáp án D Câu hỏi 20 : Nhận xét nào sau đây là chưa chính xác:
Đáp án: C Phương pháp giải: Khái niệm chất khử, chất oxi hóa, sự khử, sự oxi hóa: - Chất khử (bị oxi hóa) là chất cho electron => số oxi hóa tăng. - Chất oxi hóa (bị khử) là chất nhận eletron => số oxi hóa giảm. - Sự khử (quá trình khử) là quá trình nhận electron. - Sự oxi hóa (quá trình oxi hóa) là quá trình cho electron. Lời giải chi tiết: C sai vì trong phản ứng oxi hóa khử, phải có nguyên tố nhường và nguyên tố nhận e nên không thể chỉ có chất khử hoặc chỉ có chất oxi hóa. Đáp án C Câu hỏi 21 : Cho các phản ứng hoá học sau: (1) CaO + CO2→ CaCO3. (2) Fe + O2→ Fe3O4. (3) Cu(OH)2→ CuO + CO2. (4) KMnO4→ K2MnO4 + MnO2 + O2. (5) Fe + HCl → FeCl2 + H2. (6) Fe + CuSO4→ FeSO4 + Cu. (7) KOH + HCl → KCl + H2O. (8) BaCl2 + Na2SO4 → BaSO4 + NaCl. Số phản ứng hoá hợp và phản ứng phân huỷ lần lượt là:
Đáp án: B Phương pháp giải: Khái niệm phản ứng hóa hợp và phản ứng phân hủy: - Phản ứng hoá hợp là phản ứng giữa hai hay nhiều chất tạo thành một chất. - Phản ứng phân huỷ phản ứng từ một chất tạo thành hai hay nhiều sản phẩm. Lời giải chi tiết: (1) Phản ứng hóa hợp (2) Phản ứng hóa hợp (3) Phản ứng phân hủy (4) Phản ứng phân hủy (5) Phản ứng thế (6) Phản ứng thế (7) Phản ứng trao đổi (8) Phản ứng trao đổi Vậy có 2 phản ứng hóa hợp là (1) (2) và 2 phản ứng phân hủy là (3) (4) Đáp án B Câu hỏi 22 : Cho các phản ứng hoá học sau: (1) CaO + CO2 → CaCO3. (2) Fe + O2 → Fe3O4. (3) Cu(OH)2 → CuO + CO2. (4) KMnO4 → K2MnO4 + MnO2 + O2. (5) Fe + HCl → FeCl2 + H2. (6) Fe + CuSO4→ FeSO4 + Cu. (7) KOH + HCl → KCl + H2O. (8) BaCl2 + Na2SO4 → BaSO4 + NaCl. Số phản ứng thay đổi số oxi hoá là:
Đáp án: B Phương pháp giải: Xác định số oxi hóa của các nguyên tố trong hợp chất trước và sau phản ứng từ đó xác định phản ứng có sự thay đổi số oxi hóa. Lời giải chi tiết: Các phản ứng có sự thay đổi số oxi hóa là: (2), (4), (5), (6) Đáp án B Câu hỏi 23 : (A-2008): Cho các phản ứng sau: 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O. 2HCl + Fe →FeCl2 + H2 14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O. 6HCl + 2Al → 2AlCl3 + 3H2. 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O. Số phản ứng trong đó HCl thể hiện tính oxi hóa là
Đáp án: A Phương pháp giải: Chất oxi hóa là chất nhận e => số oxi hóa giảm Mà Cl đã đạt số oxi hóa thấp nhất => H có số oxi hóa giảm => phản ứng có tạo H2 Lời giải chi tiết: Phản ứng HCl thể hiện tính oxi hóa là 2HCl + Fe →FeCl2 + H2 6HCl + 2Al → 2AlCl3 + 3H2 Đáp án A Câu hỏi 24 : Cho các phản ứng: Ca(OH)2 + Cl2 → CaOCl2 + H2O 2H2S + SO2 → 3S + 2H2 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O 4KClO3 → KCl + KClO4 O3 → O2 + O Số phản ứng oxi hoá - khử là
Đáp án: D Phương pháp giải: Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa. Lời giải chi tiết: Phản ứng oxi hoá - khử là: Ca(OH)2 + Cl2 → CaOCl2 + H2O 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O 2H2S + SO2 → 3S + 2H2 4KClO3 → KCl + KClO4 Đáp án D Câu hỏi 25 : (B-2010): Cho phản ứng: 2C6H5-CHO + KOH → C6H5-COOK + C6H5-CH2-OH Phản ứng này chứng tỏ C6H5-CHO
Đáp án: A Phương pháp giải: Lời giải chi tiết:
Ta thấy C6H5CHO vừa nhận và nhường e nên vừa là chất oxi hóa, vừa là chất khử. Đáp án A Câu hỏi 26 : (B-2013): Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phương trình của phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là:
Đáp án: D Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron. Lời giải chi tiết:
\(\begin{gathered} 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O. Đáp án D Câu hỏi 27 : (A-2010): Trong phản ứng: K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là
Đáp án: D Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron. Lời giải chi tiết: \(\begin{array}{*{20}{c}}{\mathop {1 \times }\limits^{} }\\{\mathop {3 \times }\limits^{} }\end{array}\left| \begin{array}{l}2\mathop {Cr}\limits^{ + 6} + 6e \to 2\mathop {Cr}\limits^{ + 3} \\2\mathop {Cl}\limits^{ - 1} \to C{l_2} + 2e\end{array} \right.\) K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 + 2KCl + 7H2O Ta thấy: Số phân tử HCl tham gia phản ứng là 14. Sản phẩm tạo ra 3 phân tử Cl2 => có 6 ion Cl- nhận e => có 6 phân tử HCl đóng vai trò chất khử. => Tỉ lệ k = 6/14 = 3/7 Đáp án D Câu hỏi 28 : Trong 4 phản ứng dưới đây, phản ứng nào không có sự thay đổi số oxi hóa của các nguyên tố?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Phương trình hóa học \(\eqalign{ & \mathop {Na}\limits^{ + 1} \mathop {Cl}\limits^{ - 1} + \mathop {Ag}\limits^{ + 1} \mathop N\limits^{ + 5} {\mathop O\limits^{ - 2} _3} \to \mathop {Ag}\limits^{ + 1} \mathop {Cl}\limits^{ - 1} + \mathop {Na}\limits^{ + 1} \mathop N\limits^{ + 5} {\mathop O\limits^{ - 2} _3} \cr & \mathop {Fe}\limits^0 + {\mathop {Cl}\limits^0 _2} \to \mathop {Fe}\limits^{ + 3} \mathop {C{l_3}}\limits^{ - 1} \cr & \mathop {Zn}\limits^0 + {\mathop H\limits^{ + 1} _2}\mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4} \to \mathop {Zn}\limits^{ + 2} \mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4} + {\mathop H\limits^0 _2} \cr & \mathop K\limits^{ + 1} \mathop {Mn}\limits^{ + 7} {\mathop O\limits^{ - 2} _4}\buildrel {{t^o}} \over \longrightarrow {\mathop K\limits^{ + 1} _2}\mathop {Mn}\limits^{ + 6} {\mathop O\limits^{ - 2} _4} + \mathop {Mn}\limits^{ + 4} {\mathop O\limits^{ - 2} _2} + {\mathop O\limits^0 _2} \cr} \) Đáp án A Câu hỏi 29 : Phát biểu nào sau đây không đúng:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 30 : Cho quá trình:\(NO_3^ - + 3e + 4{H^ + } \to NO + 2{H_2}O\) , đây là quá trình
Đáp án: B Phương pháp giải: Quá trình nhường electron là quá trình oxi hóa Quá trình nhận electron là quá trình khử Lời giải chi tiết: Quá trình \(NO_3^ - + 3e + 4{H^ + } \to NO + 2{H_2}O\) là quá trình nhận e hay là quá trình khử Đáp án B Quảng cáo
|














 Br2 + KCl. Nguyên tố clo (Cl):
Br2 + KCl. Nguyên tố clo (Cl):