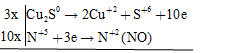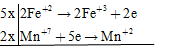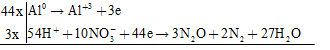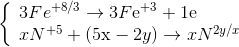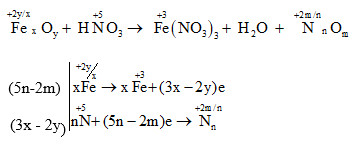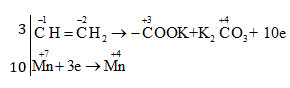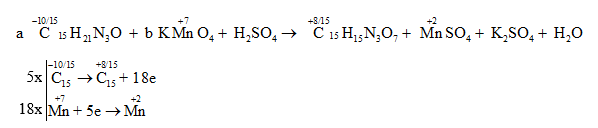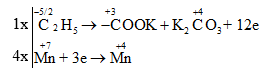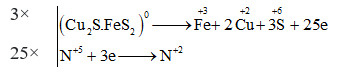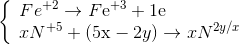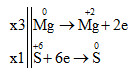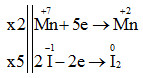20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Hệ số cân bằng của \(C{u_2}S\) và \(HN{O_3}\) trong phản ứng \(C{u_2}S + HN{O_3} \to Cu{(N{O_3})_2} + {H_2}S{O_4} + NO + {H_2}O\) là:
Đáp án: A Phương pháp giải: Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận. cân bằng theo 4 bước - Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi - Bước 2: Viết các quá trình oxi hóa, quá trình khử. - Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận - Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự: Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.) Lời giải chi tiết: Sơ đồ phản ứng \(\overbrace {C{u_2}S}^0 + H\mathop {{\text{ }}N}\limits^{ + 5} {O_3} \to \mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + {H_2}\mathop {{\text{ }}S}\limits^{ + 6} {O_4} + \mathop {{\text{ }}N}\limits^{ + 2} O + {H_2}O\) Các quá trình oxi hóa – khử \(3C{u_2}S + 22HN{O_3} \to 6Cu{(N{O_3})_2} + 3{H_2}S{O_4} + 10NO + 8{H_2}O\) Hệ số cân bằng của \(C{u_2}S\) và \(HN{O_3}\) lần lượt là 3 và 22 Đáp án A Câu hỏi 2 : Cho phương trình hoá học: FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O. Khi cân bằng với hệ số nguyên tối giản thì hệ số của KHSO4 là
Đáp án: C Phương pháp giải: Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận. cân bằng theo 4 bước - Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi - Bước 2: Viết các quá trình oxi hóa, quá trình khử. - Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận - Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự: Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.) Lời giải chi tiết: FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O Các quá trình cho – nhận e đặt hệ số của KHSO4 = a; K2SO4 = b => nH2O = a/2 (BTNT "H") => hệ số tối giản của KHSO4 là 16 Đáp án C Câu hỏi 3 : Cho phản ứng \(F{e^{2 + }} + MnO_4^ - + {H^ + } \to F{e^{3 + }} + M{n^{2 + }} + {H_2}O\) sau khi cân bằng, tổng hệ số (có tỉ lệ nguyên và tối giản nhất) là:
Đáp án: B Phương pháp giải: Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận. cân bằng theo 4 bước - Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi - Bước 2: Viết các quá trình oxi hóa, quá trình khử. - Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận - Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự: Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.) Lời giải chi tiết: - Bước 1: Xác định số oxi hóa của các ion (nguyên tố thay đổi số oxi hóa trong pthh) \(F{e^{2 + }} + \mathop {Mn}\limits^{ + 7} O_4^ - + {H^ + } \to F{e^{3 + }} + M{n^{2 + }} + {H_2}O\) - Bước 2: Các quá trình cho – nhận e \(\left| \matrix{ F{e^{ + 2}} \to F{e^{ + 3}} + 1e \hfill \cr {M^{ + 7}} + 5e \to M{n^{ + 2}} \hfill \cr} \right.\) - Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận - Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. \(5F{e^{2 + }} + MnO_4^ - + 8{H^ + } \to 5F{e^{3 + }} + M{n^{2 + }} + 4{H_2}O\) Tổng hệ số cân bằng là: 24 Đáp án C Câu hỏi 4 : Cho phương trình phản ứng: \(Al + HN{O_3} \to Al{(N{O_3})_3} + {N_2} + {N_2}O + {H_2}O\) . Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3:2, hãy xác định tỉ lệ mol nAl : nN2O : nN2 trong các kết quả sau
Đáp án: D Phương pháp giải: Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận. cân bằng theo 4 bước - Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi - Bước 2: Viết các quá trình oxi hóa, quá trình khử. - Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận - Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự: Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.) Lời giải chi tiết: \(Al + HN{O_3} \to Al{(N{O_3})_3} + {N_2} + {N_2}O + {H_2}O\) Các quá trình cho – nhận e \(44Al + 162HN{O_3} \to 44Al{(N{O_3})_3} + 6{N_2} + 9{N_2}O + 81{H_2}O\) \( \Rightarrow {n_{Al}}:{n_{{N_2}O}}:{n_{{N_2}}} = 44:9:6\) Đáp án D Câu hỏi 5 : Cho phản ứng hóa học sau:\(X + HN{O_3} \to Fe{(N{O_3})_3} + NO + {H_2}O\) . Số chất X thỏa mãn sơ đồ trên là:
Đáp án: C Phương pháp giải: Chọn Fe và các hợp chất của sắt có số oxi hóa trung gian Lời giải chi tiết: Phương trình hóa học: \(X + HN{O_3} \to Fe{(N{O_3})_3} + NO + {H_2}O\) Dựa vào phương trình hóa học trên -Sản phẩm có muối sắt (III) X phải là hợp chất chứa Fe - Sản phẩm chỉ gồm muối nitrat và NO là sản phẩm khử duy nhất của HNO3 nên X chỉ có thể là sắt, oxit sắt hoặc muối nitrat của sắt và có thể tham gia vào quá trình oxi hóa (do N+5 tham gia quá trình khử N+5 + 3e → N+2 (NO) để khử N+5 thành NO X có thể là: \(Fe,FeO,F{e_3}{O_4},Fe{(N{O_3})_2}\) Đáp án C Câu hỏi 6 : Cho phản ứng: FeSO4 + KMnO4 + H2O → K2SO4 + MnO2 + Fe(OH)3 + Fe2(SO4)3. Sau khi cân bằng (với hệ số là các số nguyên, tối giản), hệ số của H2O là
Đáp án: A Phương pháp giải: Cân bằng phương pháp ion - electron áp dụng cho các phản ứng oxi hóa - khử xảy ra trong dd có sự tham gia của môi trường: axit, bazo, nước. Khi cân bằng sử dụng theo 4 bước như phương pháp thăng bằng electron nhưng chất oxi hóa, chất khử được viết đúng dạng mà nó tồn tại trong dd theo nguyên tắc sau: 1. Nếu phản ứng có axit tham gia: + Vế nào thiếu bao nhiêu O thêm bấy nhiêu H2O để tạo ra H+ ở vế kia và ngược lại VD: NO3‑ → NO Ta thấy vế phải thiếu 2O, thêm vế phải 2H2O để tạo vế trái 4H+, sau đó cân bằng điện tích của bán phản ứng NO3‑ + 4H+ + 3e → NO + 2H2O 2. Nếu phản ứng có bazơ tham gia: + Vế nào thiếu bao nhiêu O thêm lượng OH- gấp đôi để tạo H2O ở vế kia và ngược lại VD: Cr2O3 → 2CrO4- Vế trái thiếu 5O thêm vế trái 10OH- để tạo 5H2O ở vế phải, sau đó cân bằng điện tích bán phản ứng Cr2O3 + 10OH- → 2CrO4- + 5H2O +6e 3. Nếu phản ứng có H2O tham gia + Sản phẩm phản ứng tạo ra axit, cân bằng theo nguyên tắc 1 + Sản phẩm phản ứng tạo ra bazơ, cân bằng theo nguyên tắc 2 MnO4- + 2H2O + 3e → MnO2 + 4OH- Lời giải chi tiết: Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố, xác định được chất khử, chất oxi hóa\(\mathop {Fe}\limits^{ + 2} S{O_4} + K\mathop {Mn}\limits^{ + 7} {O_4} + {H_2}O \to \,{K_2}S{O_4} + \mathop {Mn}\limits^{ + 4} {O_2} + \mathop {Fe}\limits^{ + 3} {(OH)_3} + \mathop {Fe_2^{}}\limits^{ + 3} {(S{O_4})_3}\) Bước 2: Viết quá trình khử, quá trình oxi hóa, cân bằng mỗi quá trình và đặt hệ số thích hợp trước chất khử, chất oxi hóa \(\begin{array}{l}\begin{array}{*{20}{c}}{3x}\\{1x}\end{array}\left| \begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}} + 1e\\Mn{O_4}^ - + 2{H_2}O + 3e \to Mn{O_2}^ - + 4O{H^ - }\end{array} \right.\\ \to 3F{e^{ + 2}} + Mn{O_4}^ - + 2{H_2}O \to 3F{e^{ + 3}} + Mn{O_2}^ - + 4O{H^ - }\end{array}\) Bước 3: Viết bán phản ứng, ép đúng tỉ lệ Fe(OH)3 và nhân hệ số thích hợp để triệt tiêu OH- \(\begin{array}{*{20}{c}}{3x}\\{4x}\end{array}\left| \begin{array}{l}3F{e^{ + 2}} + Mn{O_4}^ - + 2{H_2}O \to 3F{e^{ + 3}} + Mn{O_2}^ - + 4O{H^ - }(1)\\F{e^{3 + }} + 3O{H^ - } \to Fe{(OH)_3}\,\,\,\,(2)\end{array} \right.\) \( \to 9F{e^{ + 2}} + 3Mn{O_4}^ - + 6{H_2}O \to 5F{e^{ + 3}} + 3Mn{O_2}^ - + 4Fe{(OH)_3}\,(3)\) Ta thấy trong phương trình phân tử Fe+3 tồn tại ở dạng Fe2(SO4)3 nên ta nhân cả 2 vê (3) với hệ số 2 để làm chẵn số nguyên tố Fe+3 \(18F{e^{ + 2}} + 6Mn{O_4}^ - + 12{H_2}O \to 10F{e^{ + 3}} + 6Mn{O_2}^ - + 8Fe{(OH)_3}\,(4)\) Thêm ion K+, SO42- vào phương trình ion (4) ta được phương trình phân tử ban đầu cân bằng. → 18FeSO4 + 6KMnO4 + 12H2O → 3K2SO4 + 6MnO2 + 8Fe(OH)3 + 5Fe2(SO4)3 Vậy hệ số của H2O là 12 Đáp án A Câu hỏi 7 : Cho phản ứng: Fe3O4 + HNO3 → Fe(NO3)3 + NXOY + H2O. Số phân tử HNO3 đóng vai trò chất môi trường là:
Đáp án: B Phương pháp giải: Phương pháp : thăng bằng e Lời giải chi tiết:
Lời giải (5x-2y) Fe3O4 +(46x – 18y) HNO3 → (15x-6y) Fe(NO3)3 + NXOY + (23x-9y)H2O Số lượng phân tử HNO3 môi trường là 45x -18y Đáp án B Câu hỏi 8 : Cho phản ứng: FeS2 + H2SO4 đặc nóng→ Fe2(SO4)3 + SO2 + H2O. Tỉ lệ số phân tử bị khử và số phân tử bị oxi hóa là:
Đáp án: B Phương pháp giải: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron cho bằng tổng số electron nhận. Đặt hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Từ đó xác định được tỉ lệ số phân tử bị khử và số phân tử bị oxi hóa. Lời giải chi tiết: Xác định số oxi hóa của các nguyên tố hóa học thay đổi trong phản ứng:
Vậy phương trình hóa học được cân bằng là: 2FeS2 + 14H2SO4 đặc nóng→ Fe2(SO4)3 + 15SO2 + 14H2O Vậy số phân tử bị khử là 15, số phân tử bị oxi hóa là 2. Tỉ lệ số phân tử bị khử và số phân tử bị oxi hóa là 15 : 2. Đáp án B Câu hỏi 9 : Cho phản ứng: FexOy + HNO3→ Fe(NO3)3 + H2O + NnOm. Sau khi cân bằng, hệ số của axit HNO3 là:
Đáp án: A Phương pháp giải: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron cho bằng tổng số electron nhận. Đặt hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Từ đó xác định được hệ số của axit HNO3 sau khi cân bằng. Lời giải chi tiết: Xác định số oxi hóa của các nguyên tố hóa học thay đổi trong phản ứng:
Vậy phương trình hóa học được cân bằng là: (5n-2m)FexOy + (18nx- 6mx-2ny)HNO3→ (5nx-2mx)Fe(NO3)3 + (9nx-3mx-ny)H2O + (3x-2y)NnOm. Sau khi cân bằng, hệ số của axit HNO3 là(18nx- 6mx-2ny). Đáp án A Câu hỏi 10 : Cho các phản ứng hóa học sau: aFeS + bHNO3 → cFe(NO3)3 + dH2SO4 + eNO + gH2O Trong đó a, b, c, d, e, g là các số nguyên tối giản. Giá trị b là
Đáp án: B Phương pháp giải: Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron. Lời giải chi tiết: \(\begin{array}{l} FeS + 6HNO3 → Fe(NO3)3 + H2SO4 + 3NO + 2H2O Đáp án B Câu hỏi 11 : Cho phản ứng: C6H5-CH=CH2 + KMnO4 → C6H5-COOK + K2CO3 + MnO2 + KOH + H2O. Khi có 10 phân tử KMnO4 phản ứng thì số nguyên tử cacbon bị oxi hóa là?
Đáp án: C Phương pháp giải: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron cho bằng tổng số electron nhận. Đặt hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Từ đó xác định được số nguyên tử cacbon bị oxi hóa khi có 10 phân tử KMnO4 phản ứng. Lời giải chi tiết: Xác định số oxi hóa của các nguyên tố hóa học thay đổi trong phản ứng: \({C_6}{H_5} - \mathop C\limits^{ - 1} H = \mathop C\limits^{ - 2} {H_2} + {\rm{ }}K\mathop {Mn}\limits^{ + 7} {O_4} \to {\rm{ }}{C_6}{H_5} - \mathop C\limits^{ + 3} OOK{\rm{ }} + {\rm{ }}{K_2}\mathop C\limits^{ + 4} {O_3} + {\rm{ }}\mathop {Mn}\limits^{ + 4} {O_2} + {\rm{ }}KOH{\rm{ }} + {\rm{ }}{H_2}O\)
Vậy phương trình hóa học được cân bằng là: 3 C6H5-CH=CH2 + 10 KMnO4 → 3 C6H5-COOK + 3 K2CO3 + 10 MnO2 + KOH + 4 H2O. Vậy khi có 10 phân tử KMnO4 phản ứng thì số nguyên tử cacbon bị oxi hóa là 6. Đáp án C Câu hỏi 12 : Cho phản ứng: a C15H21N3O + b KMnO4 + H2SO4 → C15H15N3O7 + MnSO4 + K2SO4 + H2O. Giá trị của a và b lần lượt là:
Đáp án: C Phương pháp giải: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron cho bằng tổng số electron nhận. Đặt hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Từ đó xác định được giá trị của a và b. Lời giải chi tiết: Xác định số oxi hóa của các nguyên tố hóa học thay đổi trong phản ứng:
Vậy phương trình hóa học được cân bằng là: 5 C15H21N3O + 18 KMnO4 + 27 H2SO4 → 5 C15H15N3O7 + 18 MnSO4 + 9 K2SO4 + 42 H2O. Vậy giá trị của a và b lần lượt là 5 và 18. Đáp án C Câu hỏi 13 : Cho phương trình phản ứng sau: C6H5C2H5 + KMnO4 → C6H5COOK + MnO2 + K2CO3 + KOH + H2O. Hệ số nguyên tối giản đứng trước chất bị khử khi phản ứng cân bằng là:
Đáp án: A Phương pháp giải: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron cho bằng tổng số electron nhận. Đặt hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Từ đó xác định đượchệ số nguyên tối giản đứng trước chất bị khử khi phản ứng cân bằng. Lời giải chi tiết: Xác định số oxi hóa của các nguyên tố hóa học thay đổi trong phản ứng:
Vậy phương trình hóa học được cân bằng là: C6H5C2H5 + 4 KMnO4 → C6H5COOK + 4 MnO2 + K2CO3 + KOH + 2 H2O Hệ số nguyên tối giản đứng trước chất bị khử (KMnO4) khi phản ứng cân bằng là: 4. Đáp án A Câu hỏi 14 : Cho phương trình hóa học sau: Cu2S.FeS2 + HNO3 → Cu(NO3)2 + Fe(NO3)3 + H2SO4 + NO + H2O Tổng hệ số cân bằng của các chất trong phương trình trên là
Đáp án: D Phương pháp giải: Cân bằng theo phương pháp thăng bằng electron Lời giải chi tiết: Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố \({\left. {\left( {C{u_2}S.Fe{S_2}} \right.} \right)^0} + H\mathop N\limits^{ + 5} {O_3} \to \,\mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + \mathop {Fe}\limits^{ + 3} {(N{O_3})_3} + {H_2}\mathop S\limits^{ + 6} {O_4} + \mathop N\limits^{ + 2} O + {H_2}O\) Bước 2: Viết quá trình nhường, nhận e và đặt hệ số trước mỗi quá trình sao cho tổng e chất khử nhường = tổng e chất oxi hóa nhận
Bước 3: Đặt hệ số vào các chất trong phương trình \(3C{u_2}S.Fe{S_2} + 46H\mathop N\limits^{ + 5} {O_3} \to \,6\mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + \mathop {3Fe}\limits^{ + 3} {(N{O_3})_3} + 9{H_2}\mathop S\limits^{ + 6} {O_4} + \mathop {25N}\limits^{ + 2} O + 14{H_2}O\) → Tổng hệ số của các chất trong phương trình trên là: 3 + 46 + 6 + 3 + 9 + 25 + 14 = 106 Đáp án D Câu hỏi 15 : Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NXOY + H2O . Hệ số tối giản của HNO3 là:
Đáp án: C Phương pháp giải: Phương pháp : thăng bằng e Lời giải chi tiết:
Lời giải
(5x-2y) FeO +(16x – 6y) HNO3 → (5x-2y) Fe(NO3)3 + NXOY + (8x-3y)H2O Hệ số tối giản của HNO3 là 16x − 6y Đáp án C Câu hỏi 16 : Cho phương trình hoá học: FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O. Khi cân bằng với hệ số nguyên tối giản thì hệ số của KHSO4 là
Đáp án: C Phương pháp giải: Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận. cân bằng theo 4 bước - Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi - Bước 2: Viết các quá trình oxi hóa, quá trình khử. - Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận - Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự: Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.) Lời giải chi tiết: FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O Các quá trình cho – nhận e đặt hệ số của KHSO4 = a; K2SO4 = b => nH2O = a/2 (BTNT "H") => hệ số tối giản của KHSO4 là 16 Đáp án C Câu hỏi 17 : Cho phản ứng: Mg + H2SO4 → MgSO4 + S + H2O. Tổng hệ số cân bằng là:
Đáp án: D Phương pháp giải: Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Lời giải chi tiết:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O Tổng hệ số cân bằng là: 3 + 4 + 3 + 1 + 4 = 15 Đáp án D Câu hỏi 18 : Cho sơ đồ phản ứng: aKMnO4 + bKI + cH2SO4 → K2SO4 + MnSO4 + I2 + H2O Hệ số cân bằng a, b, c của các chất phản ứng lần lượt là:
Đáp án: B Phương pháp giải: Cân bằng phương trình hóa học theo phương pháp thăng bằng electron. Lời giải chi tiết: 2KMnO4 + 10KI + 8H2SO4 → 6K2SO4 + 2MnSO4 + 5I2 + 8H2O Vậy a = 2; b = 10; c = 8 Đáp án B Câu hỏi 19 : Cho phương trình hoá học: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O. Trong phương trình trên, tỉ lệ số phân tử HCl bị oxi hoá và số phân tử HCl làm môi trường (không oxi hoá - khử) là
Đáp án: D Phương pháp giải: Phân tử HCl bị oxi hóa tạo thành phân tử Cl2 => Số phân tử HCl bị oxi hóa => Số phân tử HCl môi trường Lời giải chi tiết: Phân tử HCl bị oxi hóa tạo thành phân tử Cl2 => Số phân tử HCl bị oxi hóa là 5.2 = 10 => Số phân tử HCl môi trường là 16-10 = 6 Vậy tỉ lệ số phân tử HCl bị oxi hoá và số phân tử HCl làm môi trường (không oxi hoá-khử) là 10:6 = 5:3 Đáp án D Câu hỏi 20 : Cho phản ứng: aFe3O4 + bHNO3 → cFe(NO3)3 + dNO + eH2O. Trong đó, a, b, c, d, e là các số nguyên tối giản. Tổng a, b, c, d, e bằng
Đáp án: B Phương pháp giải: Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng e. Lời giải chi tiết:
Vậy 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O a + b + c + d + e = 3 + 28 + 9 + 1 + 14 = 55 Đáp án B Quảng cáo
|