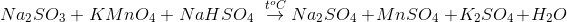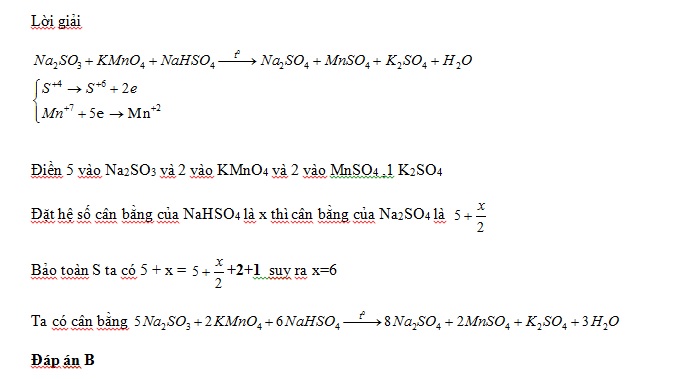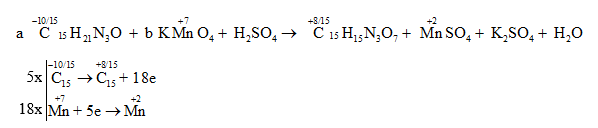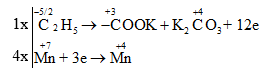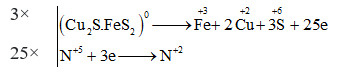10 bài tập vận dụng cao về phản ứng OXH - Khử (phần 2) có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Tổng hệ số của các chất ( là những số nguyên, tối giản ) trong phương trình phản ứng là:
Đáp án: B Phương pháp giải: cân bằng theo thăng bằng e Lời giải chi tiết:
Câu hỏi 2 : Cho phản ứng: a C15H21N3O + b KMnO4 + H2SO4 → C15H15N3O7 + MnSO4 + K2SO4 + H2O. Giá trị của a và b lần lượt là:
Đáp án: C Phương pháp giải: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron cho bằng tổng số electron nhận. Đặt hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Từ đó xác định được giá trị của a và b. Lời giải chi tiết: Xác định số oxi hóa của các nguyên tố hóa học thay đổi trong phản ứng:
Vậy phương trình hóa học được cân bằng là: 5 C15H21N3O + 18 KMnO4 + 27 H2SO4 → 5 C15H15N3O7 + 18 MnSO4 + 9 K2SO4 + 42 H2O. Vậy giá trị của a và b lần lượt là 5 và 18. Đáp án C Câu hỏi 3 : Cho phương trình phản ứng sau: C6H5C2H5 + KMnO4 → C6H5COOK + MnO2 + K2CO3 + KOH + H2O. Hệ số nguyên tối giản đứng trước chất bị khử khi phản ứng cân bằng là:
Đáp án: A Phương pháp giải: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron cho bằng tổng số electron nhận. Đặt hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Từ đó xác định đượchệ số nguyên tối giản đứng trước chất bị khử khi phản ứng cân bằng. Lời giải chi tiết: Xác định số oxi hóa của các nguyên tố hóa học thay đổi trong phản ứng:
Vậy phương trình hóa học được cân bằng là: C6H5C2H5 + 4 KMnO4 → C6H5COOK + 4 MnO2 + K2CO3 + KOH + 2 H2O Hệ số nguyên tối giản đứng trước chất bị khử (KMnO4) khi phản ứng cân bằng là: 4. Đáp án A Câu hỏi 4 : Cho phương trình hóa học sau: Cu2S.FeS2 + HNO3 → Cu(NO3)2 + Fe(NO3)3 + H2SO4 + NO + H2O Tổng hệ số cân bằng của các chất trong phương trình trên là
Đáp án: D Phương pháp giải: Cân bằng theo phương pháp thăng bằng electron Lời giải chi tiết: Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố \({\left. {\left( {C{u_2}S.Fe{S_2}} \right.} \right)^0} + H\mathop N\limits^{ + 5} {O_3} \to \,\mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + \mathop {Fe}\limits^{ + 3} {(N{O_3})_3} + {H_2}\mathop S\limits^{ + 6} {O_4} + \mathop N\limits^{ + 2} O + {H_2}O\) Bước 2: Viết quá trình nhường, nhận e và đặt hệ số trước mỗi quá trình sao cho tổng e chất khử nhường = tổng e chất oxi hóa nhận
Bước 3: Đặt hệ số vào các chất trong phương trình \(3C{u_2}S.Fe{S_2} + 46H\mathop N\limits^{ + 5} {O_3} \to \,6\mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + \mathop {3Fe}\limits^{ + 3} {(N{O_3})_3} + 9{H_2}\mathop S\limits^{ + 6} {O_4} + \mathop {25N}\limits^{ + 2} O + 14{H_2}O\) → Tổng hệ số của các chất trong phương trình trên là: 3 + 46 + 6 + 3 + 9 + 25 + 14 = 106 Đáp án D Câu hỏi 5 : Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO trong đó oxi chiếm 25,39% khối lượng hỗn hợp. Cho m gam hỗn hợp X tác dụng với 8,96 lít CO (đktc) sau một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với hiđro là 19. Cho chất rắn Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 7,168 lít NO (điều kiện tiêu chuẩn, sản phẩm khử duy nhất). Cô cạn dung dịch T thu được b gam muối khan (biết b = 3,456m). Giá trị của b gần nhất với giá trị nào sau đây?
Đáp án: C Phương pháp giải: Từ thể tích và khối lượng mol trung bình của hỗn hợp khí Z ta tìm được số mol CO và CO2 trong hỗn hợp Z. Từ đó tìm được số mol O còn lại trong chất rắn Y. Coi hỗn hợp Y gồm kim loại và O Ta có các quá trình nhận electron: O0 + 2e → O-2 N+5 + 3e → N+2 Cô cạn dung dịch T thu được 3,456m gam muối khan gồm kim loại và NO3- (trong muối) Ta có: n e nhận = nNO3- trong muối → m muối = m kim loại + mNO3-trong muối, từ đó giải tìm được giá trị m và giá trị b. Lời giải chi tiết: Giả sử Z gồm a mol CO dư và b mol CO2 + BTNT "C": nCO bđ = nCO dư + nCO2 => a + b = 0,4 (1) + mZ = 28a + 44b = 0,4.19.2 (2) Giải hệ (1) và (2) được a = 0,15 và b = 0,25 Quá trình khử oxit KL bằng CO có thể viết đơn giản là: CO + O → CO2 → nO pư = nCO2 = 0,25 mol → nO dư = 0,2539m/16 - 0,25 mol nNO = 7,168/22,4 = 0,32 mol Coi hỗn hợp Y gồm {KL: 0,7461m (gam); O: 0,2539m/16 - 0,25 (mol)} Ta có các quá trình nhận electron: O0 + 2e → O-2 0,2539m/16-0,25 → 0,2539m/8-0,5 N+5 + 3e → N+2 0,96 ← 0,32 Cô cạn dung dịch T thu được 3,456m gam muối khan gồm kim loại và NO3- (trong muối) Ta có: n NO3- trong muối = n e nhận = 0,2539m/8 - 0,5 + 0,96 = 0,2539m/8 + 0,46 (mol) → m muối = m kim loại + mNO3-trong muối => 0,7461m + 62.(0,2539m/8 + 0,46) = 3,456m → m = 38,4276 gam → b = 3,456m = 132,8 gam Vậy giá trị của b gần nhất với giá trị 133,056. Đáp án C Câu hỏi 6 : Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí X duy nhất (đktc). Cô cạn dung dịch X thu được 39,8 gam chất rắn. Khí X là:
Đáp án: B Phương pháp giải: Chất rắn khan thu được chứa Zn(NO3)2 và có thể có NH4NO3. Từ khối lượng chất rắn tính được mol của NH4NO3. Giả sử 1 phân tử khí trao đổi n electron. BTe: 2nZn = 8nNH4NO3 + n.n khí => n => Khí Lời giải chi tiết: Chất rắn khan thu được chứa Zn(NO3)2 và có thể có NH4NO3. Ta có: nZn(NO3)2 = nZn = 0,2 mol Giả sử 1 phân tử khí trao đổi n electron. BT electron: n e cho = n e nhận => 2nZn = 8nNH4NO3 + n.n khí => 2.0,2 = 8.0,025 + n.0,02 => n = 10 => X là N2 Đáp án B Câu hỏi 7 : a) Cho phản ứng oxi hóa - khử: Cu + H2SO4 → CuSO4 + SO2 + H2O. Hãy xác định chất khử, chất oxi hóa và cân bằng phản ứng hóa - khử trên bằng phương pháp thăng bằng electron. b) Hoà tan hoàn toàn 2,08 gam hỗn hợp bột Y gồm FexOy và Cu bằng dung dịch H2SO4 đặc nóng (dư), thu được 0,448 lít khí SO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch chứa 5,6 gam hỗn hợp muối sunfat. Tính phần trăm khối lượng của Cu trong Y. Phương pháp giải: a) Cân bằng phản ứng oxi hóa - khử bằng phương pháp thăng bằng electron: 1. Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi. 2. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. 3. Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron do chất oxi hóa nhận. 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học. b) Dùng phương pháp quy đổi và dùng định luật bảo toàn electron. Lời giải chi tiết: a) Ta có: \(\mathop {Cu}\limits^0 \, + {H_2}\mathop S\limits^{ + 6} {O_4}\; \to \mathop {Cu}\limits^{ + 2} S{O_4}\; + \mathop S\limits^{ + 4} {O_2} + {H_2}O\) Cu có số oxi hóa tăng từ 0 lên +2 → Cu là chất khử S có số oxi hóa giảm từ +6 xuống +4 → H2SO4 là chất oxi hóa \(\begin{array}{*{20}{c}}{\mathop {x1}\limits^{} }\\{\mathop {x1}\limits^{} }\end{array}\left| \begin{array}{l}\mathop {Cu}\limits^0 \mathop { \to Cu}\limits^{{\rm{ + 2}}} {\rm{ + 2e}}\\\mathop {\rm{S}}\limits^{{\rm{ + 6}}} {\rm{ + 2e}} \to \mathop {\rm{S}}\limits^{ + 4} \end{array} \right.\) → PTHH: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O. b) Quy đổi hỗn hợp thành Fe (a mol), Cu ( b mol) và O (c mol) Ta có mY = 56a + 64b + 16c = 2,08 (gam) Theo định luật bảo toàn electron: 3a + 2b = 2c + 0,02.2 Ta có mmuối = 400.a/2 + 160b = 5,6 Giải hệ trên ta tìm được a = 0,02 ; b = 0,01 và c = 0,02 Ta có x : y = nFe : nO = 1 : 1. Vậy công thức oxit là FeO. Từ đó ta tìm được %mCu = 30,77%. Câu hỏi 8 : Cho 5,68 gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được 0,672 lít NO (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan. Tính giá trị của m. Phương pháp giải: - Quy đổi hỗn hợp X về Fe (x mol) và O (y mol) - Biểu diễn khối lượng của X theo khối lượng Fe và khối lượng O (1) - Áp dụng bảo toàn electron (2) - Từ (1) và (2) tìm ra số mol Fe và O trong X - Bảo toàn nguyên tố Fe tìm ra số mol muối, từ đó tìm được m. Lời giải chi tiết: \({n_{NO}} = \frac{{0,672}}{{22,4}} = 0,03\,\,mol\) Quy đổi hỗn hợp X về Fe (x mol) và O (y mol) Ta có: mX = mFe + mO → 56x + 16y = 5,68 (1) Các quá trình trao đổi electron: \(\mathop {F{\rm{e}}}\limits^0 \to \mathop {F{\rm{e}}}\limits^{ + 3} + 3{\rm{e}}\) \(\mathop O\limits^0 + 2{\rm{e}} \to \mathop O\limits^{ - 2} \) \(\mathop N\limits^{ + 5} + 3{\rm{e}} \to \mathop N\limits^{ + 2} \) Áp dụng bảo toàn electron: \(3{n_{F{\rm{e}}}} = 2{n_O} + 3{n_{NO}}\) \( \to 3.x = 2y + 3.0,03 \to 3{\rm{x - 2y = 0,09}}\)(2) Từ (1) và (2) → x = 0,08; y = 0,075 Bảo toàn nguyên tố Fe: \({n_{F{\rm{e}}{{(N{O_3})}_3}}} = {n_{F{\rm{e}}}} = 0,08mol\) → m muối = 0,08.242 = 19,36 gam Câu hỏi 9 : Cho phản ứng: FeSO4 + KMnO4 + H2O → K2SO4 + MnO2 + Fe(OH)3 + Fe2(SO4)3. Sau khi cân bằng (với hệ số là các số nguyên, tối giản), hệ số của H2O là
Đáp án: A Phương pháp giải: Cân bằng phương pháp ion - electron áp dụng cho các phản ứng oxi hóa - khử xảy ra trong dd có sự tham gia của môi trường: axit, bazo, nước. Khi cân bằng sử dụng theo 4 bước như phương pháp thăng bằng electron nhưng chất oxi hóa, chất khử được viết đúng dạng mà nó tồn tại trong dd theo nguyên tắc sau: 1. Nếu phản ứng có axit tham gia: + Vế nào thiếu bao nhiêu O thêm bấy nhiêu H2O để tạo ra H+ ở vế kia và ngược lại VD: NO3‑ → NO Ta thấy vế phải thiếu 2O, thêm vế phải 2H2O để tạo vế trái 4H+, sau đó cân bằng điện tích của bán phản ứng NO3‑ + 4H+ + 3e → NO + 2H2O 2. Nếu phản ứng có bazơ tham gia: + Vế nào thiếu bao nhiêu O thêm lượng OH- gấp đôi để tạo H2O ở vế kia và ngược lại VD: Cr2O3 → 2CrO4- Vế trái thiếu 5O thêm vế trái 10OH- để tạo 5H2O ở vế phải, sau đó cân bằng điện tích bán phản ứng Cr2O3 + 10OH- → 2CrO4- + 5H2O +6e 3. Nếu phản ứng có H2O tham gia + Sản phẩm phản ứng tạo ra axit, cân bằng theo nguyên tắc 1 + Sản phẩm phản ứng tạo ra bazơ, cân bằng theo nguyên tắc 2 MnO4- + 2H2O + 3e → MnO2 + 4OH- Lời giải chi tiết: Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố, xác định được chất khử, chất oxi hóa\(\mathop {Fe}\limits^{ + 2} S{O_4} + K\mathop {Mn}\limits^{ + 7} {O_4} + {H_2}O \to \,{K_2}S{O_4} + \mathop {Mn}\limits^{ + 4} {O_2} + \mathop {Fe}\limits^{ + 3} {(OH)_3} + \mathop {Fe_2^{}}\limits^{ + 3} {(S{O_4})_3}\) Bước 2: Viết quá trình khử, quá trình oxi hóa, cân bằng mỗi quá trình và đặt hệ số thích hợp trước chất khử, chất oxi hóa \(\begin{array}{l}\begin{array}{*{20}{c}}{3x}\\{1x}\end{array}\left| \begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}} + 1e\\Mn{O_4}^ - + 2{H_2}O + 3e \to Mn{O_2}^ - + 4O{H^ - }\end{array} \right.\\ \to 3F{e^{ + 2}} + Mn{O_4}^ - + 2{H_2}O \to 3F{e^{ + 3}} + Mn{O_2}^ - + 4O{H^ - }\end{array}\) Bước 3: Viết bán phản ứng, ép đúng tỉ lệ Fe(OH)3 và nhân hệ số thích hợp để triệt tiêu OH- \(\begin{array}{*{20}{c}}{3x}\\{4x}\end{array}\left| \begin{array}{l}3F{e^{ + 2}} + Mn{O_4}^ - + 2{H_2}O \to 3F{e^{ + 3}} + Mn{O_2}^ - + 4O{H^ - }(1)\\F{e^{3 + }} + 3O{H^ - } \to Fe{(OH)_3}\,\,\,\,(2)\end{array} \right.\) \( \to 9F{e^{ + 2}} + 3Mn{O_4}^ - + 6{H_2}O \to 5F{e^{ + 3}} + 3Mn{O_2}^ - + 4Fe{(OH)_3}\,(3)\) Ta thấy trong phương trình phân tử Fe+3 tồn tại ở dạng Fe2(SO4)3 nên ta nhân cả 2 vê (3) với hệ số 2 để làm chẵn số nguyên tố Fe+3 \(18F{e^{ + 2}} + 6Mn{O_4}^ - + 12{H_2}O \to 10F{e^{ + 3}} + 6Mn{O_2}^ - + 8Fe{(OH)_3}\,(4)\) Thêm ion K+, SO42- vào phương trình ion (4) ta được phương trình phân tử ban đầu cân bằng. → 18FeSO4 + 6KMnO4 + 12H2O → 3K2SO4 + 6MnO2 + 8Fe(OH)3 + 5Fe2(SO4)3 Vậy hệ số của H2O là 12 Đáp án A Câu hỏi 10 : Hòa tan hoàn toàn sắt oxit bằng dung dịch H2SO4 đặc nóng (vừa đủ), thu được 2,24 lít khí SO2 (đktc). Cô cạn dung dịch sau phản ứng thu được 120 gam muối khan. Công thức của sắt oxit là
Đáp án: B Phương pháp giải: - Tính số mol Fe2(SO4)3, suy ra số mol ion Fe3+ - Giả sử số oxi hóa của Fe trong oxit là +n Fe+n → Fe+3 + (3-n)e S+6 + 2e → S+4 Áp dụng bảo toàn e lập phương trình ẩn n ⟹ giá trị của n + Nếu n = 2 ⟹ oxit là FeO + Nếu n = 8/3 ⟹ oxit là Fe3O4 Lời giải chi tiết: Muối khan thu được sau phản ứng là Fe2(SO4)3 ⟹ nFe2(SO4)3 = 120/400 = 0,3 mol ⟹ nFe3+ = 2nFe2(SO4)3 = 0,6 mol Giả sử số oxi hóa của Fe trong oxit là +n Fe+n → Fe+3 + (3-n)e S+6 + 2e → S+4 0,6 → 0,6.(3-n) 0,2 ← 0,1 Áp dụng bảo toàn e: 0,6.(3 - n) = 0,2 ⟹ n = 8/3 Vậy oxit sắt là Fe3O4. Đáp án B Quảng cáo
|