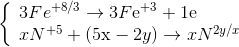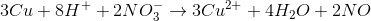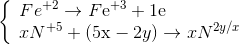10 bài tập vận dụng cao về phản ứng OXH - Khử (phần 1)Làm bàiQuảng cáo
Câu hỏi 1 : Cho hỗn hợp X gồm 0,2 mol Al và 0,2 mol Zn tác dụng với 500 ml dung dịch Y gồm Cu(NO3)2 và AgNO3 đến khi phản ứng hoàn toàn thu được 47,35 gam chất rắn A gồm 3 kim loại và dung dịch B chứa 2 muối. Cho A tác dụng với dung dịch HCl dư thu được 3,36 lít khí H2 (đktc). Coi thể tích dung dịch không đổi. Nồng độ của Cu(NO3)2 trong hỗn hợp Y là:
Đáp án: B Phương pháp giải: Phương pháp : bảo toàn e và tính theo PTHH. Tổng số mol của X bằng tổng số mol muói trong B + số mol Zn trong rắn A ( vì muối là Al(NO3)3 và Zn(NO3)2) Lời giải chi tiết:
Lời giải Vì dung dịch khi cho X tác dụng với Y chỉ chưa 2 muối nên 2 muối đó là Al(NO3)3 và Zn(NO3)2 và 3 kim loại thu được là Ag, Cu, Zn Ta có Al → Al+3+ 3e Zn → Zn+2+ 2e Cu+2+ 2e → Cu Ag+1+ 1e → Ag A tác dụng với HCl thì Zn + 2HCl →ZnCl2 + H2 Suy ra số mol H2 = số mol Zn dư và bằng 0,15 mol Suy ra tổng só mol Al và Zn trong dd B là 0,4-0,15 =0,25 mol trong đó có 0,2mol Al và 0,05 mol Zn Trong A thì khối lượng Cu và Ag là 47,35 – 0,15.65=37,6 g Đặt số mol Cu và Ag trong dd Y ban đầu là x và y thì 64 x + 108y = 37,6 Theo bảo toàn e thì 2x + y =0,2.3 + 0,05.2=0,7 suy ra x =0,25 và y=0,2 Nên nồng độ của Cu(NO3)2 trong hỗn hợp Y là 0,25 :0,5 =0,5 M Đáp án B Câu hỏi 2 : Cho phản ứng: Fe3O4 + HNO3 → Fe(NO3)3 + NXOY + H2O. Số phân tử HNO3 đóng vai trò chất môi trường là:
Đáp án: B Phương pháp giải: Phương pháp : thăng bằng e Lời giải chi tiết:
Lời giải (5x-2y) Fe3O4 +(46x – 18y) HNO3 → (15x-6y) Fe(NO3)3 + NXOY + (23x-9y)H2O Số lượng phân tử HNO3 môi trường là 45x -18y Đáp án B Câu hỏi 3 : Cho hỗn hợp X gồm 0,2 mol Al và 0,2 mol Zn tác dụng với 500 ml dung dịch Y gồm Cu(NO3)2 và AgNO3 đến khi phản ứng hoàn toàn thu được 47,35 gam chất rắn A gồm 3 kim loại và dung dịch B chứa 2 muối. Cho A tác dụng với dung dịch HCl dư thu được 3,36 lít khí H2 (đktc). Coi thể tích dung dịch không đổi. Nồng độ của AgNO3 trong hỗn hợp Y là:
Đáp án: C Phương pháp giải: Phương pháp : bảo toàn e và tính theo PTHH. Tổng số mol của X bằng tổng số mol muói trong B + số mol Zn trong rắn A ( vì muối là Al(NO3)3 và Zn(NO3)2) Lời giải chi tiết: Thứ tự phản ứng của kim loại: Al, Zn Thứ tự phản ứng của muối: AgNO3, Cu(NO3)2 Vì dung dịch khi cho X tác dụng với Y chỉ chưa 2 muối nên 2 muối đó là Al(NO3)3 và Zn(NO3)2 và 3 kim loại thu được là Ag, Cu, Zn Ta có Al → Al+3+ 3e Zn → Zn+2+ 2e Cu+2+ 2e → Cu Ag+1+ 1e → Ag A tác dụng với HCl thì Zn + 2HCl →ZnCl2 + H2 Suy ra số mol H2 = số mol Zn dư và bằng 0,15 mol Suy ra tổng só mol Al và Zn trong dd B là 0,4-0,15 =0,25 mol trong đó có 0,2mol Al và 0,05 mol Zn Trong A thì khối lượng Cu và Ag là 47,35 – 0,15.65=37,6 g Đặt số mol Cu và Ag trong dd Y ban đầu là x và y thì 64 x + 108y = 37,6 Theo bảo toàn e thì 2x + y =0,2.3 + 0,05.2=0,7 suy ra x =0,25 và y=0,2 Nên nồng độ của Ag(NO3) trong hỗn hợp Y là 0,2 :0,5 =0,4 M Đáp án C Câu hỏi 4 : Cho 8,1 gam Al tác dụng với dung dịch HNO3 thu được 2,016 lít khí X (không có sản phẩm khử khác). Khí X là:
Đáp án: D Phương pháp giải: Phương pháp : Cần chia 2 trường hợp. Một trường hợp tạo dạng khí là chỉ chứ 1 N trong công thức hóa học và trường hợp 2 chứa 2 N trong công thức hóa học Áp dụng bảo toàn e tìm giá trị oxh của N trong X Lời giải chi tiết:
Lời giải Số mol Al là 8,1 : 27 =0,3 mol Số mol khí X là 2,016 : 22,4 =0,09 mol TH1 : khí tạo ra chỉ có 1 N trong công thức Ta có Al → Al+3 + 3e N+5 + (5 - x) e→ N+x Theo định luật bảo toàn e thì 0,3.3=0,09.x suy ra x = 10 (loại vì x < 5) TH2 : khí tạo ra có 2 N Ta có Al → Al+3 + 3e 2N+5 + 2(5 - x) e→ 2N+x Khi đó 0,3.3 = 0,09.2.(5-x) suy ra x = 0 Vậy N có số oxh O trong khí X do đó X là khí N2 Đáp án D Câu hỏi 5 : Thực hiện hai thí nghiệm: 1) Cho 5,76 gam Cu phản ứng với 120 ml dung dịch HNO3 1M thoát ra V1 lít khí NO 2) Cho 5,76 gam Cu phản ứng với 120 ml dung dịch chứa HNO3 1M và H2SO4 0,5M thoát ra V2 lít NO. Biết NO là sản phẩm khử duy nhất, các thể tích khí đo cùng điều kiện. Quan hệ giữa V1 và V2 là:
Đáp án: B Phương pháp giải: Phương pháp : viết phương trình phản ứng thu gọn rồi tính theo pthh Lời giải chi tiết:
Phần 1: \({n_{Cu}} = 0,09\) Số mol HNO3 là 0,12 mol Theo PTHH thì số mol H+ hết nên NO sẽ tính theo H+ suy ra nNO= 0,03mol V1 = 0,672 lít Phần 2 Số mol H+ là 0,12.1 + 0,12.0,5.2 = 0,24 mol Số mol NO3- là 0,12 mol Theo phương trình hóa học số mol H+ và Cu vừa đủ nên nNO= 0,06 mol V2 = 1,344 lít Suy ra V2= 2V1 Đáp án B Câu hỏi 6 : Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NXOY + H2O . Hệ số tối giản của HNO3 là:
Đáp án: C Phương pháp giải: Phương pháp : thăng bằng e Lời giải chi tiết:
Lời giải
(5x-2y) FeO +(16x – 6y) HNO3 → (5x-2y) Fe(NO3)3 + NXOY + (8x-3y)H2O Hệ số tối giản của HNO3 là 16x − 6y Đáp án C Câu hỏi 7 : Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, dư thu được 1,344 lít khí N2 (đktc) và dung dịch X. Thêm NaOH dư vào dung dịch X và đun sôi thì thu được 1,344 lít khí NH3. Gía trị của m là:
Đáp án: D Phương pháp giải: Phương pháp : bảo toàn electron Lời giải chi tiết:
Lời giải : Vì khi cho NaOH vào dd X thì tạo ra khí NH3 nên pư tạo muối NH4NO3 Al → Al+3 + 3e 2N+5 +10e→ N2 N+5 + 8e→ N-3 Số mol khí N2 là 0,06 mol Số mol khí NH3 là 0,06 mol Ta có NH4NO3 + NaOH → NaNO3 + NH3 +H2O Số mol NH4NO3 là 0,06 mol Áp dụng đinh luật bảo toàn e thì 3nAl = 10.0,06 + 8.0,06 nên nAl=0,36 mol Khối lượng của Al là 0,36 .27=9,72 g Đáp án D Câu hỏi 8 : Số mol Cl2 giải phóng ra trong phản ứng nào sau đây là nhỏ nhất khi số mol các chất oxi hóa trông mỗi phản ứng là bằng nhau và HCl đặc dùng dư?
Đáp án: A Phương pháp giải: lập PTHH tìm phản ứng tạo ít khí clo nhất Lời giải chi tiết: A. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O B. 2KMnO4 + 16HCl → 2KCl + MnCl2 +5 Cl2 + H2O C. K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 +7 H2O + 3Cl2 D. KClO3 + 6HCl → KCl + 3Cl2 + 3H2O Số mol Cl2 tạo ra ít nhất ở phản ứng A Đáp án A Câu hỏi 9 : Hoà tan hết 9,6 gam kim loại M trong dung dịch H2SO4 đặc, nóng, thu được SO2 là sản phẩm khử duy nhất. Cho toàn bộ lượng SO2 này hấp thụ vào 0,5 lít dung dịch NaOH 0,6M, sau phản ứng đem cô cạn dung dịch được 18,9 gam chất rắn. Kim loại M đó là
Đáp án: D Phương pháp giải: Vận dụng định luật bảo toàn e M0 → M+x + x e (với x là hóa trị của M) S+6 + 2e → S+4 => nM . x = nSO2 . 2 TH1: Chất rắn chỉ chứa muối NaHSO3: NaOH + SO2 → NaHSO3 TH2: Chất rắn chỉ chứa muối Na2SO3: 2 NaOH + SO2 → Na2SO3 + H2O TH3: Chất rắn chứa 2 muối NaHSO3, Na2SO3 TH4: Chất rắn chứa 1 muối và kiềm dư: NaOH và Na2SO3 Lưu ý ko có trường hợp chất rắn chứa NaHSO3 và NaOH vì 2 chất này phản ứng được với nhau Dựa vào số mol để so sánh xem rơi vào trường hợp nào là đúng Bảo toàn toàn số mol Na. số mol Na trong NaOH bằng tổng số mol trong chất rắn Lời giải chi tiết: nNaOH = 0,5 . 0,6 = 0,3 mol TH1: nếu là NaHSO3 => nNaHSO3 = 18,9: 104 = 0,1817 < 0,3 mol => loại TH2: nếu là Na2SO3 => nNa2SO3 = 18,9: 126 = 0,15 mol Bảo toàn nguyên tố ta có nNa2SO3 . 2 = n NaOH <=> 0,15 . 2 = 0,3 (thỏa mãn) => Chất rắn chứa Na2SO3 => n SO2 = n Na2SO3 = 0,15 mol => n M . x = n SO2 . 2 = 0,3 mol + Với x = 1 => n M = 0,3 mol => MM = 9,6: 0,3 = 32 (loại) + Với x = 2 => n M = 0,15 mol => MM = 9,6: 0,15 = 64 (Cu chọn) + Với x = 3 => n M = 0,1 mol => MM = 9,6: 0,1 = 96 (loại) Vậy kim loại cần tìm là Cu Đáp án D Câu hỏi 10 : Cho phản ứng: FeS2 + H2SO4 đặc nóng→ Fe2(SO4)3 + SO2 + H2O. Tỉ lệ số phân tử bị khử và số phân tử bị oxi hóa là:
Đáp án: B Phương pháp giải: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron cho bằng tổng số electron nhận. Đặt hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Từ đó xác định được tỉ lệ số phân tử bị khử và số phân tử bị oxi hóa. Lời giải chi tiết: Xác định số oxi hóa của các nguyên tố hóa học thay đổi trong phản ứng:
Vậy phương trình hóa học được cân bằng là: 2FeS2 + 14H2SO4 đặc nóng→ Fe2(SO4)3 + 15SO2 + 14H2O Vậy số phân tử bị khử là 15, số phân tử bị oxi hóa là 2. Tỉ lệ số phân tử bị khử và số phân tử bị oxi hóa là 15 : 2. Đáp án B Quảng cáo
|