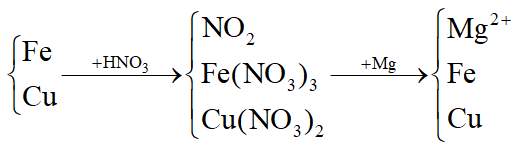20 bài tập vận dụng về phản ứng OXH - Khử có lời giải (phần 1)Làm bàiQuảng cáo
Câu hỏi 1 : Hoà tan hoàn toàn 5,6 gam Fe bằng dung dịch HNO3 loãng dư, sau phản ứng thu được muối Fe(NO3)3 và V lít khí NO2 ở đktc, là sản phẩm khử duy nhất. Giá trị của V là:
Đáp án: C Phương pháp giải: Bảo toàn e: n e cho = n e nhận => 3nFe = nNO2 Lời giải chi tiết: nFe = 0,1 mol Fe → Fe+3 + 3e N+5 +1e → N+4 0,1 → 0,3 mol 0,3 → 0,3 mol Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,3 mol => nNO2 = n e nhận = 0,3 mol => VNO2 = 0,3 . 22,4 = 6,72 lít Đáp án C Câu hỏi 2 : Hoà tan hoàn toàn m gam Cu bằng dung dịch HNO3 loãng dư, sau phản ứng thu được dung dịch chứa muối Cu(NO3)2 và 2,24 lít khí NO (ở đktc) là sản phẩm khử duy nhất. Giá trị của m là:
Đáp án: C Phương pháp giải: Bảo toàn e: n e cho = n e nhận => 2nCu = 3nNO Lời giải chi tiết: nNO= 0,1 mol Cu → Cu+2 + 2e N+5 +3e → N+2 0,15 ← 0,3 mol 0,3 ← 0,1 mol Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,3 mol => nCu = n e cho : 2 = 0,15 mol => m = 0,15 . 64 = 9,6g Đáp án C Câu hỏi 3 : Hoà tan hoàn toàn m gam Cu bằng dung dịch HNO3 loãng dư, sau phản ứng thu được dung dịch chứa muối Cu(NO3)2 và hỗn hợp khí gồm NO; NO2 có số mol lần lượt là 0,1 và 0,2 mol. Giá trị của m là:
Đáp án: B Phương pháp giải: Bảo toàn e: n e cho = n e nhận => 2nCu = 3nNO + nNO2 Lời giải chi tiết: nNO= 0,1 mol Cu → Cu+2 + 2e N+5 +3e → N+2 N+5 + 1e → N+4 0,25 ← 0,5 mol 0,3 ← 0,1 mol 0,2 ← 0,2 Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,5 mol => nCu = n e cho : 2 = 0,25 mol => m = 0,25 . 64 = 16g Đáp án B Câu hỏi 4 : Hoà tan hoàn toàn hỗn hợp X gồm 5,6 gam Fe và 6,4 gam Cu, sau phản ứng thu được dung dịch A chứa hỗn hợp muối gồm Fe(NO3)3 và Cu(NO3)2; khí NO2 (đktc) là sản phẩm khử duy nhất. Thể tích khí NO2 thu được là:
Đáp án: A Phương pháp giải: Bảo toàn e: n e cho = n e nhận => 2nCu + 3nFe = nNO2 Lời giải chi tiết: nFe= 0,1 mol; nCu= 0,1 mol Cu → Cu+2 + 2e Fe → Fe+3 +3e N+5 + 1e → N+4 0,1 → 0,2 mol 0,1 → 0,3 mol 0,5 → 0,5 Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,5 mol => nNO2 = n e nhận= 0, 5 mol => m = 0, 5 . 22,4 = 11,2lít Đáp án A Câu hỏi 5 : Hoàn tan hoàn toàn 15,2 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y gồm 2 muối nitrat và 13,44 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Phần trăm theo khối lượng của Fe trong hỗn hợp X là:
Đáp án: A Phương pháp giải: Bảo toàn e: n e cho = n e nhận => 2nCu + 3nFe = nNO2 Lời giải chi tiết: nCu= x mol; nFe= y mol => mX = 64x + 56y = 15,2 (1) nNO2 = 13,44 : 22,4= 0,6mol Cu → Cu+2 + 2e Fe → Fe+3 +3e N+5 + 1e → N+4 x → 2x mol y → 3y mol 0,6 ← 0,6 Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 2x + 3y = 0,6mol (2) Giải hệ (1) và (2) => x = 0,15 và y = 0,1 => %Fe = [(0,1 . 56) : 15,2] . 100% = 36,84% Đáp án A Câu hỏi 6 : Hoà tan hoàn toàn 15,2 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y gồm 2 muối nitrat và hỗn hợp Y gồm 2 khí NO và NO2 có số mol lần lượt là 0,1 và 0,3. Phần trăm theo khối lượng của Cu trong hỗn hợp X là:
Đáp án: B Phương pháp giải: Bảo toàn e: n e cho = n e nhận => 2nCu + 3nFe = 3nNO + nNO2 Lời giải chi tiết: nCu= x mol; nFe= y mol => mX = 64x + 56y = 15,2 (1) Cu → Cu+2 + 2e N+5 + 3e → N+2 x → 2x mol 0,3 ← 0,1 Fe → Fe+3 +3e N+5 +1e →N+4 y → 3y mol 0,3←0,3 Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 2x + 3y = 0,6 mol (2) Giải hệ (1) và (2) => x = 0,15 và y = 0,1 => %Cu = [(0,15 . 64) : 15,2] . 100% = 63,16% Đáp án B Câu hỏi 7 : Hoà tan hoàn toàn 15,2 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y gồm 2 muối nitrat và hỗn hợp Y gồm 2 khí NO và NO2 có số mol lần lượt là 0,1 và 0,3. Tổng khối lượng muối thu được trong dung dịch Y là:
Đáp án: B Phương pháp giải: Bảo toàn e: n e cho = n e nhận => 2nCu + 3nFe = 3nNO + nNO2 Lời giải chi tiết: nCu= x mol; nFe= y mol => mX = 64x + 56y = 15,2 (1) Cu → Cu+2 + 2e N+5 + 3e → N+2 x → 2x mol 0,3 ← 0,1 Fe → Fe+3 +3e N+5 +1e →N+4 y → 3y mol 0,3←0,3 Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 2x + 3y = 0,6 mol (2) Giải hệ (1) và (2) => x = 0,15 và y = 0,1 m muối = mCu(NO3)2 + mFe(NO3)3 = 0,15 . 188 + 0,1 . 242 = 52,4g Đáp án B Câu hỏi 8 : Hoà tan hoàn toàn 15,2 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y gồm 2 muối nitrat và hỗn hợp Y gồm 2 khí NO và NO2 có số mol lần lượt là 0,1 và 0,3. Thể tích dung dịch HNO3 1M đã dùng là:
Đáp án: C Phương pháp giải: Bảo toàn e: n e cho = n e nhận => 2nCu + 3nFe = 3nNO + nNO2 Lời giải chi tiết: nCu= x mol; nFe= y mol => mX = 64x + 56y = 15,2 (1) Cu → Cu+2 + 2e N+5 + 3e → N+2 x → 2x mol 0,3 ← 0,1 Fe → Fe+3 +3e N+5 +1e →N+4 y → 3y mol 0,3←0,3 Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 2x + 3y = 0,6 mol (2) Giải hệ (1) và (2) => x = 0,15 và y = 0,1 n HNO3 = 2nCu(NO3)2 + 3nFe(NO3)3 + nNO + nNO2 = 0,15 . 2 + 0,1 . 3 + 0,1 + 0,3 = 1mol => V = 1 lít Đáp án C Câu hỏi 9 : Đốt cháy 5,6 gam Fe trong 1,12 lít O2 (đktc), sau một thời gian thu được hỗn hợp X gồm: FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan hoàn toàn hỗn hợp X bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối Fe(NO3)3 và V lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của V là:
Đáp án: A Phương pháp giải: Quy đổi hh X gồm Fe và O2 (0,05 mol) Bảo toàn e: 3nFe = 4nO2 + nNO2 Lời giải chi tiết: Quy đổi hh X gồm Fe và O2 nFe = 0,1 mol; nO2 = 0,05 mol Fe → Fe+3 + 3e O2 + 4e→ O-2 N+5 + 1e → N+4 0,1 → 0,3 mol 0,05→ 0,2mol 0,3 – 0,2→ 0,1 Áp dụng định luật bảo toàn e => nNO2 = 0,1 mol => VNO2 = 2,24 lít Đáp án A Câu hỏi 10 : Đốt cháy m gam Fe trong 1,12 lít O2 (đktc), sau một thời gian thu được hỗn hợp Y gồm: FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan hoàn toàn hỗn hợp X bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối Fe(NO3)3 và 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
Đáp án: A Phương pháp giải: Quy đổi hh X gồm Fe và O2 (0,05 mol) Bảo toàn e: 3nFe = 4nO2 + nNO2 Lời giải chi tiết: Quy đổi hh X gồm Fe và O2 nNO2 = 0,1 mol; nO2 = 0,05 mol Fe → Fe+3 + 3e O2 + 4e→ O-2 N+5 + 1e → N+4 x → 3x mol 0,05→ 0,2mol 0,1← 0,1 Áp dụng định luật bảo toàn e ta có 3x = 0,2 + 0,1 => x = 0,1 mol => m = 5,6g Đáp án A Câu hỏi 11 : Hoà tan hoàn toàn m gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch Y gồm 2 muối Fe(NO3)3 và Cu(NO3)2; 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Dung dịch Y tác dụng vừa đủ với m’ gam Mg (Mg đẩy Fe và Cu ra khỏi muối). Giá trị của m’ là:
Đáp án: A Phương pháp giải:
Từ sơ đồ dễ dàng thấy sau tất cả các phản ứng chỉ có Mg và N có số oxi hóa thay đổi Viết các quá trình cho nhận e, áp dụng định luật bảo toàn e suy ra số mol Mg. Lời giải chi tiết: nNO2 = 0,1 mol
Từ sơ đồ dễ dàng thấy sau tất cả các phản ứng chỉ có Mg và N có số oxi hóa thay đổi Ta có Mg → Mg2+ + 2e N+5 + 1e → N+4 a → 2a 0,1 ← 0,1 Áp dụng định luật bảo toán e ta có 2a = 0,1 => a = 0,05 mol => m = 0,05 . 24 = 1,2g Đáp án A Câu hỏi 12 : Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng trong điều kiện không có không khí, thu được hỗn hợp rắn Y. Cho Y tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí Z và còn lại một phần không tan G. Để đốt cháy hoàn toàn Z và G cần vừa đủ V lít O2 (ở đktc). Giá trị của V là:
Đáp án: A Phương pháp giải: Ta thấy chuỗi phản ứng sau Fe → Fe+2 (FeCl2) S → S+4 (SO2) H+ → H2 → H2O => H không thay đổi số oxi hóa O2 → O-2 Như vậy trao đổi e chỉ có Fe,S và O2 Viết các quá trình cho nhận e, sử dụng định luật bảo toàn e tính được số mol O2. Lời giải chi tiết: Ta thấy chuỗi phản ứng sau Fe → Fe+2 (FeCl2) S → S+4 (SO2) H+ → H2 → H2O => H không thay đổi số oxi hóa O2 → O-2 Như vậy trao đổi e chỉ có Fe,S và O2 Fe → Fe+2 +2e 0,1...............0,2 S → S+4+4e 0,075......0,3 =>ne nhận=ne cho=0,3+0,2=0,5 O2 + 4e → 2O-2 1/8....0,5 =>V O2=2,8 lit Đáp án A Câu hỏi 13 : Khử hoàn toàn 6,64 gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 cần dùng 2,24 lít CO (đktc) . Khối lượng Fe thu được là:
Đáp án: A Phương pháp giải: Dễ thấy CO + [O] →CO2 (1) trong đó [O] lấy từ oxit nCO = nO (oxit) => mO(oxit) => mFe Lời giải chi tiết: Dễ thấy CO + [O] →CO2 (1) trong đó [O] lấy từ oxit Mà nCO = 0,1 mol => nCO2 = 0,1 mol (bảo toàn C) nên áp dụng bảo toàn khối lượng cho (1) ta được : m[O] = mCO2 - mCO = 0,1(44 - 28) = 1.6 g => mFe = mX - m[O] = 6,64 - 1.6 = 5,04 g Đáp án A Câu hỏi 14 : Hoà tan hoàn toàn m gam Fe bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm muối Fe(NO3)3 và 2,24 lít khí NO (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
Đáp án: A Phương pháp giải: Viết quá trình cho và nhận e. Áp dụng định luật bảo toàn e tính được số mol Fe. Lời giải chi tiết: nNO= 0,1 mol Fe → Fe+3 + 3e N+5 +3e → N+2 0,1 ← 0,3 mol 0,3 ← 0,1 mol Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,3 mol => nFe= 1/3 n e cho = 0,1 mol => mFe = 0,1 . 56 = 5,6 g Đáp án A Câu hỏi 15 : Hoà tan hoàn toàn m gam Fe bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm muối Fe(NO3)3 và 2,24 lít khí NO (đktc) là sản phẩm khử duy nhất. Thể tích dung dịch HNO3 đã dùng là:
Đáp án: B Phương pháp giải: Viết quá trình cho và nhận e. Áp dụng định luật bảo toàn e tính được số mol Fe. Áp dụng định luật bảo toàn nguyên tố cho nguyên tố N: nHNO3 = nNO + 3 . nFe(NO3)3 Lời giải chi tiết: nNO= 0,1 mol Fe → Fe+3 + 3e N+5 +3e → N+2 0,1 ← 0,3 mol 0,3 ← 0,1 mol Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,3 mol => nFe= 1/3 n e cho = 0,1 mol => nFe(NO3)3 = 0,1 mol nHNO3 = nNO + 3 . nFe(NO3)3 = 0,1 + 0,1 . 3 = 0,4 mol => VHNO3 = nHNO3 : CM HNO3 = 0,4 . 1 = 0,4 lít Đáp án B Câu hỏi 16 : Hoà tan hoàn toàn m gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 và 2,24 lít khí NO (đktc) là sản phẩm khử duy nhất. Thể tích dung dịch HNO3 đã dùng là:
Đáp án: B Phương pháp giải: Viết bán phản ứng: NO3- + 4H+ + 3e → NO + 2H2O Từ số mol NO tính được số mol H+ => nHNO3 => V dd HNO3 Lời giải chi tiết: Cách 1: (nhanh) nNO=0,1 mol NO3- + 4H+ + 3e → NO + 2H2O 0,4 ← 0,1 VHNO3 = nHNO3 : CM = 0,4 : 1 = 0,4 lít Cách 2: nNO = 2,24 :22,4 = 0,1 (mol) Sau phản ứng Fe lên Fe+3; Cu lên Cu+2; N+5 xuống N+2 (trong NO) Qúa trình nhường e: Fe → Fe+3 + 3e x → x → 3x (mol) Cu → Cu +2 + 2e y → y → 2y (mol) Qúa trình nhận e N+5 +3e → N+2 (NO) 0,3 ← 0,1 (mol) Bảo toàn e ta có: ∑ne KL nhường = ∑ne N+5 nhận => (3x+2y) = 0,3 (1) Ta có: nHNO3 ban đầu = nNO3- (trong muối) + nNO = 3nFe(NO3)3 + 2nCu(NO3)2 + nNO = 3x + 2y + 0,1 = 0,3 + 0,1 (do thế (1) vào) = 0,4 (mol) => VHNO3 đã dùng = n : CM = 0,4 : 1 = 0,4 (lit) Đáp án B Câu hỏi 17 : Hoà tan hoàn 12,4 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 đồng thời thu được hỗn hợp khí Y gồm: 0,1 mol NO và 0,15 mol NO2 (đktc). Phần trăm theo khối lượng Fe có trong hỗn hợp là:
Đáp án: A Phương pháp giải: Đặt ẩn là số mol của Fe và Cu. Từ khối lượng hỗn hợp => (1) Viết quá trình cho và nhận e. Bảo toàn electron => (2) Giải (1) và (2) thu được số mol của Fe và Cu. Lời giải chi tiết: nCu= x mol; nFe= y mol => mX = 64x + 56y = 12,4 (1) Cu → Cu+2 + 2e N+5 + 3e → N+2 x → 2x mol 0,3 ← 0,1 Fe → Fe+3 +3e N+5 +1e →N+4 y → 3y mol 0,15←0,15 Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 2x + 3y = 0,45 mol (2) Giải hệ (1) và (2) => x = 0,15 và y = 0,05 => %Fe = [(0,05 . 56) : 12,4] . 100% = 22,58% Đáp án A Câu hỏi 18 : Hoà tan hoàn 12,4 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 đồng thời thu được hỗn hợp khí Y gồm: 0,1 mol NO và 0,15 mol NO2 (đktc). Thể tích dung dịch HNO3 đã dùng là:
Đáp án: C Phương pháp giải: Viết các bán phản ứng: NO3- + 4H+ + 3e → NO + 2H2O NO3- + 2H+ + 1e → NO2 + H2O Từ số mol của NO và NO2 ta tính được số mol H+ => nHNO3 => V dd HNO3 Lời giải chi tiết: NO3- + 4H+ + 3e → NO + 2H2O NO3- + 2H+ + 1e → NO2 + H2O 0,4 ← 0,1 0,3 ← 0,15 nHNO3 = 4 nNO + 2nNO2 = 0,4 + 0,3 = 0,7 mol VHNO3 = nHNO3 : CM = 0,7 : 1 = 0,7 lít Đáp án C Câu hỏi 19 : Hoà tan hoàn toàn 3,6 gam kim loại R có hoá trị II (không đổi) bằng dung dịch HNO3, sau phản ứng thu được dung dịch gồm muối nitrat của kim loại R và 2,24 lít khí NO (đktc) là sản phẩm khử duy nhất. Kim loại R là:
Đáp án: C Phương pháp giải: Viết các quá trình cho và nhận e. Áp dụng định luật bảo toàn e tìm được số mol của R. Từ khối lượng đã biết và số mol vừa tính được ta xác định được khối lượng mol => R Lời giải chi tiết: nNO= 0, 1mol R → R+2 + 2e N+5 + 3e →N+2 0,15 ← 0,3 mol 0,3 ← 0,1 Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,3 mol => nR = 0,15 mol => MR = 3,6 : 0,15 = 24 (Mg) Đáp án C Câu hỏi 20 : Nung 11,2 gam Fe trong không khí, sau một thời gian thu được m gam hỗn hợp rắn X gồm: Fe, FeO, Fe2O3 và Fe3O4. Hoà tan hoàn toàn hỗn hợp X bằng dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch A chỉ chứa muối Fe(NO)3 và 2,24 lít NO (đktc). Giá trị của m là:
Đáp án: A Phương pháp giải: Quy đổi hh X gồm Fe và O2. Đặt ẩn là số mol của O2. Viết các quá trình cho và nhận e: Fe → Fe+3 + 3e O2 + 4e→ O-2 N+5 + 3e → N+2 Áp dụng định luật bảo toàn e tính được số mol của O2. => m = mFe + mO2 = ? Lời giải chi tiết: Quy đổi hh X gồm Fe và O2 nFe = 0,2mol; nNO= 0,1mol Fe → Fe+3 + 3e O2 + 4e→ O-2 N+5 + 3e → N+2 0,2 → 0,6 mol x→ 4xmol 0,3 ←0,1 Áp dụng định luật bảo toàn e ta có: 0,6 = 4x + 0,3 => x = 0,075mol => m = mFe + mO2 = 11,2 + 0,075 . 32 = 13,6g Đáp án A Quảng cáo
|