Đề kiểm tra 15 phút Hóa 12 chương 5: Đại cương về kim loại - Đề số 1Đề bài
Câu 1 :
Khi điều chế kim loại, các ion kim loại đóng vai trò là chất
Câu 2 :
Cho các ion kim loại: Zn2+, Sn2+, Ni2+, Fe2+, Pb2+. Thứ tự tính oxi hoá giảm dần là
Câu 3 :
Hòa tan hoàn toàn 5,4 gam Al trong dung dịch H2SO4 dư. Khối lượng muối sinh ra là
Câu 4 :
Cho 1 lượng Cu phản ứng hết với dung dịch H2SO4đặc nóng dư, sau phản ứng thu được 2,24 lít khí SO2 (đktc) và m gam muối khan. Giá trị của m là
Câu 5 :
X, Y là kim loại không phản ứng được với dung dịch H2SO4 loãng, Y tác dụng được với dung dịch Fe(NO3)3 còn X thì không. Hai kim loại X, Y có thể là
Câu 6 :
Ngâm một kim loại X vào dung dịch HCl thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vào vài giọt dung dịch FeSO4 thì thấy bọt khí thoát ra rất nhiều và nhanh. Kim loại X là
Câu 7 :
Dãy gồm các kim loại đều có thể điều chế được bằng phương pháp nhiệt luyện là
Câu 8 :
Kim loại vừa phản ứng với dung dịch HCl, vừa phản ứng với dung dịch NaOH là
Câu 9 :
m gam chất rắn. Giá trị của m là Cho 12 gam Fe vào 100 ml dung dịch chứa CuSO4 1M và Fe2(SO4)3 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được
Câu 10 :
Dãy cation kim loại được xếp theo chiều tăng dần tính oxi hóa từ trái sang phải là
Lời giải và đáp án
Câu 1 :
Khi điều chế kim loại, các ion kim loại đóng vai trò là chất
Đáp án : A Lời giải chi tiết :
Ion kim loại bị khử : Mn+ + ne → M
Câu 2 :
Cho các ion kim loại: Zn2+, Sn2+, Ni2+, Fe2+, Pb2+. Thứ tự tính oxi hoá giảm dần là
Đáp án : D Lời giải chi tiết :
D đúng vì thứ tự cặp oxi hóa – khử là: $\dfrac{{Z{n^{2 + }}}}{{Zn}};\,\dfrac{{F{e^{2 + }}}}{{Fe}};\,\dfrac{{N{i^{2 + }}}}{{Ni}};\,\dfrac{{S{n^{2 + }}}}{{Sn}};\,\dfrac{{P{b^{2 + }}}}{{Pb}}$ → Thứ tự tính oxi hóa giảm dần: Pb2+ > Sn2+ > Ni2+ > Fe2+ > Zn2+
Câu 3 :
Hòa tan hoàn toàn 5,4 gam Al trong dung dịch H2SO4 dư. Khối lượng muối sinh ra là
Đáp án : B Phương pháp giải :
Bảo toàn nguyên tố : \({n_{A{l_2}{{(S{O_4})}_3}}} = {1 \over 2}{n_{Al}}\) Lời giải chi tiết :
nAl = 0,2 mol Bảo toàn nguyên tố :\({n_{A{l_2}{{(S{O_4})}_3}}} = {1 \over 2}{n_{Al}}\) = 0,1 mol => \({m_{A{l_2}{{(S{O_4})}_3}}}\)= 0,1.342 = 34,2 gam
Câu 4 :
Cho 1 lượng Cu phản ứng hết với dung dịch H2SO4đặc nóng dư, sau phản ứng thu được 2,24 lít khí SO2 (đktc) và m gam muối khan. Giá trị của m là
Đáp án : C Phương pháp giải :
+) ne nhận = 2nSO2 +) nFe = necho / 3 = ne nhận / 3 +)\({n_{SO_4^{2 - }}} = {{{n_{e{\rm{ }}cho}}} \over 2}\) +) mmuối = mFe + mSO4 Lời giải chi tiết :
nSO2 = 0,1 mol => ne nhận = 2nSO2 = 0,2 mol => nCu = necho / 2 = ne nhận / 2 = 0,1 mol \({n_{SO_4^{2 - }}} = {{{n_{e{\rm{ }}cho}}} \over 2}\) = 0,1 mol => mmuối = mCu + mSO4 = 0,1.64 + 0,1.96 = 16 gam
Câu 5 :
X, Y là kim loại không phản ứng được với dung dịch H2SO4 loãng, Y tác dụng được với dung dịch Fe(NO3)3 còn X thì không. Hai kim loại X, Y có thể là
Đáp án : C Lời giải chi tiết :
X, Y không phản ứng được với dung dịch H2SO4 → X, Y đứng sau H trong dãy điện hóa → Loại đáp án A, B vì có Fe đứng trước H. Y tác dụng được với Fe3+ → Loại đáp án D => Chọn C
Câu 6 :
Ngâm một kim loại X vào dung dịch HCl thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vào vài giọt dung dịch FeSO4 thì thấy bọt khí thoát ra rất nhiều và nhanh. Kim loại X là
Đáp án : C Phương pháp giải :
xem lại lí thuyết ăn mòn kim loại Lời giải chi tiết :
X + HCl → H2 X+ FeSO4 → Fe (1) Để bọt khí thoát ra nhiều và nhanh thì xảy ra hiện tượng ăn mòn điện hóa → X là kim loại có tính khử mạnh hơn Fe → X là Zn
Câu 7 :
Dãy gồm các kim loại đều có thể điều chế được bằng phương pháp nhiệt luyện là
Đáp án : A Phương pháp giải :
Phương pháp nhiệt luyện (dùng kim loại mạnh để đẩy kim loại yếu ra khỏi dung dịch muối) => dùng để điều chế các kim loại từ Mg trở về sau trong dãy điện hóa Lời giải chi tiết :
Phương pháp nhiệt luyện (dùng kim loại mạnh để đẩy kim loại yếu ra khỏi dung dịch muối) => dùng để điều chế các kim loại từ Mg trở về sau trong dãy điện hóa A. thỏa mãn B. loại Ba C. Loại Na. D. Loại Ca
Câu 8 :
Kim loại vừa phản ứng với dung dịch HCl, vừa phản ứng với dung dịch NaOH là
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của các kim loại Al, Fe, Cr, Cu đã được học để chọn ra kim loại phù hợp với yêu cầu. Lời giải chi tiết :
Al vừa phản ứng được với dd HCl và dd NaOH 3Al + 6HCl → 2AlCl3 + 3H2↑ Al + NaOH + H2O → NaAlO2 + 3/2H2↑
Câu 9 :
m gam chất rắn. Giá trị của m là Cho 12 gam Fe vào 100 ml dung dịch chứa CuSO4 1M và Fe2(SO4)3 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được
Đáp án : C Phương pháp giải :
bảo toàn điện tích: nFe2+ = nSO42- bảo toàn khối lượng kim loại ta có: mFe + mCu2+ + mFe3+ = mFe2+ + m Lời giải chi tiết :
nFe = 12: 56 ≈ 0,21 (mol) nCuSO4 = nFe2(SO4)3 = 0,1.1 = 0,1 (mol) Khi cho Fe vào hh 2 muối xảy ra phản ứng theo thứ tự là: Fe + Fe3+ → Fe2+ Fe + Cu2+ → Cu↓ + Fe2+ Dung dịch sau phản ứng chứa Fe2+ và SO42- Mà ∑ nSO42- = 0,1 + 0,1.3 = 0,4 (mol) → nFe2+ = nSO42- = 0,4 (mol) BTKL kim loại ta có: 12 + 0,1.64 + 0,1.2.56 = 0,4.56 + m → m = 7,2 (g)
Câu 10 :
Dãy cation kim loại được xếp theo chiều tăng dần tính oxi hóa từ trái sang phải là
Đáp án : B Phương pháp giải :
Xem lại dãy điện hóa kim loại hóa 12 Lời giải chi tiết :
Dãy cation kim loại được xếp theo chiều tăng dần tính oxi hóa từ trái sang phải là: Mg2+, Fe2+, Cu2+ |














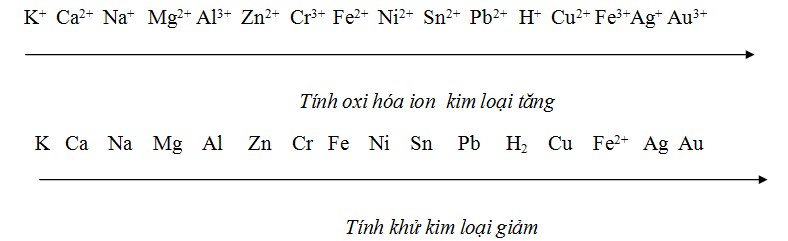





Danh sách bình luận