Đề kiểm tra 1 tiết Hóa 12 chương 5: Đại cương về kim loại - Đề số 1Đề bài
Câu 1 :
Hòa tan hoàn toàn 8,96 gam Fe trong dung dịch H2SO4 dư. Khối lượng muối sinh ra là
Câu 2 :
Sản phẩm thu được khi điện phân NaOH nóng chảy là gì ?
Câu 3 :
Trong quá trình điện phân dung dịch AgNO3, ở cực dương xảy ra phản ứng
Câu 4 :
Ngâm một thanh kẽm trong 100 ml dung dịch AgNO3 0,2M. Giả sử kim loại sinh ra bám hết vào thanh kẽm. Sau khi phản ứng hoàn toàn khối lượng thanh kẽm tăng bao nhiêu gam ?
Câu 5 :
Trong quá trình hoạt động của pin điện hoá Cu-Ag nồng độ của các ion trong dung dịch biến đổi như thế nào ?
Câu 6 :
Điện phân 500 ml dung dịch hỗn họp FeSO4 0,1M, Fe2(SO4)3 0,2M và CuSO4 0,1M với điện cực trơ. Điện phân cho đến khi khối lượng catot tăng 8,8 gam thì ngừng điện phân. Biết cường độ dòng điện đem điện phân là 10A. Thời gian điện phân là:
Câu 7 :
Hoà tan hoàn toàn 3 kim loại Zn, Fe, Cu bằng dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn không tan là Cu. Các chất tan có trong dung dịch sau phản ứng là
Câu 8 :
Cho 4 dung dịch muối: CuSO4, K2SO4, NaCl, KNO3. Dung dịch nào sau điện phân cho ra một dung dịch axit ?
Câu 9 :
Có hai bình điện phân mắc nối tiếp nhau. Bình 1 chứa dung dịch CuCl2, bình 2 chứa dung dịch AgNO3. Tiến hành điện phân với điện cực trơ, kết thúc điện phân thấy catot của bình 1 tăng lên 1,6 gam. Khối lượng catot của bình 2 tăng lên là
Câu 10 :
Cho các hợp kim sau: Cu-Fe (I); Zn-Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn là
Câu 11 :
Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp
Câu 12 :
Kim loại nào dưới đây không tan trong dung dịch NaOH ?
Câu 13 :
Cho khí CO qua hỗn hợp T gồm Fe và Fe2O3 nung nóng thu được hỗn hợp khí B và hỗn hợp chất rắn D. Cho B qua dung dịch Ca(OH)2 dư thu được 6 gam kết tủa. Mặt khác, hòa tan hỗn hợp D bằng dung dịch H2SO4 đặc, nóng, dư thu được 0,18 mol SO2 (sản phẩm khử duy nhất) và 24 gam muối. Phần trăm số mol của Fe trong hỗn hợp T là
Câu 14 :
Cho hỗn hợp gồm Mg (7a mol) và Fe (4a mol) vào dung dịch chứa 0,08 mol FeCl3 và 0,16 mol CuCl2, sau một thời gian thu được dung dịch X và 7,36 gam chất rắn Y. Cho dung dịch AgNO3 dư vào X, kết thúc phản ứng thu được 84,68 gam kết tủa. Nếu cho NaOH dư vào X (không có mặt oxi) thu được 24,72 gam các hiđroxit kim loại. Lấy 7,36 gam Y hòa tan trong dung dịch HNO3 loãng dư thu được 0,08 mol khí NO duy nhất và dung dịch T chứa m gam muối. Giá trị của m là
Câu 15 :
Phản ứng nào sau đây là phản ứng điều chế kim loại bằng phương pháp nhiệt luyện
Câu 16 :
Cho Eo(Cu-Ag) = 0,46V và suất điện động của pin Fe - Ag là 1,24 V. Tính Eo(Fe-Cu)
Câu 17 :
Cho dung dịch Mg(NO3)2 có lẫn tạp chất là dung dịch AgNO3. Hóa chất có thể dùng để loại bỏ tạp chất là
Câu 18 :
Bạc là kim loại được dùng phổ biến để tạo trang sức là vì :
Câu 19 :
Cho các kim loại: K, Al, Mg, Na, Ba. Số kim loại có thể tác dụng với nước ở điều kiện thường tạo ra dung dịch làm xanh giấy quỳ tím là
Câu 20 :
Phương trình hóa học nào sau đây không biểu diễn PTHH của phản ứng điều chế kim loại bằng phương pháp điện phân?
Câu 21 :
Dung dịch Cu(NO3)2 có lẫn tạp chất AgNO3 .Phương pháp hoá học đơn giản để loại được tạp chất là
Câu 22 :
Cho Fe phản ứng với dung dịch H2SO4 đặc, sau phản ứng thu được khí mùi trứng thối. Khí đó là
Câu 23 :
Cho 9,75 gam Zn tan hoàn toàn trong dung dịch HNO3 loãng, sau phản ứng thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V là
Câu 24 :
Cho các kim loại: Na, Ca, Zn, Mg, Fe, Cu, Cr, Ag, Al, Pb. Số kim loại điều chế được bằng phương pháp nhiệt luyện là:
Câu 25 :
Cho các mệnh đề sau, số mệnh đề đúng là: 1, Fe khử được Cu2+ trong dung dịch. 2, Fe3+ có tính oxi hóa mạnh hơn Cu2+. 3, Fe2+ oxi hoá được Cu. 4, Tính oxi hóa của các ion tăng theo thứ tự: Fe2+, H+, Cu2+, Ag+. Số mệnh đề đúng là
Câu 26 :
Cho hỗn hợp bột Mg, Al vào dung dịch chứa Fe(NO3)2 và Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn gồm ba kim loại là:
Câu 27 :
Trong các phát biểu sau, phát biểu đúng là?
Câu 28 :
Phát biểu nào sau đây là đúng?
Câu 29 :
Khi cho Fe vào dung dịch hỗn hợp các muối AgNO3, Cu(NO3)2, Pb(NO3)2 thì Fe sẽ khử ion kim loại theo thứ tự sau (ion đặt trước sẽ bị khử trước):
Câu 30 :
Điện phân dung dịch X chứa KCl và CuSO4 bằng dòng điện một chiều có cường độ 5A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch). Toàn bộ khí sinh ra trong quá trình điện phân (ở cả hai điện cực) theo thời gian được biểu diễn bằng đồ thị bên.
Phát biểu nào sau đây đúng?
Lời giải và đáp án
Câu 1 :
Hòa tan hoàn toàn 8,96 gam Fe trong dung dịch H2SO4 dư. Khối lượng muối sinh ra là
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố : nFeSO4 = nFe Lời giải chi tiết :
nFe = 0,16 mol Bảo toàn nguyên tố : nFeSO4 = nFe = 0,16 mol => mFeSO4 = 0,16.152 = 24,32 gam
Câu 2 :
Sản phẩm thu được khi điện phân NaOH nóng chảy là gì ?
Đáp án : A Lời giải chi tiết :
NaOH → Na + O2 + 2H2O => ở catot (-): Na và ở anot (+): O2 và H2O.
Câu 3 :
Trong quá trình điện phân dung dịch AgNO3, ở cực dương xảy ra phản ứng
Đáp án : B Lời giải chi tiết :
Cực dương (+):2H2O → O2 + 4H+ + 4e
Câu 4 :
Ngâm một thanh kẽm trong 100 ml dung dịch AgNO3 0,2M. Giả sử kim loại sinh ra bám hết vào thanh kẽm. Sau khi phản ứng hoàn toàn khối lượng thanh kẽm tăng bao nhiêu gam ?
Đáp án : B Phương pháp giải :
Độ tăng khối lượng = ${{\text{m}}_{\text{B}\downarrow }}$- ${{\text{m}}_{\text{A tan}}}$ Lời giải chi tiết :
nAgNO3 = 0,1.0,2 = 0,02 mol Zn + 2AgNO3 → Zn(NO3)2 + 2Ag 0,01 ← 0,02 → 0,02 => Độ tăng khối lượng = ${{\text{m}}_{\text{B}\downarrow }}$- ${{\text{m}}_{\text{A tan}}}$= 0,02.108 – 0,01.65 = 1,51 gam
Câu 5 :
Trong quá trình hoạt động của pin điện hoá Cu-Ag nồng độ của các ion trong dung dịch biến đổi như thế nào ?
Đáp án : D Lời giải chi tiết :
Quá trình hoạt động của pin Cu-Ag : Cu → Cu2+ + 2e => tăng nồng độ ion Cu2+ Ag+ + 1e → Ag => giảm nồng độ ion Ag+
Câu 6 :
Điện phân 500 ml dung dịch hỗn họp FeSO4 0,1M, Fe2(SO4)3 0,2M và CuSO4 0,1M với điện cực trơ. Điện phân cho đến khi khối lượng catot tăng 8,8 gam thì ngừng điện phân. Biết cường độ dòng điện đem điện phân là 10A. Thời gian điện phân là:
Đáp án : C Phương pháp giải :
Từ mcatot tăng => Khối lượng kim loại bám vào Xác định chất bị điện phân : gồm Cu2+, Fe3+ và Fe2+ bị điện phân 1 phần Tính ${{n}_{{{e}_{td}}}}=\frac{It}{F}\Rightarrow t$ Lời giải chi tiết :
nFe3+ = 0,2 mol ; nCu2+ = 0,05mol ; nFe2+ =0,05mol mtăng = mCu + mFe => mFe = 8,8 – 0,05.64 = 5,6g => nFe = 0,1mol Các ion đã điện phân ở catot: Fe3+ , Cu2+, Fe2+ điện phân 1 phần netđ = nFe3+ + 2nCu2+ + 2nFe2+ = 0,2 + 0,05.2 + 0,1.2 = 0,5 mol => $t=\frac{F.{{n}_{{{e}_{t\text{d}}}}}}{I} =\frac{96500.0,5}{10}=4825s$
Câu 7 :
Hoà tan hoàn toàn 3 kim loại Zn, Fe, Cu bằng dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn không tan là Cu. Các chất tan có trong dung dịch sau phản ứng là
Đáp án : D Lời giải chi tiết :
Sau phản ứng thu được chất rắn không tan là Cu → trong dung dịch không còn muối Fe(NO3)3
Câu 8 :
Cho 4 dung dịch muối: CuSO4, K2SO4, NaCl, KNO3. Dung dịch nào sau điện phân cho ra một dung dịch axit ?
Đáp án : B Lời giải chi tiết :
Dung dịch điện phân cho ra axit => cation bị điện phân => dung dịch CuSO4 Phương trình điện phân : 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Câu 9 :
Có hai bình điện phân mắc nối tiếp nhau. Bình 1 chứa dung dịch CuCl2, bình 2 chứa dung dịch AgNO3. Tiến hành điện phân với điện cực trơ, kết thúc điện phân thấy catot của bình 1 tăng lên 1,6 gam. Khối lượng catot của bình 2 tăng lên là
Đáp án : B Phương pháp giải :
2 bình điện phân mắc nối tiếp => ne trao đổi bình 1 = ne trao đổi bình 2 +) ne trao đổi = 2.nCu = nAg = 0,025.2 = 0,05 mol Lời giải chi tiết :
2 bình điện phân mắc nối tiếp => ne trao đổi bình 1 = ne trao đổi bình 2 nCu = 1,6/64 = 0,025 mol => ne trao đổi = 0,025.2 = 0,05 mol => nAg = 0,05 mol => mbình 2 tăng = mAg = 5,4 gam
Câu 10 :
Cho các hợp kim sau: Cu-Fe (I); Zn-Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn là
Đáp án : C Phương pháp giải :
xem lại lí thuyết ăn mòn kim loại Lời giải chi tiết :
Trong hợp kim Fe bị ăn mòn trước thì Fe phải có tính khử mạnh hơn Tính khử của các kim loại được sắp xếp theo chiều giảm dần : Zn > Fe > Sn > Cu → Hợp kim Cu-Fe (I) và Sn-Fe (IV) thì Fe bị ăn mòn trước Đối với cặp hợp kim Fe-C (III), anot là Fe, catot là C → Fe bị ăn mòn → Có 3 cặp hợp kim mà Fe đều bị ăn mòn là I, III, IV
Câu 11 :
Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp
Đáp án : A Lời giải chi tiết :
Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp điện phân nóng chảy
Câu 12 :
Kim loại nào dưới đây không tan trong dung dịch NaOH ?
Đáp án : D Lời giải chi tiết :
Kim loại không tan trong dung dịch NaOH là Mg. Zn và Al tan được trong dung dịch kiềm. Na tác dụng với nước trong dung dịch
Câu 13 :
Cho khí CO qua hỗn hợp T gồm Fe và Fe2O3 nung nóng thu được hỗn hợp khí B và hỗn hợp chất rắn D. Cho B qua dung dịch Ca(OH)2 dư thu được 6 gam kết tủa. Mặt khác, hòa tan hỗn hợp D bằng dung dịch H2SO4 đặc, nóng, dư thu được 0,18 mol SO2 (sản phẩm khử duy nhất) và 24 gam muối. Phần trăm số mol của Fe trong hỗn hợp T là
Đáp án : A Phương pháp giải :
+) nCaCO3 = nCO phản ứng = nCO2 Gọi nFe = x mol; nFe2O3 = y mol +) Xét toàn bộ quá trình có Fe và CO cho e; H2SO4 nhận e +)Bảo toàn e: 3nFe + 2nCO = 2nSO2 nFe2(SO4)3 = 0,06 mol +) Bảo toàn Fe: x + 2y = 0,06.2 Lời giải chi tiết :
nCaCO3 = 0,06 mol => nCO phản ứng = nCO2 = 0,06 mol Gọi nFe = x mol; nFe2O3 = y mol Xét toàn bộ quá trình có Fe và CO cho e; H2SO4 nhận e Bảo toàn e: 3nFe + 2nCO = 2nSO2 => 3x + 2.0,06 = 2.0,18 => x = 0,08 mol nFe2(SO4)3 = 0,06 mol Bảo toàn Fe: x + 2y = 0,06.2 => y = 0,02 mol $ = > \,\,\% {m_{Fe}} = \dfrac{{0,08}}{{0,08 + 0,02}}.100\% = 80\% $
Câu 14 :
Cho hỗn hợp gồm Mg (7a mol) và Fe (4a mol) vào dung dịch chứa 0,08 mol FeCl3 và 0,16 mol CuCl2, sau một thời gian thu được dung dịch X và 7,36 gam chất rắn Y. Cho dung dịch AgNO3 dư vào X, kết thúc phản ứng thu được 84,68 gam kết tủa. Nếu cho NaOH dư vào X (không có mặt oxi) thu được 24,72 gam các hiđroxit kim loại. Lấy 7,36 gam Y hòa tan trong dung dịch HNO3 loãng dư thu được 0,08 mol khí NO duy nhất và dung dịch T chứa m gam muối. Giá trị của m là
Đáp án : B Phương pháp giải :
+) Bảo toàn điện tích => \({{n}_{O{{H}^{-}}}}={{n}_{C{{l}^{-}}}}\) +) Tính mkim loại trong X +) Bảo toàn khối lượng cho kim loại => a +) \({{n}_{AgCl}}={{n}_{C{{l}^{-}}}}=>{{n}_{Ag}}\) +) Xét Y chứa những gì +) Bảo toàn electron \(=>{{n}_{N{{H}_{4}}N{{O}_{3}}}}\) => mmuối Lời giải chi tiết :
Bảo toàn điện tích => \({{n}_{O{{H}^{-}}}}={{n}_{C{{l}^{-}}}}=0,56\) => mkim loại trong X = 24,72 – 0,56.17 = 15,2 Bảo toàn khối lượng cho kim loại: 24.7a + 56.4a + 0,08.56 + 0,16.64 = 15,2 + 7,36 => a = 0,02 \({{n}_{AgCl}}={{n}_{C{{l}^{-}}}}=0,56=>{{n}_{Ag}}=0,04\) => \({{n}_{F{{e}^{2+}}}}=0,04\) => mới có 0,02 mol Mg phản ứng, Fe3+ còn dư, Fe và Cu2+ chưa phản ứng Chất rắn Y chứa: nMg = 7a – 0,04/2 = 0,12 nFe = 4a = 0,08 Y phản ứng với HNO3, bảo toàn electron: 0,12.2 + 0,08.3 \(=3.{{n}_{NO}}+8.{{n}_{N{{H}_{4}}N{{O}_{3}}}}\) \(=>{{n}_{N{{H}_{4}}N{{O}_{3}}}}=0,03\) => mmuối = 7,36 + 62.(0,12.2 + 0,08.3) + 80.0,03 = 39,52
Câu 15 :
Phản ứng nào sau đây là phản ứng điều chế kim loại bằng phương pháp nhiệt luyện
Đáp án : B Lời giải chi tiết :
A: Phương pháp thuỷ luyện B: Phương pháp nhiệt luyện C, D: Phương pháp điện phân
Câu 16 :
Cho Eo(Cu-Ag) = 0,46V và suất điện động của pin Fe - Ag là 1,24 V. Tính Eo(Fe-Cu)
Đáp án : B Phương pháp giải :
Công thức tính suất điện động của pin :Eopin = Eo(+) – Eo(-) Lời giải chi tiết :
Công thức tính suất điện động của pin :Eopin = Eo(+) – Eo(-) \( \to {E^o}_{Fe - Cu}\; = {E^o}_{C{u^{2 + }}/Cu}\,\,{\rm{ }}-{E^o}_{F{e^{2 + }}/Fe}\;{\rm{ }}\)và \({E^o}_{Cu - Ag}\; = {\rm{ }}{E^o}_{A{g^ + }/Ag}\,\,-{E^o}_{C{u^{2 + }}/Cu}\;{\rm{ }}\) \(\eqalign{ => \({E^o}_{Fe - Cu} = E_{Fe - Ag}^0 - E_{Cu - Ag}^0\)= 1,24 – 0,46 = 0,78 V
Câu 17 :
Cho dung dịch Mg(NO3)2 có lẫn tạp chất là dung dịch AgNO3. Hóa chất có thể dùng để loại bỏ tạp chất là
Đáp án : D Phương pháp giải :
KL mạnh đẩy KL yếu ra khỏi dung dịch muối Lời giải chi tiết :
A sai vì Ag không phản ứng với tạp chất B sai vì Zn phản ứng được với AgNO3, dung dịch thu được lẫn Zn(NO3)2 C sai vì Fe phản ứng được với AgNO3 nhưng dung dịch thu được lẫn Fe(NO3)2 D đúng vì Mg phản ứng được với AgNO3 nhưng dung dịch thu được chỉ gồm Mg(NO3)2 Mg + 2AgNO3 →Mg(NO3)2 + 2Ag
Câu 18 :
Bạc là kim loại được dùng phổ biến để tạo trang sức là vì :
Đáp án : D Lời giải chi tiết :
Kim loại dùng để tạo trang sức, vì ngoài là kim loại sáng, đẹp, không bị oxi hóa,nó còn có tác dụng bảo vệ sức khỏe là bạc
Câu 19 :
Cho các kim loại: K, Al, Mg, Na, Ba. Số kim loại có thể tác dụng với nước ở điều kiện thường tạo ra dung dịch làm xanh giấy quỳ tím là
Đáp án : B Lời giải chi tiết :
Kim loại có thể tác dụng với nước ở điều kiện thường tạo ra dung dịch làm xanh giấy quỳ tím là Ba, K, Na
Câu 20 :
Phương trình hóa học nào sau đây không biểu diễn PTHH của phản ứng điều chế kim loại bằng phương pháp điện phân?
Đáp án : D Phương pháp giải :
xem lại lí thuyết điều chế kim loại Lời giải chi tiết :
D là phương pháp thủy luyện
Câu 21 :
Dung dịch Cu(NO3)2 có lẫn tạp chất AgNO3 .Phương pháp hoá học đơn giản để loại được tạp chất là
Đáp án : C Phương pháp giải :
xem lại lí thuyết điều chế kim loại Lời giải chi tiết :
Phương pháp hoá học đơn giản để loại được tạp chất là cho Cu dư vào dung dịch, sau khi phản ứng xong lọc bỏ chất rắn. Vì Cu loại bỏ được muối AgNO3 theo PTHH: Cu + AgNO3→ Cu(NO3)2 +Ag
Câu 22 :
Cho Fe phản ứng với dung dịch H2SO4 đặc, sau phản ứng thu được khí mùi trứng thối. Khí đó là
Đáp án : B Lời giải chi tiết :
Khí mùi trứng thối là H2S (xem lại phần lí thuyết kim loại tác dụng với axit có tính oxi hóa)
Câu 23 :
Cho 9,75 gam Zn tan hoàn toàn trong dung dịch HNO3 loãng, sau phản ứng thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V là
Đáp án : A Phương pháp giải :
bảo toàn e Lời giải chi tiết :
\(Zn \to \mathop {Zn}\limits^{ + 2} + 2e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} O\) 0,15 → 0,3 0,3 →0,1 => VN2O = 0,1.22,4 = 2,24 lít
Câu 24 :
Cho các kim loại: Na, Ca, Zn, Mg, Fe, Cu, Cr, Ag, Al, Pb. Số kim loại điều chế được bằng phương pháp nhiệt luyện là:
Đáp án : A Phương pháp giải :
xem lại lí thuyết điều chế kim loại Lời giải chi tiết :
Phương pháp nhiệt luyện dùng để điều chế các kim loại đứng sau Al : Zn, Fe, Cu, Cr, Ag, Pb
Câu 25 :
Cho các mệnh đề sau, số mệnh đề đúng là: 1, Fe khử được Cu2+ trong dung dịch. 2, Fe3+ có tính oxi hóa mạnh hơn Cu2+. 3, Fe2+ oxi hoá được Cu. 4, Tính oxi hóa của các ion tăng theo thứ tự: Fe2+, H+, Cu2+, Ag+. Số mệnh đề đúng là
Đáp án : C Lời giải chi tiết :
1, đúng vì: Fe + Cu2+ → Fe2+ + Cu 2, đúng vì Cu + 2Fe3+ → Cu2+ + 2Fe2+ 3, sai vì Fe2+ không phản ứng được với Cu 4, đúng
Câu 26 :
Cho hỗn hợp bột Mg, Al vào dung dịch chứa Fe(NO3)2 và Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn gồm ba kim loại là:
Đáp án : B Phương pháp giải :
Hỗn hợp rắn gồm 3 kim loại là 3 kim loại có tính khử yếu nhất Lời giải chi tiết :
Thứ tự các chất trong dãy điện hóa: Thứ tự các chất trong dãy điện hóa: \({{M{g^{2 + }}} \over {Mg}};{{A{l^{3 + }}} \over {Al}};{{F{e^{2 + }}} \over {Fe}};{{C{u^{2 + }}} \over {Cu}};{{F{e^{3 + }}} \over {F{e^{2 + }}}}\) Hỗn hợp rắn gồm 3 kim loại là 3 kim loại có tính khử yếu nhất: Fe, Cu, Al
Câu 27 :
Trong các phát biểu sau, phát biểu đúng là?
Đáp án : A Lời giải chi tiết :
Nguyên tắc: Mn+ +ne →M
Câu 28 :
Phát biểu nào sau đây là đúng?
Đáp án : D Phương pháp giải :
xem lại lí thuyết ăn mòn kim loại Lời giải chi tiết :
“Ăn mòn kim loại” là sự phá huỷ kim loại do tác dụng hoá học của môi trường xung quanh.
Câu 29 :
Khi cho Fe vào dung dịch hỗn hợp các muối AgNO3, Cu(NO3)2, Pb(NO3)2 thì Fe sẽ khử ion kim loại theo thứ tự sau (ion đặt trước sẽ bị khử trước):
Đáp án : A Phương pháp giải :
Ghi nhớ dãy điện hóa học của kim loại Fe sẽ khử cation kim loại mà kim loại của nó có tính khử yếu trước
Lời giải chi tiết :
Thứ tự khử: Fe khử Ag+, Cu2+ rồi đến Pb2+
Câu 30 :
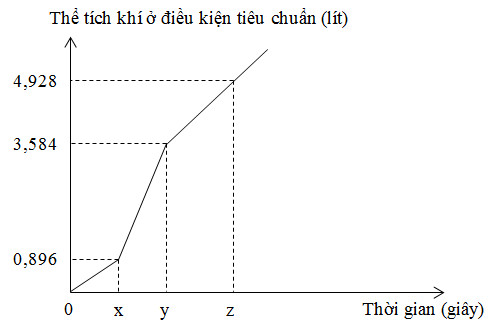
Điện phân dung dịch X chứa KCl và CuSO4 bằng dòng điện một chiều có cường độ 5A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch). Toàn bộ khí sinh ra trong quá trình điện phân (ở cả hai điện cực) theo thời gian được biểu diễn bằng đồ thị bên.
Phát biểu nào sau đây đúng?
Đáp án : B Phương pháp giải :
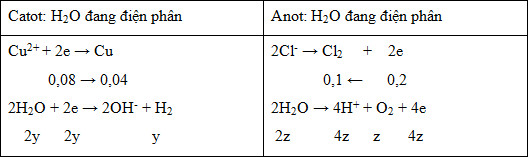
Ta thấy đoạn đồ thị thứ 2 dốc hơn đoạn 1 nên suy ra Cu2+ điện phân hết trước Cl- (đoạn 1 khí là Cl2; đoạn 2 khí là Cl2 và H2; đoạn 3 khí là H2 và O2) Viết các phản ứng điện phân ở các điện cực từ đó xác định được số mol của các chất ban đầu. Lời giải chi tiết :
Ta thấy đoạn đồ thị thứ 2 dốc hơn đoạn 1 nên suy ra Cu2+ điện phân hết trước Cl- (đoạn 1 khí là Cl2; đoạn 2 khí là Cl2 và H2; đoạn 3 khí là H2 và O2) + Tại x giây: n khí = 0,896 : 22,4 = 0,04 mol
=> nCuSO4 bđ = 0,04 mol + Tại y giây: n khí = 3,584 : 22,4 = 0,16 mol
=> n khí = nH2 + nCl2 => x + x + 0,04 = 0,16 => x = 0,06 mol => nCl- = 2x + 0,08 = 0,2 mol => nKCl bđ = 0,2 mol Xét các phương án: + A sai vì nCuSO4 : nKCl = 0,04 : 0,2 = 1 : 5 + B đúng vì Cu2+ điện phân hết trước Cl-: CuSO4 + 2KCl → Cu + Cl2 + K2SO4 2KCl + 2H2O → 2KOH + Cl2 + H2 + C sai vì: Tại 2x giây, ne(2x giây) = 2.ne(x giây) = 0,16 mol
=> V khí = (0,04+0,08).22,4 = 2,688 lít + D sai vì: Tại z giây:
BTe: 0,08 + 2y = 0,2 + 4z n khí = y + 0,1 + z = 4,928/22,4 Giải hệ thu được y = 0,1 và z = 0,02 => m dd giảm = mCu + mH2 + mCl2 + mO2 = 0,04.64 + 0,1.2 + 0,1.71 + 0,02.32 = 10,5 gam |






















Danh sách bình luận