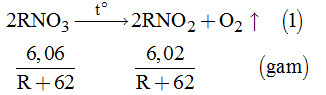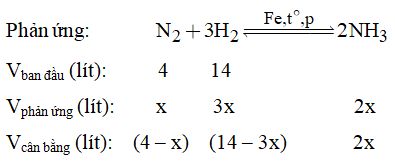Đề kiểm tra 1 tiết (45 phút) - Đề số 1 - Chương II - Hóa học 11Đáp án và lời giải chi tiết Đề kiểm tra 1 tiết (45 phút) - Đề số 1 - Chương II - Hóa học 11. Quảng cáo
Đề bài I. PHẦN TRẮC NGHIỆM Câu 1. Dãy nào sau đây được sắp xếp theo chiều tăng dần số oxi hóa của nitơ? \(\begin{array}{l}A.NO < {N_2}O < N{H_3} < NO_3^ - < N{O_2}\\B.NH_4^ + < {N_2} < {N_2}O < NO < N{O_2}\\C.N{H_3} < {N_2} < N{O_2} < NO < {N_2}O\\D.N{H_3} < NO < {N_2}O < N{O_2} < {N_2}{O_5}\end{array}\) Câu 2. Một bình kín dung tích 0,5 lít có chứa 0,5 mol H2 và 0,5 mol N2. Khi phản ứng đạt trạng thái cân bằng thấy có 0,02 mol NH3. Hằng số cân bằng của phản ứng tổng hợp NH3 là: A.0,00197 B.0,00170 C.0,00500 D.0,00350 Câu 3. Trong số các phân tử sau: NCl3, NO, NF3 và NH3 phân tử phân cực mạnh nhất là: A.NCl3 B.NO C.NH3 D.NF3 Câu 4. Cộng hóa trị của nitơ trong các hợp chất nào sau đây lớn nhất? A.NH4Cl B.HNO2 C.HNO3 D.NH4Cl và HNO3 Câu 5. Một nguyên tố R có cấu hình electron: 1s22s22p3, công thức hợp chất với hiđro và công thức oxit cao nhất nào sau đây là đúng? A.RH3 và R2O3 B.RH3 và R2O5 C.RH4 và RO2 D.RH2 và RO Câu 6. Sản phẩm của phản ứng nhiệt phân KNO3 là gì? A.KNO2 và O2 B.K2O, NO2 và O2 C.K2O và N2 D.K, NO2 và O2 Câu 7. Chất nào sau đây có thể làm khô khí NH3? A.H2SO4 đặc B.CuSO4 khan C.HCl D.CaO Câu 8. Cho hỗn hợp bột kim loại gồm Cu và Fe vào dung dịch HNO3 loãng, nguội dư được dung dịch (X) . Cho dung dịch NaOH vào dung dịch (X) thu được kết tủa (Y). Kết tủa (Y) gồm những chất nào sau đây? \(\begin{array}{l}A.Fe{\left( {OH} \right)_3};Cu{\left( {OH} \right)_2}\\B.Fe{\left( {OH} \right)_2};Cu{\left( {OH} \right)_2}\\C.Fe{\left( {OH} \right)_2}\\D.Fe{\left( {OH} \right)_2};Fe{\left( {OH} \right)_3}\end{array}\) II. PHẦN TỰ LUẬN Câu 9. Hỗn hợp X gồm 2 khí N2 và H2 theo tỉ lệ mol là 1 : 4. Nung nóng X với xúc tác thu được hỗn hợp khí Y, trong đó NH3 chiếm 20% thể tích. Tính hiệu suất của phản ứng trên. Câu 10. Tiến hành nung 6,06 gam muối nitrat của một kim loại kiềm thu được 5,1 gam muối nitrit. Hỏi muối nitrat đem phân hủy của kim loại là gì? Câu 11. Nén hỗn hợp gồm 4 lít khí nitơ và 14 lít hiđro trong bình phản ứng ở nhiệt độ và xúc tác thích hợp. Sau phản ứng, thu được 16,4 lít hỗn hợp khí. Hãy tính thể tích khí amoniac thu được. Biết các thể tích được đo ở cùng nhiệt độ và áp suất. Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
Câu 1: \(\mathop N\limits^{ - 3} {H_4}^ + < {\mathop N\limits^0 _2} < {\mathop N\limits^{ + 1} _2}O < \mathop N\limits^{ + 2} O < \mathop N\limits^{ + 4} {O_2}\) Đáp án B Câu 2: Ta có phương trình hóa học: N2 + 3H2 ↔ 2NH3 Ban đầu 0,5 0,5 Phản ứng 0,01 0,03 0,02 Sau pư 0,49 0,47 0,02 Hằng số cân bằng của phản ứng tổng hợp NH3 là: \(\frac{{{{(0,02:0,5)}^2}}}{{(0,49:0,5).{{(0,47:0,5)}^3}}} = 0,00197\) Đáp án A Câu 3: Đáp án D Câu 4: N trong HNO3 có số OXH là +5 nên HNO3 là chất có chứa N có số OXH lớn nhất NH4Cl chứa N có số OXH là -3 HNO2 chứa N có số OXH là +3 Đáp án C Câu 5: R thuộc nhóm VA => Công thức oxit cao nhất là R2O5 và công thức hợp chất với hidro là RH3 Đáp án B Câu 6: KNO3 → KNO2 + ½ O2 Đáp án A Câu 7: Chất có thể làm khô NH3 là chất có khả năng hút nước, nhưng không tác dụng với NH3 Đáp án D Câu 8 Ta có sơ đồ phản ứng: \(\left\{ \begin{array}{l}Cu\\Fe\end{array} \right. + HN{O_3} \to \mathop {\left\{ \begin{array}{l}Cu{(N{O_3})_2}\\Fe{(N{O_3})_3}\end{array} \right.}\limits_X + NaOH \to \mathop {\left\{ \begin{array}{l}Cu{(OH)_2}\\Fe{(OH)_3}\end{array} \right.}\limits_Y \) Đáp án A II. PHẦN TỰ LUẬN Câu 9. Phản ứng: \({N_2} + 3{H_2} \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2N{H_3}\) Ban đầu: 1 4 mol Phản ứng: x 3x 2x mol Cân bằng (1- x) (4 - 3x) 2x mol Ta có: \(\dfrac{{2x}}{{\left( {1 - x} \right) + \left( {4 - 3x} \right) + 2x}} \times 100 = 20\) \(\Rightarrow x = \dfrac{1}{{2,4}}\) Hiệu suất: \(H = \dfrac{{2 \times \dfrac{1}{{2,4}}}}{2} \times 100\% = 41,67\% \) Câu 10. Gọi công thức muối nitrat của hai kim loại kiềm là: RNO3 Cách 1. \(\begin{array}{l}RN{O_3} \to RN{O_2} + \frac{1}{2}{O_2} \uparrow {\rm{ }}\left( 1 \right)\\\left( {R + 62} \right){\rm{ }}\left( {R + 46} \right){\rm{ }}\left( {gam} \right)\\6,06{\rm{ \;\;\;\;\;\;\;\;\;\;\;\; 5,1 }}\left( {gam} \right)\end{array}\) Lập tỉ lệ: \(\begin{array}{l}\dfrac{{R + 62}}{{6,06}} = \dfrac{{R + 46}}{{5,1}}\\ \Leftrightarrow 5,1R + 316,2 = 6,06R + 278,76\\ \Rightarrow R = \dfrac{{37,44}}{{0,96}} = 39:Kali\left( K \right)\end{array}\) Vậy công thức muối nitrat là KNO3. Cách 2. Theo đề bài, khi nung 6,06 gam muối nitrat tạo thành 5,1 gam muối nitrat, tức là giải phóng \(6,06 - 5,1 = 0,96\left( {gam} \right)\) oxi hay \(\dfrac{{0,96}}{{32}} = 0,03\left( {mol} \right){O_2}\) Từ (1) \(\begin{array}{l} \Rightarrow {n_{RN{O_3}}} = 0,06\left( {mol} \right)\\ \Rightarrow {M_{RN{O_3}}} = \dfrac{{6,06}}{{0,06}} = 101\\ \Rightarrow R + 62 = 101 \Rightarrow R = 39\left( {Kali} \right)\end{array}\) Vậy muối nitrat đem phân hủy là: KNO3. Cách 3. Theo đề bài, khối lượng oxi được giải phóng là: \(6,06 - 5,1 = 0,96\left( {gam} \right)\). Vậy 0,96 gam O2 được giải phóng từ 2(R + 62) gam nitrat Do đó: \(\begin{array}{l}\dfrac{{6,06}}{{2\left( {R + 62} \right)}} = \dfrac{{0,96}}{{32}}\\ \Leftrightarrow 2R = \dfrac{{6,06 \times 32}}{{0,96}} - 124\\ \Rightarrow R = \dfrac{{202 - 124}}{2} = 39:Kali\left( K \right)\end{array}\) Vậy muối nitrat đem dùng là: KNO3. Cách 4. Ta có: \({n_{RN{O_3}}} = \dfrac{{6,06}}{{R + 62}}\left( {mol} \right)\)
Từ (1) và đề bài \( \Rightarrow {n_{RN{O_3}}} = \dfrac{{6,06}}{{R + 62}} \times \left( {R + 46} \right) = 5,1 \) \(\Rightarrow R = 39:Kali\left( K \right).\) Câu 11.
Tổng thể tích sau phản ứng: \(18 - 2x = 16,4 \Rightarrow x = 0,8 \) \(\Rightarrow {V_{N{H_3}}} = 1,6\left( l \right)\). Loigiaihay.com
|