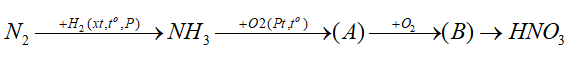Trắc nghiệm Bài 3: Đơn chất nitrogen Hóa 11 Chân trời sáng tạoĐề bài
Câu 1 :
Trong không khí chứa chủ yếu hai khí nào sau đây?
Câu 2 :
Ở nhiệt độ thường, khí N2 khá trơ về mặt hóa học. Nguyên nhân là do:
Câu 3 :
Cấu hình electron nguyên tử của Nitrogen là:
Câu 4 :
Vị trí của nitrogen (N) trong bảng hệ thống tuần hoàn là:
Câu 5 :
Ứng dụng nào sau đây không phải của Nitrogen?
Câu 7 :
\({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\) Biết \({E_{H - H}} = 436kJ/mol\); \({E_{N - H}} = 389kJ/mol\); \({E_{N \equiv N}} = 946kJ/mol\) Tính biến thiên enthalpy của phản ứng tổng hợp ammonia
Câu 8 :
Hỗn hợp X gồm N2 và H2 có MX = 12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. MY có giá trị là :
Câu 9 :
Dãy các chất nào sau đây trong đó nitrogen có số oxi hóa tăng dần?
Câu 10 :
Mệnh đề nào dưới đây là không đúng?
Câu 11 :
Nitrogen là chất khí phổ biến tron khí quyển Trái Đất và được sử dụng chủ yếu để sản xuất Ammonia. Số oxi hóa của nguyên tố N trong phân tử N2 là?
Câu 12 :
Số oxi hóa của nitrogen trong hợp chất nào sau đây là lớn nhất ?
Câu 13 :
Một hỗn hợp gồm hai khí H2 và N2 theo tỉ lệ mol là 4: 1. Nung với xúc tác ở nhiệt độ cao thu được hỗn hợp khí Y, trong đó NH3 chiếm 20% thể tích. Hiệu suất của phản ứng trên là?
Câu 14 :
Tìm câu SAI trong các phát biểu sau?
Câu 15 :
Căn cứ vào tính chất vật lí nào sau đây để tách khí Nitrogen ra khỏi không khí?
Câu 16 :
Hỗn hợp khi X gồm N2 và H2 có tỉ khối hơi so với He bằng 1,8. Đun nóng trong bình kín một thời gian (có bột Fe làm xúc tác) thu được hỗn hợp khí Y có tỉ khối hơn so với He bằng 2. Hiệu suất phản ứng tổng hợp NH3 là
Câu 17 :
Khi có tia lửa điện hoặc ở nhiệt độ cao, nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. Công thức của X là
Câu 18 :
Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là:
Câu 19 :
Nitrogen có số oxi hóa âm trong hợp chất với nguyên tố nào sau đây ?
Câu 20 :
Người ta sản xuất khi nitrogen trong công nghiệp bằng cách nào sau đây?
Lời giải và đáp án
Câu 1 :
Trong không khí chứa chủ yếu hai khí nào sau đây?
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về Trạng thái tự nhiên nitrogen. Lời giải chi tiết :
Không khí chứa 78,1% thể tích là N2, oxi chiếm 20,9% thể tích, 1% là hơi nước và các khí khác
Câu 2 :
Ở nhiệt độ thường, khí N2 khá trơ về mặt hóa học. Nguyên nhân là do:
Đáp án : A Phương pháp giải :
Dựa vào kiến thức về Cấu tạo phân tử nitrogen. Lời giải chi tiết :
Phân tử nitrogen gồm hai nguyên tử liên kết với nhau bởi một liên kết ba. Phân tử nitrogen có năng lượng liên kết lớn (945 kJ/mol) và không có cực => Rất bền và trơ về mặt hóa học
Câu 3 :
Cấu hình electron nguyên tử của Nitrogen là:
Đáp án : D Phương pháp giải :
Dựa vào kiến thức về Cấu tạo nguyên tử nitrogen. Lời giải chi tiết :
Nguyên tử nitrogen có 7 electron =>Cấu hình electron: 1s22s22p3
Câu 4 :
Vị trí của nitrogen (N) trong bảng hệ thống tuần hoàn là:
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về Cấu tạo nguyên tử nitrogen. Lời giải chi tiết :
Nguyên tố nitrogen ở ô số 7, nhóm VA, chu kỳ 2 trong bảng tuần hoàn.
Câu 5 :
Ứng dụng nào sau đây không phải của Nitrogen?
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về Ứng dụng của nitrogen. Lời giải chi tiết :
Nitrogen có nhiều ứng dụng trong các ngành sản xuất hóa chất, bảo quản thực phẩm, dược phẩm, mẫu vật phẩm y tế,...
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về Tính chất hóa học của nitrogen. Lời giải chi tiết :
A phản ứng với O2 tạo ra chất B Chất B phản ứng với H2O tạo HNO3 => B là NO2 => A là NO \(2NO + {O_2} \to 2N{O_2}\) => (B) là NO2
Câu 7 :
\({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\) Biết \({E_{H - H}} = 436kJ/mol\); \({E_{N - H}} = 389kJ/mol\); \({E_{N \equiv N}} = 946kJ/mol\) Tính biến thiên enthalpy của phản ứng tổng hợp ammonia
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về công thức tính enthalpy chuẩn dựa vào năng lượng liên kết Lời giải chi tiết :
Ta có: \({\Delta _r}H_{298}^0 = \sum {{E_{C{\rm{D}}}} - \sum {{E_{SP}}} } \)= 946.1 + 3.436– 6.389 = -80(J)
Câu 8 :
Hỗn hợp X gồm N2 và H2 có MX = 12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. MY có giá trị là :
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về Tính chất hóa học nitrogen. Lời giải chi tiết :
Xét 1 mol hỗn hợp gồm a mol N2 và b mol H2: a + b = 1 (1) a.28 + b.2 = 12,4 (2) Từ (1) và (2) => a = 0,4 và b = 0,6 N2 + 3H2 → 2NH3 Trước: 0,4 0,6 Pư: x 3x 2x (CB) 0,4-x 0,6-3x 2x Hiệu suất của phản ứng: H=\(\frac{{3x}}{{0,6}}.100\% \)= 40% => x = 0,08 nY = 1 – 2x = 1-2.0,08=0,84 mol => MY = \(\frac{{12,4}}{{0,84}}\)= 14,76 (g/mol)
Câu 9 :
Dãy các chất nào sau đây trong đó nitrogen có số oxi hóa tăng dần?
Đáp án : A Phương pháp giải :
Dựa vào kiến thức về Cấu tạo nguyên tử nitrogen. Lời giải chi tiết :
\(\mathop N\limits^{ - 3} {H_4}Cl,{\rm{ }}{\mathop N\limits^{ + 1} _2}O,{\rm{ }}{\mathop N\limits^{ + 3} _2}{O_3},{\rm{ }}\mathop N\limits^{ + 4} {O_2},{\rm{ }}H\mathop N\limits^{ + 5} {O_3}\)
Câu 10 :
Mệnh đề nào dưới đây là không đúng?
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về Cấu tạo nguyên tử nitrogen. Lời giải chi tiết :
Trong cùng một nhóm, theo chiều tăng điện tích hạt nhân tính kim loại tăng dần => Ý C sai.
Câu 11 :
Nitrogen là chất khí phổ biến tron khí quyển Trái Đất và được sử dụng chủ yếu để sản xuất Ammonia. Số oxi hóa của nguyên tố N trong phân tử N2 là?
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về Cấu tạo nguyên tử nitrogen. Lời giải chi tiết :
Nitrogen có số oxi hóa là 0: (\(\mathop {{N_2}}\limits^0 \))
Câu 12 :
Số oxi hóa của nitrogen trong hợp chất nào sau đây là lớn nhất ?
Đáp án : D Phương pháp giải :
Dựa vào kiến thức về Cấu tạo nguyên tử nitrogen. Lời giải chi tiết :
Nitrogen có số oxi hóa cao nhất trong hợp chất HNO3 (\(\mathop {HN}\limits^{ + 5} {O_3}\))
Câu 13 :
Một hỗn hợp gồm hai khí H2 và N2 theo tỉ lệ mol là 4: 1. Nung với xúc tác ở nhiệt độ cao thu được hỗn hợp khí Y, trong đó NH3 chiếm 20% thể tích. Hiệu suất của phản ứng trên là?
Đáp án : A Phương pháp giải :
Dựa vào kiến thức về Tính chất hóa học nitrogen. Lời giải chi tiết :
Xét 1 mol hỗn hợp gồm 0,2 mol N2 và 0,8 mol H2: N2 + 3H2 → 2NH3 Trước: 0,2 0,8 Pư: x 3x 2x (CB) 0,2-x 0,8-3x 2x nY = 1 – 2x NH3 chiếm 20% thể tích => \(\frac{{2x}}{{1 - 2x}}\).100 = 20 => x = 1/12 Hiệu suất của phản ứng: H=\(\frac{{1/12}}{{0,2}}.100\% \)= 41,67%
Câu 14 :
Tìm câu SAI trong các phát biểu sau?
Đáp án : A Phương pháp giải :
Dựa vào kiến thức về Cấu tạo nguyên tử nitrogen. Lời giải chi tiết :
Nitrogen có số oxi hóa dương trong những hợp chất với nguyên tố O
Câu 15 :
Căn cứ vào tính chất vật lí nào sau đây để tách khí Nitrogen ra khỏi không khí?
Đáp án : D Phương pháp giải :
Dựa vào kiến thức về Tính chất vật lý nitrogen. Lời giải chi tiết :
Nitrogen là chất khí khó hóa lỏng, hóa lỏng ở -196℃. Còn oxygen hóa lỏng ở -183℃.
Câu 16 :
Hỗn hợp khi X gồm N2 và H2 có tỉ khối hơi so với He bằng 1,8. Đun nóng trong bình kín một thời gian (có bột Fe làm xúc tác) thu được hỗn hợp khí Y có tỉ khối hơn so với He bằng 2. Hiệu suất phản ứng tổng hợp NH3 là
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về Tính chất hóa học nitrogen. Lời giải chi tiết :
MX = 4.1,8 = 7,2 Xét 1 mol hỗn hợp gồm a mol N2 và b mol H2: a + b = 1; 28a + 2b = 7,2 ⇒ a = 0,2; b = 0,8 (mol) N2 + 3H2 → 2NH3 nY = 1 – 2a Mà MY = 4.2 = 8; mY = mX = 7,2 ⇒ nY = 0,9 = 1 – 2a ⇒ a = 0,05 (mol). Vậy H = (0,05/0,2). 100% = 25%
Câu 17 :
Khi có tia lửa điện hoặc ở nhiệt độ cao, nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. Công thức của X là
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về Tính chất hóa học nitrogen. Lời giải chi tiết :
Ở nhiệt độ cao trên 3000℃ hoặc có tia lửa điện, nitrogen kết gợp với oxygen, tạo ra nitrogen monoxide (NO)
Câu 18 :
Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là:
Đáp án : D Phương pháp giải :
Dựa vào kiến thức về Tính chất hóa học nitrogen. Lời giải chi tiết :
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Trước pư: 0,5 0,5 Pư: 0.1 0,3 <- 0,2 (CB) 0,4 0,2 0,2 Ta có: \({K_C} = \frac{{{{{\rm{(N}}{{\rm{H}}_{\rm{3}}}{\rm{)}}}^2}}}{{{{{\rm{(}}{H_2})}^3}({N_2}{\rm{)}}}}\) Thay các giá trị ((N2)) = 0,8M; (H2) = (NH3) = 0,4M Vậy \({K_C} = \frac{{{{{\rm{(0,4)}}}^2}}}{{{{{\rm{(0,4}})}^3}.0,8}}\)= 3,125
Câu 19 :
Nitrogen có số oxi hóa âm trong hợp chất với nguyên tố nào sau đây ?
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về Cấu tạo nguyên tử nitrogen. Lời giải chi tiết :
Nitrogen có số oxi hóa âm trong hợp chất với nguyên tố H (\(\mathop N\limits^{ - 3} {H_3}\))
Câu 20 :
Người ta sản xuất khi nitrogen trong công nghiệp bằng cách nào sau đây?
Đáp án : A Phương pháp giải :
Dựa vào kiến thức về Trạng thái tự nhiên nitrogen. Lời giải chi tiết :
Trong công nghiệp, khí N2 được điều chế bằng phương pháp chưng cất phân đoạn không khí lỏng.
|