Lý thuyết hợp chất của cacbon1. CO là chất khí không màu Quảng cáo
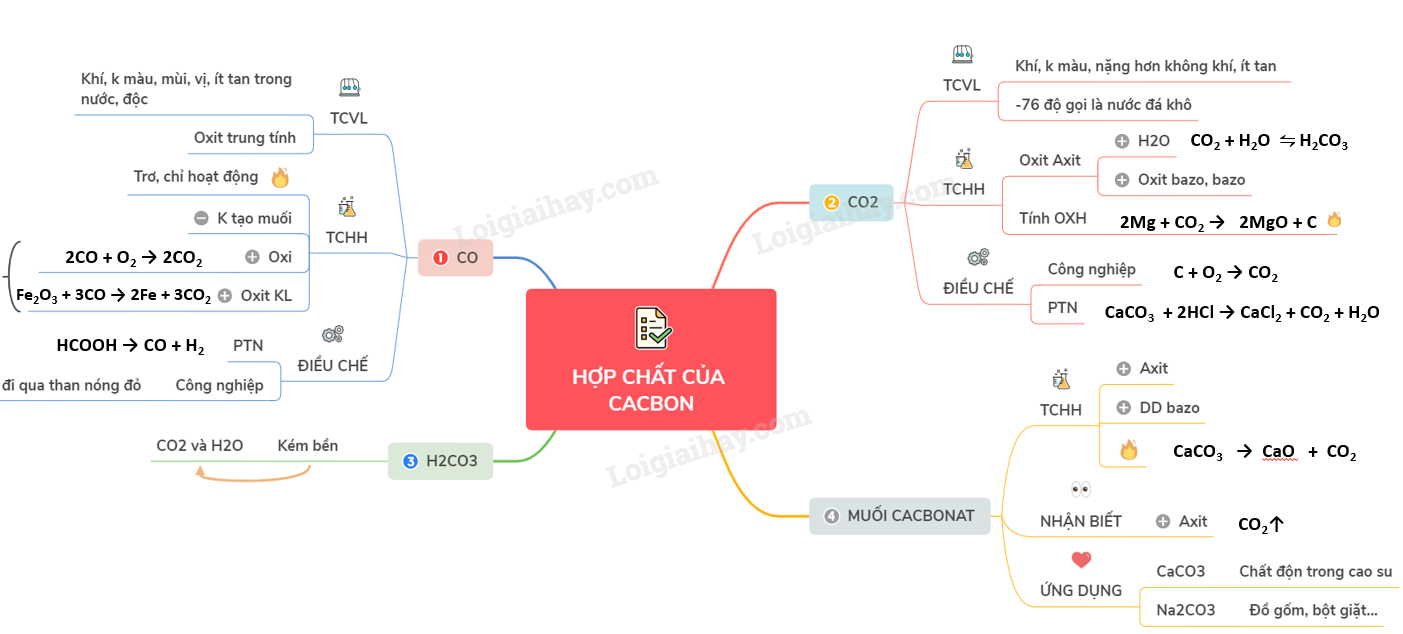
A. CACBON MONOXIT I. TÍNH CHẤT VẬT LÍ - CO là chất khí không màu, không mùi, không vị, ít tan trong nước, bền với nhiệt và rất độc. - Kém hoạt động ở nhiệt độ thường, hoạt động nhiều hơn khi đun nóng - CO là oxit trung tính II. TÍNH CHẤT HÓA HỌC - Phân tử CO có liên kết ba bền vững nên ở nhiệt độ thường C rất trơ, chỉ hoạt động trong điều kiện nhiệt độ cao. - CO là oxit trung tính không có khả năng tạo muối → không tác dụng với dung dịch bazơ và dung dịch axit ở nhiệt độ thường. 1. Tính khử mạnh - Tác dụng với oxi: cho ngọn lửa màu lam nhạt 2CO + O2 \(\xrightarrow{{{t}^{o}}}\) 2CO2 - Tác dụng với oxit kim loại: Fe2O3 + 3CO \(\xrightarrow{{{t}^{o}}}\) 2Fe + 3CO2 2. Cacbon monoxit là oxit không tạo muối III. ĐIỀU CHẾ 1. Trong phòng TN HCOOH \(\xrightarrow{{{H_2}S{O_4}d,{t^{^o}}}}\) CO + H2 2. Trong công nghiệp Cho hơi nước đi qua than nóng đỏ thu được khí than ướt B. CACBON ĐIOXIT I. TÍNH CHẤT VẬT LÍ - CO2 là chất khí, không màu nặng hơn không khí, ít tan trong nước. - Làm lạnh đột ngột ở -76oC, khí CO2 hóa thành khối rắn gọi là “nước đá khô”. - Nước đá khô không nóng chảy mà thăng hoa. II. TÍNH CHẤT HÓA HỌC 1. Tính chất của oxit axit - Tác dụng với nước tạo thành dung dịch axit yếu. CO2 (k) + H2O (l) ⇋ H2CO3 (dd) - Tác dụng với oxit bazơ, bazơ tạo thành muối. CO2 + NaOH → NaHCO3 2NaOH + CO2 → Na2CO3 + H2O CaO + CO2 → CaCO3 (tº) 2. Tính OXH (Khi tác dụng với chất có tính khử mạnh) 2Mg + CO2 \(\xrightarrow{{{t}^{o}}}\) 2MgO + C III. ĐIỀU CHẾ 1. Trong công nghiệp C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí) CaCO3 → CaO + CO2 (1000ºC) 2. Trong phòng thí nghiệm CaCO3 + 2HCl → CaCl2 + CO2 + H2O C. AXIT CACBONIC VÀ MUỐI CACBONAT I. AXIT CACBONIC - Là axit kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân hủy thành CO2 và H2O. - Là axit hai nấc, trong dung dịch phân li hai nấc. H2CO3 ⇋ H+ + HCO3- HCO3- ⇋ H+ + CO32- II. MUỐI CACBONAT - Muối cacbonat của kim loại kiềm, amoni và đa số các muối hidrocacbonat đều tan tốt trong nước - Muối cacbonat của các kim loại còn lại không tan, muối hidrocacbonat kếm bền nên dễ bị nhiệt phân 1. Tính chất hóa học a) Tác dụng với axit: CaCO3 + 2HCl → CaCl2 + CO2 + H2O NaHCO3 + HCl → NaCl + CO2 + H2O b) Tác dụng với dung dịch bazo: NaHCO3 + NaOH → Na2CO3 + H2O c) Phản ứng nhiệt phân: 2NaHCO3 → Na2CO3 + CO2 + H2O CaCO3 → CaO + CO2 2. Nhận biết Cho tác dụng với axit → CO2 CaCO3 + 2HCl → CaCl2 + CO2 + H2O 3. Tính chất và ứng dụng của một số muối cacbonat - Canxi cacbonat (CaCO3) tinh khiết là chất bột nhẹ, màu trắng, dùng làm chất dộn trong cao su và 1 số ngành công nghiệp. - Natricacbonat (Na2CO3) khan (sođa khan) là chất bột màu trắng, tan nhiều trong nước. Dùng trong công ngiệp thủy tinh, đồ gốm, bột giặt, … Sơ đồ tư duy: Hợp chất của cacbon
Loigiaihay.com
|




















Danh sách bình luận