Ôn tập chương 7 trang 83, 84 SBT Hóa 10 Chân trời sáng tạoCấu hình electron nào của nguyên tử halogen? Dung dịch AgNO3 không tác dụng với dung dịch. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
7.1 Cấu hình electron nào của nguyên tử halogen? A. 1s22s22p6. B. 1s22s22p63s2. C. 1s22s22p63s23p5. D. 1s22s22p63s23p64s23d7. Phương pháp giải: Dựa vào các nguyên tử halogen thuộc nhóm VIIA -> Có 7 electron ở lớp ngoài cùng Lời giải chi tiết: - Đáp án: C 7.2 Dung dịch AgNO3 không tác dụng với dung dịch. A. NaI. B. NaF. C. NaCl. D. NaBr Phương pháp giải: Dựa vào tính tan của các muối halide với ion Ag+ Lời giải chi tiết: - Đáp án: B - Giải thích: Do AgF là một muối tan
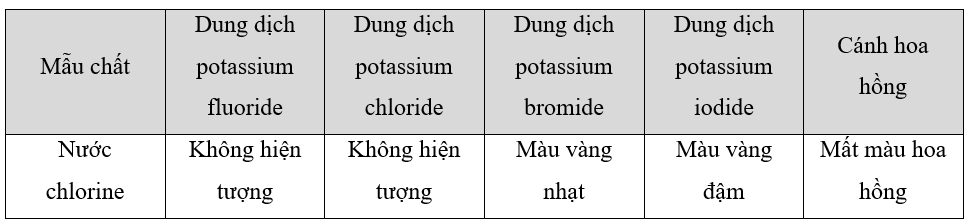
7.3 Phương trình hoá học nào viết sai? A. Br2 + Cu → CuBr2 B. 2HCl + Na2CO3 → 2NaCl + H2O + CO2 C. NaBr + AgNO3 → AgBr + NaNO3 D. Cl2 + Fe → FeCl2 Phương pháp giải: A. Tính oxi hóa của Br2 B. Tính acid của HCl C. Tính tan của muối Br- D. Tính oxi hóa của Cl2 Lời giải chi tiết: - Đáp án: D - Giải thích: Cl2 có tính oxi hóa mạnh, sẽ oxi hóa Fe từ 0 lên Fe có số oxi hóa +3 3Cl2 + 2Fe → 2FeCl3 7.4 Nước chlorine có tính tẩy màu là do: A. HCl có tính acid mạnh. B. Cl2 vừa có tính khử vừa có tính oxi hoá. C. HClO có tính oxi hoá mạnh. D. Cl2 có tính oxi hoá mạnh. Phương pháp giải: Dựa vào thành phần có trong nước chlorine và tính oxi hóa của các thành phần có trong nước chlorine Lời giải chi tiết: - Ta có: Cl2 + H2O HCl + HClO - Trong thành phần của nước chlorine, HClO là một chất có tính oxi hóa mạnh => Đáp án: C 7.5 Halogen không có tính khử là A. fluorine. B. bromine. C. iodine. D. chlorine. Phương pháp giải: - Fluorine chỉ có tính oxi hóa - Chlorine, Bromine và Iodine vừa có tính oxi hóa, vừa có tính khử Lời giải chi tiết: - Đáp án: A, do fluorine có độ âm điện lớn nhất nên trong hợp chất, fluorine luôn có số oxi hóa -1 => Chỉ mang tính oxi hóa 7.6 Phương trình hoá học của 2 phản ứng như sau: Cl2 + 2NaBr → 2NaCl + Br2 Br2 + 2NaI → 2NaBr + I2 So sánh tính khử của các ion halide qua 2 phản ứng. Giải thích Phương pháp giải: Dựa vào tính chất trong phản ứng oxi hóa khử: Chất khử mạnh + Chất oxi hóa mạnh " Chất oxi hóa yếu + Chất khử yếu Lời giải chi tiết: - Trong phản ứng: \(\mathop {C{l_2}}\limits^0 + 2Na\mathop {Br}\limits^{ - 1} \to 2Na\mathop {Cl}\limits^{ - 1} + \mathop {B{r_2}}\limits^0 \) ta có ion Br- là chất khử => Tính khử: Br- > Cl- - Trong phản ứng: \(\mathop {B{r_2}}\limits^0 + 2Na\mathop I\limits^{ - 1} \to 2Na\mathop {Br}\limits^{ - 1} + \mathop {{I_2}}\limits^0 \) ta có ion I- là chất khử => Tính khử: I- > Br- => So sánh tính khử của các ion halide: I- > Br- > Cl- 7.7 Ghi hiện tượng vào các ô trống trong bảng và viết phương trình hoá học của phản ứng (nếu có).
Phương pháp giải: - Tính oxi hóa của các halogen giảm dần theo thứ tự: F2 > Cl2 > Br2 > I2 - Nước chlorine có tính oxi hóa mạnh Lời giải chi tiết:
Các phương trình xảy ra: Cl2 + 2KBr -> 2KCl + Br2 Cl2 + 2KI -> 2KCl + I2 Cl2 + H2O HCl + HClO (HClO có tính oxi hóa mạnh làm mất màu hoa hồng) 7.8 Chlorine tạo được các acid có oxygen trong thành phần phân tử. Tên và công thức của các acid có oxygen của chlorine theo bảng.
Acid có hậu tố -ous thì tạo muối có hậu tố -ite; acid có hậu tố -ic tạo muối có hậu tố -ate; acid có mức oxi hoá của nguyên tố trung tâm thấp nhất có tiền tố hypo- acid có mức oxi hoá của nguyên tố trung tâm cao nhất có tiền tổ per-. Áp dụng quy tắc trên, đọc tên các chất sau: HBrO; HBrO2; HBrO3; HBrO4; NaBrO: KBгO2; KBrO3 và KBгO4. Lời giải chi tiết:
7.9 Nghiền mịn 10 g một mẫu đá vôi trong tự nhiên, hoà tan trong lượng dư dung dịch HCl thu được 4 g khí carbonic. Tính hàm lượng calcium carbonate trong mẫu đá vôi. Phương pháp giải: - Tính số mol khí carbonic -> số mol calcium carbonate phản ứng -> Tính hàm lượng calcium carbonate trong mẫu đá vôi Lời giải chi tiết: - Có \({n_{C{O_2}}} = \frac{4}{{44}} = 0,091\)mol - Ta có phương trình: CaCO3 + 2HCl -> CaCl2 + CO2 + H2O 0,091 <- 0,091 mol - Hàm lượng calcium carbonate trong mẫu đá vôi là: \(\% {m_{CaC{O_3}}} = \frac{{0,091.100}}{{10}}.100\% = 90,91\% \)
|





















Danh sách bình luận