Bài 6. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm trang 22, 23 SBT Hóa 10 Chân trời sáng tạoDãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần của bán kính nguyên tử? A. Be, F, O, C, Mg. B. Mg, Be, C, O, F. C. F, O, C, Be, Mg. D. F, Be, C, Mg, O. Nguyên tử của nguyên tố nào có bán kính lớn nhất trong các nguyên tử sau đây? A. Al. B. P. C. S. D. K. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
6.1 Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần của bán kính nguyên tử? A. Be, F, O, C, Mg. B. Mg, Be, C, O, F. C. F, O, C, Be, Mg. D. F, Be, C, Mg, O. Phương pháp giải: - Xu hướng biến đổi bán kính nguyên tử: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử + Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: F < O < C < Be (1) + Trong cùng một nhóm IIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: Be < Mg (2) => Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần bán kính nguyên tử: F < O < C < Be < Mg => Đáp án: C
6.2 Nguyên tử của nguyên tố nào có bán kính lớn nhất trong các nguyên tử sau đây? A. Al. B. P. C. S. D. K. Phương pháp giải: - Xu hướng biến đổi bán kính nguyên tử: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
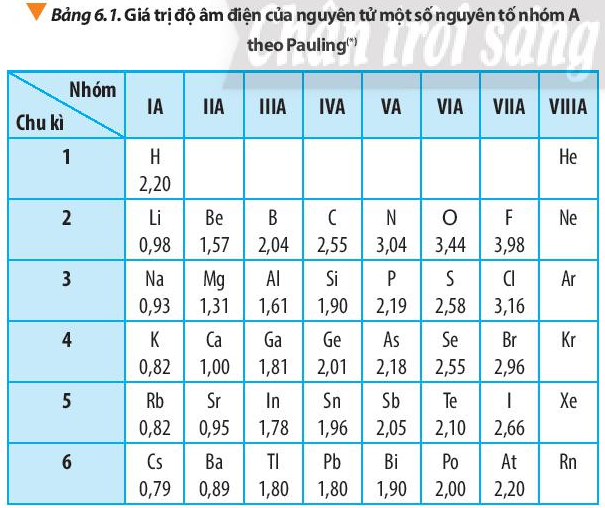
- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử Do nguyên tố Al và K không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là Na (Cùng chu kì với Al và cùng nhóm với K) + Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: S < P < Al < Na (1) + Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: Na < K (2) => Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần bán kính nguyên tử: S < P < Al < Na < K => Đáp án: D 6.3 Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần độ âm điện của nguyên tử? A. Li, F, N, Na, C. B. F, Li, Na, C, N. C. Na, Li, C, N, F. D. N, F, Li, C, Na. Phương pháp giải: - Xu hướng biến đổi độ âm điện: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi độ âm điện + Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: Li < C < N < F (1) + Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: Na < Li (2) => Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần độ âm điện: Na < Li < C < N < F => Đáp án: C 6.4 Nguyên từ của nguyên tố nào sau đây có độ âm điện lớn nhất? Cho biết nguyên tố này được sử dụng trong công nghệ hàn, sản xuất thép và methanol. A. B. B. N. C. O. D. Mg. Phương pháp giải: - Xu hướng biến đổi độ âm điện: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi độ âm điện Do nguyên tố B và Mg không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là Be (Cùng chu kì với B và cùng nhóm với Mg) + Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: Be < B < N < O (1) + Trong cùng một nhóm IIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: Mg < Be (2) => Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần độ âm điện: Mg < Be < B < N < O => Đáp án: C 6.5 Nguyên tử của nguyên tố nào sau đây có tính kim loại mạnh nhất? Cho biết nguyên tố này được sử dụng trong đồng hồ nguyên tử, với độ chính xác ở mức giây trong hàng nghìn năm. A Hydrogen. B. Beryllium. C. Caesium. D. Phosphorus. Phương pháp giải: - Xu hướng biến đổi tính kim loại, tính phi kim: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim Do nguyên tố H, Be và P không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là Li và Na (Li cùng chu kì với Be và cùng nhóm với H, Na cùng chu kì với P và cùng nhóm với H) + Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính kim loại là: Be < Li (1) + Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính kim loại là: P < Na (2) + Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính kim loại là: H < Li < Na < Cs (3) => Từ (1), (2) và (3) ta có nguyên tố có tính kim loại mạnh nhất là Cs => Đáp án: C 6.6 Nguyên tử của nguyên tố nào sau đây có tính phi kim mạnh nhất? Cho biết nguyên tố này có trong thành phần của hợp chất teflon, được sử dụng để tráng chảo chống dính. A. Fluorine. B. Bromine. C. Phosphorus. D. Iodine. Phương pháp giải: - Xu hướng biến đổi tính kim loại, tính phi kim: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim Do nguyên tố P và F không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là Cl (Cl cùng chu kì với P và cùng nhóm với F) + Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: P < Cl (1) + Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: I < Br < Cl < F (2) => Từ (1) và (2) ta có nguyên tố có tính phi kim mạnh nhất là F => Đáp án: A 6.7 Hydroxide nào có tính base mạnh nhất trong các hydroxide sau đây? Cho biết hợp chất này được sử dụng làm chất phụ gia cho dầu bôi trơn của động cơ đốt trong A. Calcium hydroxide. B. Barium hydroxide. C. Strontium hydroxide. D. Magnesium hydroxide. Phương pháp giải: - Xu hướng biến đổi tính acid - base của oxide và hydroxide: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng tăng dần, tính acid của chúng giảm dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi tính acid - base của oxide và hydroxide + Trong cùng một nhóm IIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính base của hydroxide của các nguyên tố là: Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2 => Hydroxide của barium có tính base mạnh nhất => Đáp án: B 6.8 Hydroxide nào có tính acid mạnh nhất trong các hydroxide sau đây? Cho biết hợp chất này được dùng để phân huỷ các quặng phức tạp; phân tích khoáng vật hoặc làm chất xúc tác. A. Silicic acid. B. Sulfuric acid. C. Phosphoric acid. D. Perchloric acid. Phương pháp giải: - Xu hướng biến đổi tính acid - base của oxide và hydroxide: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng tăng dần, tính acid của chúng giảm dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi tính acid - base của oxide và hydroxide + Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính acid của hydroxide của các nguyên tố là: H2SiO3 < H3PO4 < H2SO4 < HClO4 => Hydroxide của chlorine có tính base mạnh nhất => Đáp án: D 6.9 Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20. Phát biểu nào sau đây sai? A. Các nguyên tố này đều là các kim loại mạnh nhất trong chu kì. B. Các nguyên tố này không cùng thuộc một chu kì. C. Thứ tự tăng dần tính base là: X(OH)2, Y(OH)2, Z(OH)2. D. Thứ tự tăng dần độ âm điện là Z, Y, X. Phương pháp giải: - Xu hướng biến đổi độ âm điện: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần - Xu hướng biến đổi tính kim loại, tính phi kim: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần - Xu hướng biến đổi tính acid - base của oxide và hydroxide: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng tăng dần, tính acid của chúng giảm dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn + Nguyên tố X có Z = 4 " Cấu hình electron của X là: 1s22s2 => X thuộc chu kì 2, nhóm IIA + Nguyên tố Y có Z = 12 " Cấu hình electron của Y là: 1s22s22p63s2 => Y thuộc chu kì 3, nhóm IIA + Nguyên tố Z có Z = 12 " Cấu hình electron của Z là: 1s22s22p63s23p64s2 => Z thuộc chu kì 4, nhóm IIA
- Bước 2: Dựa vào các xu hướng biến đổi + Xu hướng biến đổi độ âm điện: Trong cùng một nhóm IIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: Z < Y < X + Xu hướng biến đổi tính kim loại, tính phi kim: Trong cùng một chu kì 2, 3 và 4, các nguyên tố X, Y và Z đều thuộc nhóm IIA " Các nguyên tố cùng chu kì và thuộc nhóm IA sẽ có tính kim loại mạnh hơn + Xu hướng biến đổi tính acid - base của oxide và hydroxide: Trong cùng một nhóm IIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính base của hydroxide của các nguyên tố là: X(OH)2 < Y(OH)2 < Z(OH)2 => Đáp án: A 6.10 Hãy cho biết: a) Sự biến đổi tính kim loại và tính phi kim của nguyên tử một nguyên tố b) Quan hệ giữa tính phi kim và độ âm điện của nguyên tử một nguyên tố. c) Quan hệ giữa sự biến đổi độ âm điện và tính phi kim của nguyên tử các nguyên tố nhóm A trong bảng tuần hoàn. Phương pháp giải: - Định nghĩa tính kim loại: là tính chất của một nguyên tố mà nguyên tử dễ nhường electron - Định nghĩa tính phi kim: là tính chất của một nguyên tố mà nguyên tử dễ nhận electron - Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học Lời giải chi tiết: a) Vì tính kim loại và tính phi kim trái ngược nhau về mặt bản chất " nguyên tử của nguyên tố nào càng dễ nhường electron bao nhiêu thì càng khó nhận electron bấy nhiêu và ngược lại " Nguyên tử của một nguyên tố có tính kim loại càng mạnh thì tính phi kim càng yếu và ngược lại b) Từ định nghĩa về tính phi kim và đặc điểm của độ âm điện, ta thấy những nguyên tử của nguyên tố nào có độ âm điện càng cao thì khả năng hút electron càng mạnh " khả năng nhận electron càng dễ dàng " tính phi kim càng mạnh c) Trong cùng một nhóm A, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của các nguyên tố giảm dần. Vì độ âm điện của các nguyên tố đại diện cho khả năng hút electron nên độ âm điện giảm dần thì tính phi kim của nguyên tố cũng sẽ giảm dần 6.11 Quan sát hình sau:
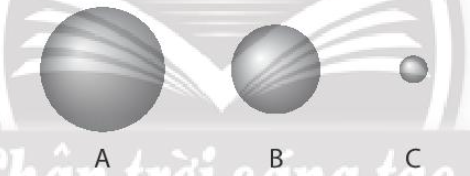
3 quả cầu A, B, C tượng trưng cho nguyên tử các nguyên tố helium, krypton và radon. Quả cầu nào là krypton? Phương pháp giải: - Xu hướng biến đổi bán kính nguyên tử: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử + Trong cùng một nhóm VIIIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: He < Kr < Rn (2) => Quả cầu krypton là quả cầu B 6.12 Sắp xếp các nguyên tử sau đây theo thứ tự tăng dần độ âm điện: Cl, Al, Na, P, F. Phương pháp giải: - Xu hướng biến đổi độ âm điện: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi độ âm điện + Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: Na < Al < P < Cl (1) + Trong cùng một nhóm VIIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: Cl < F (2) => Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần độ âm điện: Na < Al < P < Cl < F 6.13 Sắp xếp các nguyên tử sau đây theo thứ tự giảm dần tính kim loại: Na, Al, Si, Mg, P, Cl, S, F. Phương pháp giải: - Xu hướng biến đổi tính kim loại, tính phi kim: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần Lời giải chi tiết: - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim + Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần tính kim loại là: Na > Mg > Al > Si > P > S > Cl (1) + Trong cùng một nhóm VIIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần tính kim loại là: Cl > F (2) => Từ (1) và (2) ta có ta có dãy sắp xếp theo chiều giảm dần tính kim loại là: Na > Mg > Al > Si > P > S > Cl > F 6.14 Viết phương trình phản ứng của các chất sau với nước (nếu có): Na2O, SO3, Cl2O7, CO2, CaO, N2O5. Nhận xét về tính base, tính acid của các sản phẩm tạo thành. Phương pháp giải: - Xu hướng biến đổi tính acid - base của oxide và hydroxide: + Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng tăng dần, tính acid của chúng giảm dần Lời giải chi tiết: - Bước 1: Viết phương trình phản ứng của các chất với nước Na2O + H2O " 2NaOH SO3 + H2O " H2SO4 Cl2O7 + H2O " 2HClO4 CO2 + H2O H2CO3 CaO + H2O " Ca(OH)2 N2O5 + H2O " 2HNO3 - Bước 2: Xác định vị trí các nguyên tố trong bảng tuần hoàn
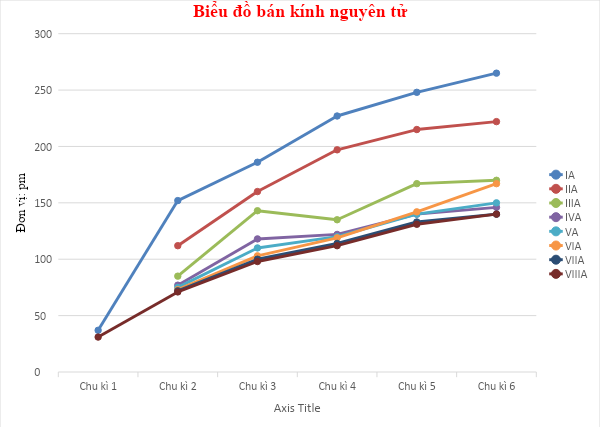
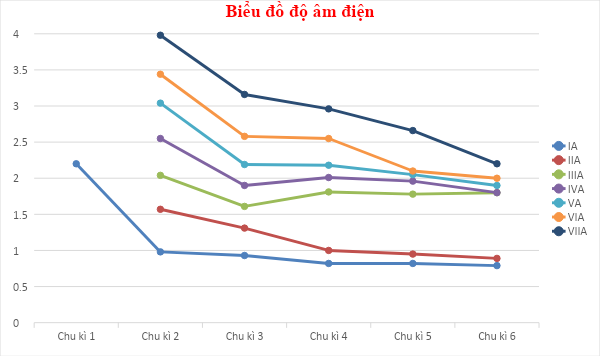
- Bước 3: Dựa vào xu hướng biến đổi tính acid - base của oxide và hydroxide + Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính acid của hydroxide của các nguyên tố là: H2CO3 < HNO3 + Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính acid của hydroxide của các nguyên tố là: H2SO4 < HClO4 + NaOH và Ca(OH)2 đều là các hydroxide có tính base mạnh vì các nguyên tố Na và Ca đều đứng ở những nhóm A đầu tiên, tuy nhiên không thể so sánh thông qua một base của một nguyên tố gián tiếp nào khác 6.15 Dựa vào Hình 6.1 và Bảng 6.1 trong SGK, hãy vẽ đồ thị hoặc biểu đồ đối với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng số liệu trên. Quan sát và cho biết hai đại lượng này biến thiên như thế nào. Giải thích.
Phương pháp giải: - Bước 1: Sử dụng các phần mềm vẽ biểu đồ như Word, Excel,… - Bước 2: Quan sát và nhận xét sự biến thiên của hai đại lượng Lời giải chi tiết: - Bước 1: Vẽ biểu đồ
- Bước 2: Nhận xét + Về bán kính nguyên tử: theo chiều tăng dần của điện tích hạt nhân ∙ Trong cùng một nhóm, bán kính nguyên tử tăng dần ∙ Trong cùng một chu kì, bán kính nguyên tử giảm dần + Về độ âm điện: theo chiều tăng dần của điện tích hạt nhân ∙ Trong cùng một nhóm, độ âm điện giảm dần ∙ Trong cùng một chu kì, độ âm điện tăng dần
|





















Danh sách bình luận