30 câu hỏi lý thuyết mức độ thông hiểu về sự biến đổi tuần hoàn tính chất các nguyên tố hóa học có lời giảiLàm bàiQuảng cáo
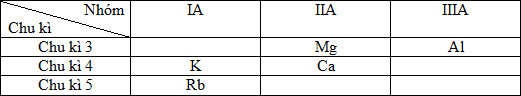
Câu hỏi 1 : Các nguyên tố Mg, Ca, Al, K, Rb được xếp theo chiều tính khử tăng dần là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Vị trí tương đối của các nguyên tố trong HTTH các nguyên tố hóa học:
- Trong cùng 1 chu kì, theo chiều tăng của điện tích hạt nhân thì tính KL của các nguyên tố giảm dần nên ta suy ra: + Mg > Al (1) + K > Ca (2) - Trong cùng 1 nhóm A, theo chiều tăng của điện tích hạt nhân thì tính KL của các nguyên tố tăng dần suy ra: + Ca > Mg (3) + Rb > K (4) Kết hợp (1) (2) (3) (4) suy ra: Al < Mg < Ca < K < Rb Đáp án B Câu hỏi 2 : Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau được lặp lại tương tự như chu kì trước là do:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 3 : Điều khẳng định nào sau đây là sai? Trong một nhóm A của bảng tuần hoàn, theo chiều tăng của điện tích hạt nhân:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Trong 1 nhóm A, theo chiều tăng dần điện tích hạt nhân độ âm giảm dần; tính kim loại, tính bazo tăng dần; tính phi kim giảm dần.Đáp án A Câu hỏi 4 : Thứ tự tăng dần bán kính nguyên tử nào sau đây đúng?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Dễ thấy F và Cl cùng nhóm VIIA => bán kính F < Cl (1)Na, Al, P và Cl cùng chu kì => bán kính Na > Al > P > Cl (2)Từ (1) và (2) => bán kính tăng dần F, Cl, P, Al, Na=> Đáp án A Câu hỏi 5 : Năng lượng ion hóa thứ nhất (I1) của nguyên tử nguyên tố: Na, K, N, P tăng dần theo thứ tự sau:
Đáp án: D Phương pháp giải: - Năng lượng ion hóa thứ nhất là năng lượng cần để bứt e đầu tiên ra khỏi nguyên tử. - Khi bán kính càng lớn → Lực liên kết giữa hạt nhân và electron ngoài cùng càng nhỏ → Sự bứt e ra khỏi nguyên tử càng dễ dàng → Năng lượng cần để bứt e ra khỏi nguyên tử càng nhỏ. Lời giải chi tiết: - Năng lượng ion hóa thứ nhất là năng lượng cần để bứt e đầu tiên ra khỏi nguyên tử. - Khi bán kính càng lớn → Lực liên kết giữa hạt nhân và electron ngoài cùng càng nhỏ → Sự bứt e ra khỏi nguyên tử càng dễ dàng → Năng lượng cần để bứt e ra khỏi nguyên tử càng nhỏ. Áp dụng vào bài này: Bán kính: K > Na > P > N Năng lượng ion hóa thứ nhất: K < Na < P < N Đáp án D Câu hỏi 6 : Các nguyên tố K, Na, P, N được sắp xếp theo thứ tự giảm dần độ âm điện:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 7 : Nguyên tố A thuộc nhóm VIIA trong bảng hệ thống tuần hoàn. Công thức hợp chất khí với hidro là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 8 : Nguyên tố R có cấu hình e là 1s22s22p3. Oxit cao nhất và hợp chất khí với hidro lần lượt có công thức là:
Đáp án: C Phương pháp giải: Từ số e lớp ngoài cùng => số thứ tự nhóm => hóa trị cao nhất của nguyên tố trong hợp chất với O và H Lời giải chi tiết: Nguyên tố R có cấu hình e là 1s22s22p3 => R thuộc nhóm VA => Đáp án C Câu hỏi 9 : Cho các nhận định sau: (1): Trong một chu kỳ, tính kim loại giảm dần theo chiều tăng của điện tích hạt nhân. (2): Trong một nhóm, tính phi kim tăng dần theo chiều tăng của điện tích hạt nhân. (3): Trong một chu kỳ, bán kính nguyên tử giảm dần theo chiều tăng của điện tích hạt nhân. (4): Trong một nhóm, độ âm điện giảm dần theo chiều tăng của điện tích hạt nhân. Số nhận định chính xác là:
Đáp án: C Phương pháp giải: Dựa vào sự biến đổi tuần hoàn của tính kim loại/phi kim; bán kính nguyên tử, độ âm điện. Lời giải chi tiết: Chỉ có (2) sai vì trong một nhóm, tính phi kim giảm dần theo chiều tăng của điện tích hạt nhân. Đáp án C Câu hỏi 10 : Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C N : 1s22s22p3 Mg : 1s22s22p63s2 Si : 1s22s22p63s23p2 K : 1s22s22p63s23p64s1 K chu kỳ 4 nhóm IA ; Mg chu kỳ 3 nhóm IIA => rK > rMg Si chu kỳ 3 nhóm IVA ; N chu kỳ 2 nhóm VA => rSi > rN Câu hỏi 11 : Tính bazơ của dãy hiđroxit: NaOH, Mg(OH)2, Al(OH)3 biến đổi theo chiều nào sau đây?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Từ Na – Mg – Al : Tính kim loại giảm => Tính bazo giảm Câu hỏi 12 : Cho các nguyên tố 9F, 16S, 17Cl, 14Si. Chiều giảm dần tính kim loại của chúng là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Trong cùng 1 nhóm, từ trên xuống thì tính kim loại tăng dần => Cl > F Trong một chu kỳ, từ trái sang phải thì tính kim loại giảm dần => Si > S > Cl Câu hỏi 13 : Cho số hiệu nguyên tử của các nguyên tố: Mg(Z=12), Al(Z=13), K(Z=19), Ca(Z=20). Tính bazơ của các hiđroxit nào sau đây lớn nhất:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Từ trên xuống dưới trong 1 nhóm, tính bazo tăng dần => Ca > Mg Trong cùng 1 chu kỳ thì từ trái sang phải, tính bazo giảm => K > Ca và Mg > Al => KOH có tính bazo lớn nhất Câu hỏi 14 : Trong nhóm IA, khi đi từ Li đến Cs, khả năng nhường electron của các nguyên tố tăng dần. Nguyên nhân là do
Đáp án: C Phương pháp giải: Lời giải chi tiết: Trong nhóm IA, khi đi từ Li đến Cs, khả năng nhường electron của các nguyên tố tăng dần. Nguyên nhân là do Số lớp electron tăng làm bán kính nguyên tử các nguyên tố tăng nhanh. Bán kính càng lớn thì lực hút giữa hạt nhân và e càng yếu nên dễ dàng bị tách Đáp án C Câu hỏi 15 : Cho các ion sau : S2−, K+, Ca2+, Cl-. Bán kính của các ion được sắp xếp đúng là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: S2−, K+, Ca2+, Cl- bây giờ có cùng số e ở vỏ ngoài là 18e nên theo chiều tăng điện tích hạt nhân thì bán kính giảm dần Đáp án A Câu hỏi 16 : Theo quy luật biến đổi tính chất đơn chất của các nguyên tố trong bảng hệ thống thì nguyên tố có tính phi kim mạnh nhất là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Trong cùng 1 nhóm A thì tính phi kim giảm dần theo chiều tăng của Z F > Cl >Br > I Câu hỏi 17 : Xét ba nguyên tố có cấu hình e lần lượt là: (X): 1s22s22p63s1 (Y): 1s22s22p63s2 (Z): 1s22s22p63s23p1 Hiđroxit của X,Y,Z xếp theo thứ tự tăng dần tính bazơ là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C X , Y Z cùng thuộc một chu kì và trong 1 chu kì theo chiều tăng dần của Z thì tính bazo giảm dần Câu hỏi 18 : Theo quy luật biến đổi tính chất đơn chất của các nguyên tố trong bảng hệ thống thì nguyên tố có tính phi kim yếu nhất trong nhóm VIIA là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 19 : Bán kính nguyên tử của các nguyên tố halogen được sắp xếp theo thứ tự giảm dần từ trái sang phải là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Trong cùng một nhóm thì theo chiều Z tăng bán kính nguyên tử sẽ tăng Câu hỏi 20 : Cho dãy các bazơ sau: NaOH, KOH, Mg(OH)2, Al(OH)3. Dãy sắp xếp đúng tính bazơ theo thứ tự giảm dần là:
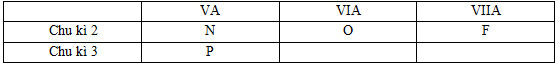
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Na , K cùng nhóm IA , K đứng dưới Na trong nhóm => tính kim loại K > Na Na, Mg , Al : cùng 1 chu kì ( trong cùng chu kì theo chiều tăng Z thì tính kim loại dảm ) Na > Mg > Al Câu hỏi 21 : Thực hiện các yêu cầu sau (không cần giải thích) a. Cho các nguyên tố: P, N, F, O. Hãy sắp xếp theo chiều giảm dần tính phi kim. b. Sắp xếp các chất sau: Mg(OH)2, Al(OH)3, KOH, NaOH theo chiều tăng dần tính bazơ. Phương pháp giải: - B1: Xác định vị trí tương đối của các nguyên tố trong bảng tuần hoàn - B2: Dựa vào quy luật biến đổi để sắp xếp các nguyên tố theo yêu cầu của đề bài Lời giải chi tiết: a. Vị trí tương đối của các nguyên tố trong bảng tuần hoàn:
Quy luật biến đổi tính phi kim: - Trong một chu kì, theo chiều tăng của điện tích hạt nhân thì tính phi kim tăng dần => N < O < F - Trong một nhóm, theo chiều tăng của điện tích hạt nhân thì tính phi kim giảm dần => P < N Vậy các nguyên tố theo chiều giảm dần tính phi kim: F, O, N, P b. Vị trí tương đối của các nguyên tố trong bảng tuần hoàn:
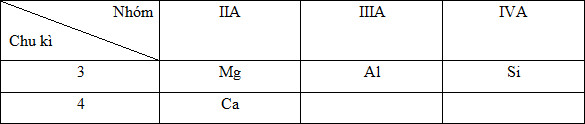
Quy luật biến đổi lực bazo: - Trong một chu kì, theo chiều tăng của điện tích hạt nhân thì tính bazo giảm dần => NaOH > Mg(OH)2 > Al(OH)3 - Trong một nhóm, theo chiều tăng của điện tích hạt nhân thì tính bazo tăng dần => KOH > NaOH Vậy các chất sau theo chiều tăng dần tính bazo: Al(OH)3, Mg(OH)2, NaOH,KOH Câu hỏi 22 : Vị trí của Al trong chu kì và nhóm thể hiện như sau:
Cho các nhận xét sau: (a) Từ Mg đến Si, bán kính nguyên tử tăng. (b) Al là kim loại lưỡng tính vì Mg là kim loại còn Si là phi kim. (c) Tổng số electron hóa trị của Mg, Al, Si bằng 9. (d) Tính axit của các hidroxit giảm dần theo trật tự: H2SiO3, Al(OH)3, Mg(OH)2. (e) Nguyên tố Mg, Al, Si không tạo được hợp chất khí với hidro. (f) Độ âm điện giảm dần theo trật tự: Si, Al, Mg, B. Trong các phát biểu trên, số phát biểu đúng là
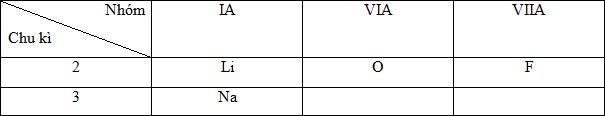
Đáp án: A Phương pháp giải: Dựa vào sự biến đổi tuần hoàn của một số tính chất của nguyên tử. Lời giải chi tiết: (a) Sai vì trong cùng 1 chu kì theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm (b) Sai vì không có khái niệm kim loại lưỡng tính (c) Đúng. Mg thuộc nhóm IIA (2e hóa trị), Al thuộc nhóm IIIA (3e hóa trị), Si thuộc nhóm IVA (4e hóa trị) (d) Đúng (e) Sai vì H2 tạo hợp chất khí với Si là SiH4 (f) Sai vì trong cùng 1 nhóm theo chiều tăng của điện tích hạt nhân độ âm điện giảm dần => độ âm điện của B lớn hơn của Al Đáp án A Câu hỏi 23 : Bán kính nguyên tử của các nguyên tố: 3Li, 11Na, 8O, 9F được xếp theo thứ tự tăng dần trừ trái sang phải là
Đáp án: A Phương pháp giải: - Viết cấu hình e của nguyên tử các nguyên tố và xác định vị trí tương đối của chúng. - Dựa vào quy luật biến đổi bán kính để sắp xếp: + Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử của các nguyên tố giảm dần. + Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử của các nguyên tố tăng dần. Lời giải chi tiết: - Cấu hình e nguyên tử: 3Li (1s22s1), 11Na(1s22s22p63s1), 8O (1s22s22p4), 9F (1s22s22p5) - Vị trí tương đối của các nguyên tố trong BTH:
- Theo quy luật biến đổi bán kính: + Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử của các nguyên tố giảm dần. + Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử của các nguyên tố tăng dần. Ta có sự sắp xếp bán kính như sau: F < O < Li < Na Đáp án A Câu hỏi 24 : Sắp xếp các nguyên tố sau đây theo chiều tăng dần tính kim loại và giải thích: 14Si, 20Ca, 13Al, 12Mg.
Đáp án: B Phương pháp giải: 1. Viết cấu hình e nguyên tử mỗi nguyên tố. 2. Xác định vị trí của nguyên tố trong BTH dựa vào cấu hình e nguyên tử. 3. So sánh tính kim loại dựa vào quy luật biến đổi tuần hoàn: - Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân tính kim loại giảm dần. - Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân tính kim loại tăng dần. Lời giải chi tiết:
Vị trí tương đối của các nguyên tố trong bảng tuần hoàn:
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân tính kim loại giảm dần => Tính kim loại: Mg > Al > Si - Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân tính kim loại tăng dần => Tính kim loại: Ca > Mg Vậy tính kim loại tăng dần là: Si < Al < Mg < Ca Đáp án B Câu hỏi 25 : Bán kính nguyên tử của các nguyên tố: 3Li, 8O, 9F, 11Na được sắp xếp theo thứ tự tăng dần từ trái sang phải là:
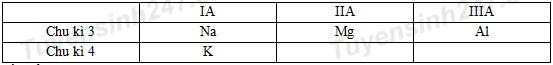
Đáp án: C Phương pháp giải: Từ số hiệu nguyên tử suy ra vị trí của các nguyên tố trên trong bảng tuần hoàn. Từ đó dựa vào quy luật biến đổi tuần hoàn bán kính nguyên tử theo chu kì và theo 1 nhóm A để sắp xếp bán kính các nguyên tử theo thứ tự tăng dần. Lời giải chi tiết: Nhận thấy 3Li, 8O, 9F là các nguyên tố thuộc cùng chu kì 2. Theo định luật tuần hoàn, trong cùng 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần. Do đó bán kính nguyên tử: 3Li > 8O > 9F 3Li và 11Na thuộc cùng nhóm IA. Theo định luật tuần hoàn trong cùng 1 nhóm, theo chiều tăng dần điện tích hạt nhân thì bán kính nguyên tử tăng dần nên bán kính nguyên tử 3Li < 11Na Vậy bán kính nguyên tử: 11Na > 8Li > 8O > 9F hay theo thứ tự tăng dần là F< O < Li < Na Đáp án C Câu hỏi 26 : Cho dãy các nguyên tố: 12Mg, 13Al, 19K, 20Ca. Hãy sắp xếp chúng theo chiều tăng dần tính kim loại?
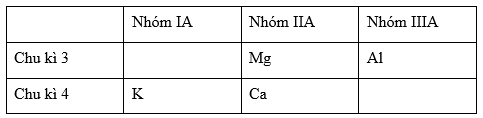
Đáp án: B Phương pháp giải: Từ số hiệu nguyên tử suy ra vị trí của các nguyên tố trên trong bảng tuần hoàn. Từ đó dựa vào quy luật biến đổi tuần hoàn tính kim loại theo chu kì và theo 1 nhóm A để sắp xếp các nguyên tố theo chiều tăng dần tính kim loại. Lời giải chi tiết: Ta có: 12Mg: 1s22s22p63s2 → Mg thuộc chu kì 3, nhóm IIA 13Al: 1s22s22p63s23p1 → Al thuộc chu kì 3, nhóm IIIA 19K: 1s22s22p63s23p64s1 → K thuộc chu kì 4, nhóm IA 20Ca: 1s22s22p63s23p64s2 → Ca thuộc chu kì 4, nhóm IIA Ta có bảng tuần hoàn rút gọn:
Theo định luật tuần hoàn, trong cùng 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần: Mà Mg và Al cùng thuộc chu kì 3 nên tính kim loại Mg >Al (1) Vì K và Ca cùng thuộc chu kì 4 nên tính kim loại K > Ca (2) Theo định luật tuần hoàn trong cùng 1 nhóm, theo chiều tăng dần điện tích hạt nhân thì tính kim loại tăng dần: vì cả Mg và Ca cùng thuộc nhóm IIA nên tính kim loại của Ca > Mg (3) Từ (1), (2) và (3) ta có tính kim loại K > Ca > Mg > Al Vậy dãy gồm các kim loại sắp theo chiều tăng dần tính kim loại là Al < Mg < Ca < K Đáp án B Câu hỏi 27 : Cho dãy các nguyên tố: 7N, 8O, 9F, 15P. Hãy sắp xếp chúng theo chiều tăng dần tính phi kim?
Đáp án: A Phương pháp giải: Từ số hiệu nguyên tử suy ra vị trí của các nguyên tố trên trong bảng tuần hoàn. Từ đó dựa vào quy luật biến đổi tuần hoàn tính phi kim theo chu kì và theo 1 nhóm A để sắp xếp các nguyên tố theo chiều tăng dần tính phi kim. Lời giải chi tiết: Ta có: 7N : 1s22s22p3 → N thuộc chu kì 2, nhóm VA 8O: 1s22s22p4 → O thuộc chu kì 2, nhóm VIA 9F: 1s22s22p5 → N thuộc chu kì 2, nhóm VIIA 15P: 1s22s22p63s23p3 → P thuộc chu kì 3, nhóm VA Ta có bảng tuần hoàn rút gọn:
Mà N, O, F đều thuộc chu kì 2 nên tính phi kim của N < O < F (1) Theo định luật tuần hoàn trong cùng 1 nhóm, theo chiều tăng dần điện tích hạt nhân thì tính phi kim giảm dần: Mà N và P đều thuộc nhóm VA nên tính phi kim của P < N (2) Từ (1) và (2) tính phi kim P <N < O < F Đáp án A Câu hỏi 28 : Cho các nguyên tố sau: X (Z=8), Y (Z=13), M (Z=15) và T (Z=19). Sự sắp xếp nào đúng với chiều tăng dần độ âm điện của các nguyên tố đó?
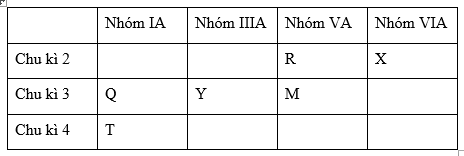
Đáp án: B Phương pháp giải: Từ số hiệu nguyên tử suy ra vị trí của các nguyên tố trên trong bảng tuần hoàn. Từ đó dựa vào quy luật biến đổi tuần hoàn độ âm điện theo chu kì và theo 1 nhóm A để sắp xếp các nguyên tố theo chiều tăng dần độ âm điện Lời giải chi tiết: Cấu hình electron nguyên tử của các nguyên tố: X (Z=8): 1s22s22p4 → X thuộc chu kì 2, nhóm VIA Y (Z=13): 1s22s22p63s23p1 → Y thuộc chu kì 3, nhóm IIIA M (Z=15): 1s22s22p63s23p3 →M thuộc chu kì 3, nhóm VA T (Z=19): 1s22s22p63s23p64s1 → T thuộc chu kì 4, nhóm IA Ta có bảng tuần hoàn rút gọn:
Giả sử nguyên tố R nằm ở chu kì 2, nhóm VA và nguyên tố Q nằm ở chu kì 3, nhóm IA Theo định luật tuần hoàn, trong cùng 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của các nguyên tố tăng dần. Do đó: Các nguyên tố R và X cùng thuộc chu kì 2 nên độ âm điện của R < X (1) Các nguyên tố Q, Y và M cùng thuộc chu kì 3 nên độ âm điện của Q < Y < M (2) Theo định luật tuần hoàn trong cùng 1 nhóm, theo chiều tăng dần điện tích hạt nhân, độ âm điện của các nguyên tố giảm dần. Do đó : các nguyên tố R và M cùng thuộc nhóm VA nên độ âm diện của M < R (3) các nguyên tố Q và T cùng thuộc nhóm IA nên độ âm điện của T < Q (4) Từ (1), (2), (3), (4) ta có độ âm điện của các nguyên tố T < Q < Y < M < R <X Vậy dãy gồm các nguyên tố được sắp xếp theo chiều tăng dần độ âm điện là: T < Y < M <X Đáp án B Câu hỏi 29 : Trong các hiđroxit dưới đây, chất nào có tính axit mạnh nhất? Cho ZS=16, ZSe=34, ZCl=17, ZBr=35.
Đáp án: C Phương pháp giải: Từ số hiệu nguyên tử suy ra vị trí của các nguyên tố trên trong bảng tuần hoàn. Từ đó dựa vào quy luật biến đổi tuần hoàn tính axit của hidroxit theo chu kì và theo 1 nhóm A để xác định chất có tính axit mạnh nhất. Lời giải chi tiết: Trong một nhóm A, đi từ trên xuống dưới theo chiều tăng dần của điện tích hạt nhân: tính axit của oxit và hiđroxit giảm dần Ta có 17Cl và 35Br đều cùng thuộc nhóm VIIA nên tính axit HClO4 > HBrO4 Ta có 16S và 34Se đều cùng thuộc nhóm VIA nên tính axit H2SO4 > H2SeO4 Trong cùng 1 chu kì, đi từ trái sang phải, theo chiều tăng dần của điện tích hạt nhân: tính axit của oxit và hiđroxit tăng dần. Nhận thấy 16S và 17Cl đều cùng thuộc chu kì 3 nên tính axit HClO4 > H2SO4 Vậy chất có tính axit mạnh nhất là HClO4. Đáp án C Câu hỏi 30 : Nguyên tử của nguyên tố X có cấu hình electron: [Ne]3s23p4. Công thức oxit cao nhất và công thức hợp chất khí với hiđro của X là:
Đáp án: C Phương pháp giải: Từ cấu hình electron suy ra vị trí của X trong bảng tuần hoàn, từ đó viêt được công thức oxit cao nhất và công thức hợp chất khí với hiđro của X . Lời giải chi tiết: Nguyên tử của nguyên tố X có cấu hình electron: [Ne]3s23p4 nên nguyên tố X thuộc nhóm VIA của bảng tuần hoàn. Vậy công thức oxit cao nhất và công thức hợp chất khí với hiđro của X là: XO3 và XH2. Đáp án C Quảng cáo
|