20 bài tập vận dụng về bảng tuần hoàn các nguyên tố hóa học có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : X là một nguyên tố nguyên tố p. Tổng số hạt trong nguyên tử của nguyên tố X là 40. Vị trí của X trong bảng tuần hoàn là
Đáp án: C Phương pháp giải: Đối với các nguyên tố có Z ≤ 82 ta luôn có: \(1 \le \frac{N}{Z} \le 1,5\) Lời giải chi tiết: Tổng số hạt của X là 40 => 2Z + N = 40 => N = 40 - 2Z \( \to 1 \le \frac{{40 - 2Z}}{Z} \le 1,5\) → Z ≤ 40 – 2Z ≤ 1,5Z 11,43 ≤ Z ≤ 13,33 → Z = 12 hoặc Z = 13 *Trường hợp 1: Với Z = 12: X có cấu hình là 1s22s22p63s2 => X là nguyên tố s => loại *Trường hợp 2: Với Z = 13: X có cấu hình là 1s22s22p63s23p1 => X là nguyên tố p => thỏa mãn đề bài Vị trí của X: - Chu kì 3 (do có 3 lớp e) - Nhóm IIIA (do là nguyên tố p và có 3e lớp ngoài cùng) Đáp án C Câu hỏi 2 : Hai nguyên tố X và Y thuộc 2 ô liên tiếp trong bảng HTTH (cùng một chu kỳ). Tổng số hạt mang điện trong cả 2 nguyên tử X và Y là 66 hạt (biết ZX<ZY). Hai nguyên tố đó là:
Đáp án: A Phương pháp giải: - Hai nguyên tố X và Y thuộc 2 ô liên tiếp trong bảng HTTH (cùng một chu kỳ) (ZX<ZY): ZY-ZX = 1 - Tổng số hạt mang điện trong cả 2 nguyên tử X và Y là 66 hạt: 2ZX + 2ZY = 66 Lời giải chi tiết: X và Y thuộc 2 ô liên tiếp trong HTTH và cùng 1 chu kì => ZY – ZX = 1 (1) Tổng số hạt mang điện trong cả 2 nguyên tử X và Z là 66 => 2ZX + 2ZY = 66 => ZX + ZY = 33 (2) Giải hệ (1) và (2) => ZY = 17 và ZX = 16 => Đáp án A Câu hỏi 3 : Hai nguyên tố T và U thuộc cùng một nhóm A và nằm ở 2 chu kỳ liên tiếp. Tổng số protron trong cả hai nguyên tử nguyên tố là 32. Hai nguyên tố T và U lần lượt là (ZT< ZU):
Đáp án: B Phương pháp giải: - Hai nguyên tố T và U thuộc cùng một nhóm A và nằm ở 2 chu kỳ liên tiếp (ZT<ZU) : + TH1 : ZU – ZT = 8 + TH2 : ZU – ZT = 18 - Tổng số protron trong cả hai nguyên tử nguyên tố là 32: ZU + ZT =32 Lời giải chi tiết: Tổng số proton của 2 nguyên tử là 32 => ZU + ZT = 32 T và U thuộc cùng 1 nhóm A và nằm ở 2 chu kì kế tiếp xảy ra 2 TH TH1: ZU – ZT = 8 => ZU = 20 (Ca) và ZT = 12 (Mg) Thỏa mãn đề bài TH2: ZU – ZT = 18 => ZU = 25 (Mn) và ZT = 7 (N) U và T không thuộc cùng nhóm A (loại) => Đáp án B Câu hỏi 4 : X và Y (ZX<ZY) là hai nguyên tố thuộc cùng một nhóm A và hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số hạt proton của hai nguyên tử hai nguyên tố đó là 22. Nhận xét đúng về X,Y là
Đáp án: C Phương pháp giải: - Hai nguyên tố X và Y thuộc cùng một nhóm A và nằm ở 2 chu kỳ liên tiếp (ZX<ZY) : + TH1 : ZY – ZX = 8 + TH2 : ZY – ZX = 18 - Tổng số protron trong cả hai nguyên tử nguyên tố là 22: ZY + ZX = 22 Lời giải chi tiết: X và Y thuộc 2 chu kì liên tiếp trong nhóm A => Số proton của Y có thể hơn X 8 hoặc 18 proton ( Do tổng số proton 2 nguyên tử 2 nguyên tố = 22) +/ Nếu pX + 18 = pY => pX = 2 (He) ; pY = 20 (Ca) => Loại. +/ Nếu pX + 8 = pY => pX = 7 ; pY = 15 => X là Nito ; Y là Photpho. => Hợp chất X với Hidro là NH3 là phân tử phân cực. => Đáp án C Câu hỏi 5 : Hai nguyên tố X, Y thuộc cùng nhóm và ở hai chu kỳ liên tiếp nhau có tổng số số hiệu nguyên tử là 32. Vậy X, Y thuộc nhóm nào?
Đáp án: D Phương pháp giải: - Hai nguyên tố X và Y thuộc cùng một nhóm A và nằm ở 2 chu kỳ liên tiếp (ZX<ZY) : + TH1 : ZY – ZX = 8 + TH2 : ZY – ZX = 18 - Tổng số hiệu nguyên tử là 22: ZY + ZX = 32 Lời giải chi tiết: Giả sử px < py, ta có px + 8 = py => px + px + 8 = 32 => px = 12 => py = 20 (Mg và Ca) => Đáp án D Câu hỏi 6 : Nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Vị trí của X trong bảng hệ thống tuần hoàn là :
Đáp án: B Phương pháp giải: Viết cấu hình e sao cho tổng e ở phân lớp p là 8 => vị trí của X Lời giải chi tiết: Cấu hình e của X là 1s22s22p63s23p2 => có 14e nên ở ô số 14 => có 4e lớp ngoài cùng => nhóm IV A Có 3 lớp e => chu kì 3 => Đáp án B Câu hỏi 7 : X và Y là hai nguyên tố thuộc hai nhóm A liên tiếp của cùng 1 chu kì. Biết ZX < ZY và ZX + ZY = 31. Y thuộc nhóm VIA. Kết luận nào sau đây là đúng với X và Y?
Đáp án: C Phương pháp giải: Lời giải chi tiết: X và Y là hai nguyên tố thuộc hai nhóm A liên tiếp của cùng 1 chu kì → ZY - ZX = 1 Ta giải hệ: ZX + ZY = 31 và ZY - ZX = 1 → X là P và Y là S Cấu hình e của S: 1s22s22p63s23p4 Cấu hình e của P: 1s22s22p63s23p3 - A sai vì X, Y đều là phi kim - B sai vì Y có 2e độc thân - C đúng - D sai vì công thức oxit cao nhất là P2O5. Đáp án C Câu hỏi 8 : X và Y là 2 nguyên tố thuộc cùng nhóm nhóm IA trong bảng HTTH và ở 2 chu kỳ liên tiếp. Hoà tan hoàn toàn 7,35 gam hỗn hợp này vào nước (dư), sau phản ứng thu được được dung dịch Z và 2,8 lít H2 (đktc). X, Y là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Gọi A là công thức trung bình của X và Y PTHH: 2A + 2H2O → 2AOH + H2 0,25 ← 0,125 (mol) => MA = 7,35 : 0,25 = 29,4 Do X và Y thuộc cùng nhóm IA và ở 2 chu kì liên tiếp nên là Na (M = 23) và K (M = 39) Đáp án B Câu hỏi 9 : Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhỏ hơn tổng số hạt mang điện của X là 12. Các nguyên tố X và Y là :
Đáp án: B Phương pháp giải: Viết cấu hình e của nguyên tử nguyên tố X dựa vào dữ kiện tổng số e phân lớp p là 8 => nguyên tử nguyên tố X => nguyên tử nguyên tố Y Lời giải chi tiết: Cấu hình e của X: 1s22s22p63s23p2 ZX = 14 => X là Si => số hạt mang điện trong X là 28 => Số hạt mang điện trong Y là 16 => ZY = 8 => Y là Oxi Đáp án B Câu hỏi 10 : Nguyên tố X thuộc loại nguyên tố d, nguyên tử của X có 5 electron hoá trị và lớp electron ngoài cùng thuộc lớp 4. Cấu hình electron của X là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 11 : A và B là hai nguyên tố trong cùng một nhóm và ở hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số hạt proton trong hạt nhân của A và B là 32. Hai nguyên tố đó là:
Đáp án: A Phương pháp giải: Hai nguyên tố ở chu kì kế tiếp nhau trong bảng tuần hoàn có số hiệu nguyên tử hơn kém nhau 8 hoặc 18. HS xét từng trường hợp để tìm số hiệu nguyên tử Lời giải chi tiết: Do A,B thuộc cùng 1 nhóm và ở 2 chu kì liên tiếp => ZA – ZB = 2 hoặc 8 hoặc 18 hoặc 32 => Do ZA + ZB = 32 Mà ZA – ZB = 8 => ZA = 20 ; ZB = 12=> A là Mg và B là Ca Đáp án A Câu hỏi 12 : Hòa tan hoàn toàn 7,30 gam hỗn hợp hai kim loại kiềm X, Y (MX < MY) thuộc hai chu kì liên tiếp vào 200 gam nước thu được dung dịch Z và 7,84 lít khí hidro (đktc). Nồng độ phần trăm của YOH trong dung dịch Z là
Đáp án: A Phương pháp giải: Viết PTHH và tính toán theo PTHH. Lời giải chi tiết: Gọi công thức chung của 2 kim loại là M M + H2O → MOH + 0,5 H2 0,7 ← 0,35 (mol) M = 7,3/0,7 = 10,43 => Li và Na Đặt nLi = x; nNa = y (mol) \(\left\{ \begin{gathered} mdd sau phản ứng = mKL + mH2O – mH2 = 7,3 + 200 – 0,35.2 = 206,6 (g) \( \to C{\% _{NaOH}} = \frac{{0,15.40}}{{206,6}}.100\% = 2,904\% \) Đáp án A Câu hỏi 13 : Nguyên tố Y là phi kim thuộc chu kì 2 của BTH, Y tạo được hợp chất khí với hiđro và công thức oxit cao nhất là YO2. Hợp chất tạo bởi Y và kim loại M là MY2 trong đó Y chiếm 37,5% về khối lượng. M là
Đáp án: D Phương pháp giải: *Xác định Y: Y thuộc chu kì 2 => số lớp e Công thức oxit cao nhất của Y là YO2 => hóa trị của Y => nhóm => số e lớp ngoài cùng => Cấu hình e của Y và xác định Y *Xác định M: Từ % khối lượng Y trong hợp chất MY2 ta xác định được khối lượng mol của M => M Lời giải chi tiết: *Xác định Y: Y thuộc chu kì 2 => Y có 2 lớp e Công thức oxit cao nhất của Y là YO2 => Y có hóa trị IV => Y thuộc nhóm IVA => Y có 4e lớp ngoài cùng => Cấu hình e của Y: 1s22s22p2 => Y là Cacbon *Xác định M: Hợp chất MC2: \(\% {m_C} = \frac{{2.12}}{{M + 2.12}}.100\% = 37,5\% \to M = 40(Ca)\) Vậy M là Ca Đáp án D Câu hỏi 14 : Hai nguyên tố X, Y ở cùng nhóm A và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton của 2 nguyên tử thuộc hai nguyên tố là 44 (ZX <ZY). Vị trí của X trong bảng tuần hoàn là:
Đáp án: B Phương pháp giải: Hai nguyên tố X, Y ở cùng nhóm A và thuộc cùng hai chu kì liên tiếp trong bảng tuần hoàn. → ZY= ZX + 8 hoặc ZY= ZX + 18 Xét 2 trường hợp trên để tìm ZX và ZY. Từ đó xác định được vị trí của X trong bảng tuần hoàn. Lời giải chi tiết: Hai nguyên tố X, Y ở cùng nhóm A và thuộc cùng hai chu kì liên tiếp trong bảng tuần hoàn. → ZY= ZX + 8 hoặc ZY= ZX + 18 *TH1: Xét ZY= ZX + 8 Theo đề bài tổng số proton của 2 nguyên tử là 44 nên ZX + ZY = 44 Giải hệ ta có: ZX= 18 và ZY= 26 Cấu hình electron nguyên tử của Y là 1s22s22p63s23p63d64s2. Vậy Y thuộc nhóm VIB. Vậy trường hợp này loại vì theo đề bài X, Y ở cùng nhóm A. *TH2: Xét ZY= ZX + 18 Theo đề bài tổng số proton của 2 nguyên tử là 44 nên ZX + ZY = 44 Giải hệ ta có: ZX= 13, ZY= 31 Cấu hình electron của X là 1s22s22p63s23p1, vậy X thuộc chu kì 3, nhóm IIIA Cấu hình electron của Y là 1s22s22p63s23p63d104s23p1, vậy Y thuộc chu kì 4, nhóm IIIA Đáp án B Câu hỏi 15 : Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số điện tích hạt nhân là 29, biết ZX < ZY. Y thuộc chu kì và nhóm nào sau đây?
Đáp án: B Phương pháp giải: Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì nên ZY – ZX = 1 Từ đề bài lập hệ phương trình tìm ZX và ZY. Từ đó xác định vị trí của X và Y trong bảng tuần hoàn. Lời giải chi tiết: Giả sử: ZY > ZX, có: ZX + ZY = 29 (1) Vì X, Y đứng kế tiếp nhau trong một chu kì nên ZY – ZX = 1 (2) Giải hệ gồm (1) và (2) ta được: ZX = 14; ZY = 15 ZX = 14: 1s22s22p63s23p2 → chu kì 3, nhóm IVA ZY = 15: 1s22s22p63s23p3 → chu kì 3, nhóm VA Đáp án B Câu hỏi 16 : Hai nguyên tử của nguyên tố X và Y có cấu hình electron ở lớp ngoài cùng là 4pa và 4sb. Tổng số electron ở hai phân lớp ngoài cùng của X và Y là 7. Biết X không phải là khí hiếm. Vậy Y và X lần lượt là:
Đáp án: B Phương pháp giải: Tổng số electron ở hai phân lớp ngoài cùng của X và Y là 7 nên a + b= 7 với 1≤b≤6 và b = 1 hoặc b = 2 *TH1: Nếu b= 1 thì a = 6. *TH2: Nếu b= 2 thì a = 5. Xét 2 trường hợp trên để tìm X và Y phù hợp. Lời giải chi tiết: Tổng số electron ở hai phân lớp ngoài cùng của X và Y là 7 nên a + b= 7 với 1 ≤ a ≤ 6 và b = 1 hoặc b = 2 *TH1: Nếu b= 1 thì a = 6. Cấu hình electron của X là 1s22s22p63s23p63d104s24p6. X có 8 electron ở lớp ngoài cùng nên X là khí hiếm. Vậy trường hợp này loại. *TH2: Nếu b= 2 thì a = 5. Cấu hình electron của X là 1s22s22p63s23p63d104s24p5. Vậy X là nguyên tố Br. Cấu hình electron của Y là 1s22s22p63s23p64s2. Vậy Y là nguyên tố Ca. Đáp án B Câu hỏi 17 : Hai nguyên tố X và Y thuộc hai nhóm A kế tiếp nhau trong một chu kì có tổng số proton trong hai hạt nhân nguyên tử là 51. Số hiệu nguyên tử của X và Y lần lượt là:
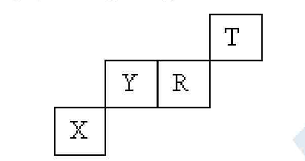
Đáp án: B Phương pháp giải: Giả sử: ZY > ZX, có: ZX + ZY = 51 (1) Vì X, Y đứng kế tiếp nhau trong một chu kì nên có 2 trường hợp: TH1: ZY – ZX = 1 (2) TH2: ZY – ZX = 11 (3) Xét 2 trường hợp trên để xác định trường hợp thỏa mãn. Lời giải chi tiết: Giả sử: ZY > ZX, có: ZX + ZY = 51 (1) Vì X, Y đứng kế tiếp nhau trong một chu kì nên có 2 trường hợp: TH1: ZY – ZX = 1 (2) Giải hệ gồm (1) và (2) ta được: ZX = 25; ZY = 26 ZX = 25: 1s22s22p63s23p63d54s2→ chu kì 4, nhóm VII B ZY = 26: 1s22s22p63s23p63d64s2 → chu kì 4, nhóm VIIIB Trường hợp này loại vì 2 nguyên tố X, Y thuộc nhóm B , còn đề bài cho 2 nguyên tố X và Y thuộc nhóm A. TH2: ZY – ZX = 11 (3) Giải hệ gồm (1) và (3) ta được: ZX = 20; ZY = 31 ZX = 20: 1s22s22p63s23p64s2→ chu kì 4, nhóm IIA ZY = 31: 1s22s22p63s23p63d104s24p1 → chu kì 4, nhóm IIIA Trường hợp 2 cả 2 nguyên tố X và Y thuộc nhóm A nên thỏa mãn. Số hiệu nguyên tử của X và Y lần lượt là 20 và 31. Đáp án B Câu hỏi 18 : Vị trí các nguyên tố X, Y, R, T trong bảng tuần hoàn như sau:
X có cấu hình electron lớp ngoài cùng là 4s24p2. Tổng số proton của 3 nguyên tử X, R, T là:
Đáp án: B Phương pháp giải: Dựa vào vị trí của X, Y, R, T để tìm cấu hình electron của các nguyên tử. Từ đó xác định được tổng số proton của 3 nguyên tử X, R, T. Lời giải chi tiết: Vì X có cấu hình electron lớp ngoài cùng là 4s24p2 nên cấu hình electron đầy đủ của X là 1s22s22p63s23p63d104s24p2. Vậy nguyên tử X có 32 electron, 32 proton. Nguyên tố X thuộc nhóm IVA. Gọi nguyên tố Z là nguyên tố cùng nhóm với X và đứng ngay trước nguyên tố Y. Vì X và Z thuộc cùng nhóm và nằm ở 2 chu kì liên tiếp nên xét các trường hợp: TH1: nguyên tố Z có 32- 8= 24 electron. Cấu hình electron nguyên tử của Z là 1s22s22p63s23p63d54s1. Nguyên tố Z thuộc nhóm VIB. Vậy trường hợp này loại. TH2: nguyên tố Z có 32- 18 = 14 electron. Cấu hình electron nguyên tử của Z là 1s22s22p63s23p2. Nguyên tố Z thuộc nhóm IVA. Vậy trường hợp 2 thỏa mãn. Nguyên tố Z đứng ngay trước nguyên tố Y nên Y có số hiệu nguyên tử là 14 + 1= 15 Suy ra số proton của nguyên tử Y bằng 15. Nguyên tố Y đứng ngay trước nguyên tố R nên R có số hiệu nguyên tử là 15 + 1= 16 Suy ra số proton của nguyên tử R bằng 16. Gọi Q là nguyên tố thuộc cùng nhóm với nguyên tố R và đứng trước nguyên tố T Suy ra số hiệu nguyên tử Q bằng 16 – 8= 8 và số hiệu nguyên tử nguyên tố T là 8 + 1= 9 Tổng số proton của 3 nguyên tử X, R, T là: 32 + 16 + 9= 57 Đáp án B Câu hỏi 19 : X và Y là 2 nguyên tố nằm trong 2 nhóm A kế tiếp nhau trong bảng tuần hoàn dạng ngắn. X thuộc nhóm VIIA. Tổng số hạt proton trong 2 hạt nhân của X và Y là 25 (biết ZX < ZY). Biết X tác dụng được với Y. Các nguyên tố X, Y tương ứng là:
Đáp án: C Phương pháp giải: Vì X thuộc nhóm VIIA nên Y thuộc nhóm VIA Ta có: PX + PY= 25 Từ đó xác định được số hiệu nguyên tử của X và Y và xác định được tên của X và Y. Lời giải chi tiết: Vì X thuộc nhóm VIIA nên Y thuộc nhóm VIA Ta có: PX + PY= 25 → X là F (Z= 9) và Y là S (Z=16) hoặc X là Cl (Z=17) và Y là O (Z=8) Vì X tác dụng được với Y nên X là F và Y là S. Đáp án C Câu hỏi 20 : Nguyên tử của hai nguyên tố X và Y có tổng số electron lớp ngoài cùng bằng 12. Ở trạng thái cơ bản, số electron p của X nhiều hơn của Y là 8. Biết nguyên tử của nguyên tố X có 3 lớp electron và Y có số lớp electron ít hơn X. Phát biểu nào sau đây đúng?
Đáp án: B Phương pháp giải: Vì tổng số electron lớp ngoài cùng của X và Y bằng 12 → 2 + 8 < số electron ở lớp ngoài cùng = 12 < 8.2=16 nên X và Y đều có electron lớp ngoài cùng đang điền trên phân lớp p. Suy ra cấu hình electron của X, Y là: X: 1s22s22p63s23pa Y: 1s22s22pb Từ đề bài xác định các giá trị a và b. Từ đó tìm được phát biểu đúng. Lời giải chi tiết: Vì tổng số electron lớp ngoài cùng của X và Y bằng 12 → 2 + 8 < số electron ở lớp ngoài cùng = 12 < 8.2=16 nên X và Y đều có electron lớp ngoài cùng đang điền trên phân lớp p. Suy ra cấu hình electron của X, Y là: X: 1s22s22p63s23pa Y: 1s22s22pb Suy ra (2+a) + (2+b)= 12 và 6 + a = b+8 Giải hệ trên ta có a = 5 và b = 3 Vậy X thuộc nhóm VIIA và Y thuộc nhóm VA Đáp án B Quảng cáo
|