30 bài tập vận dụng về sự biến đổi tuần hoàn tính chất các nguyên tố hóa học có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Cho 3 nguyên tố X, Y, Z lần lượt có số hiệu nguyên tử là 9, 16, 17. Dãy sắp xếp theo chiều tăng dần tính phi kim là:
Đáp án: D Phương pháp giải: - Viết cấu hình e của nguyên tử mỗi nguyên tố - Xác định vị trí tương đối của chúng trong bảng tuần hoàn - Dựa vào quy luật biến đổi tính phi kim để sắp xếp Lời giải chi tiết: Cấu hình e của X: 1s22s22p5 Cấu hình e của Y: 1s22s22p63s23p4 Cấu hình e của Z: 1s22s22p63s23p5 Dễ thấy X và Z thuộc cùng nhóm A => tính phi kim của X > Z Y và Z cùng thuộc 1 chu kì => tính phi kim của Y < Z => Y < Z < X Đáp án D Câu hỏi 2 : Nguyên tố X có công thức của hợp chất khí với hidro là RH3. Trong oxit cao nhất của nó, X chiếm 25,93% về khối lượng. Vậy X là:
Đáp án: A Phương pháp giải: Nguyên tố X có công thức của hợp chất khí với hidro là RH3 => công thức oxit cao nhất là R2O5 Dựa vào %mO tính được R Lời giải chi tiết: Hợp chất với Hiđro là RH3 => Hợp với oxi là: R2O5 Ta có: \(\% {m_R} = \frac{{2R}}{{2R{\rm{ }} + {\rm{ }}16.5}}.100\% = \;25,93\% \to R = 14\) => R là nguyên tố Nitơ Đáp án A Câu hỏi 3 : Hợp chất với hiđro của nguyên tố có công thức XH3. Biết % về khối lượng của oxi trong oxit cao nhất của X là 56,34%. Nguyên tử khối của X là .
Đáp án: C Phương pháp giải: Nguyên tố X có công thức của hợp chất khí với hidro là XH3 => công thức oxit cao nhất là X2O5 Dựa vào %mO tính được X Lời giải chi tiết: Hợp chất với hiđro của nguyên tố có công thức XH3 => Hợp chất với oxi có công thức X2O5 \(\% {m_O} = \frac{{16.5}}{{2X{\rm{ }} + {\rm{ }}16.5}}.100\% = \;56,34\% \to X = 31\) Đáp án C Câu hỏi 4 : Nguyên tử của nguyên tố R có cấu hình electron lớp ngoài cùng là ns2np2. Phần trăm khối lượng của R trong oxit cao nhất là 46,67%. Phát biểu nào sau đây là đúng?
Đáp án: D Phương pháp giải: R có cấu hình electron lớp ngoài cùng là ns2np2=> R thuộc nhóm IVA => Oxit cao nhất là RO2 Lời giải chi tiết: R có cấu hình electron lớp ngoài cùng là ns2np2=> R thuộc nhóm IVA => oxit cao nhất có công thức RO2 %O trong oxit = 100% - 46,67% = 53,33% => M RO2 = 32 : 53,33% = 60 g/mol => R là Silic (Si) Cấu hình e 1s22s22p63s23p2 ở trạng thái cơ bản có 2 e độc thân thuộc chu kì 3, ở điều kiện thường oxit cao nhất là chất rắn Đáp án D Câu hỏi 5 : Cho X, Y, R, T là các nguyên tố khác nhau trong số bốn nguyên tố: 12Mg, 13Al, 19K, 20Ca và các tính chất được ghi trong bảng sau:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Từ trên xuống dưới trong 1 nhóm, bán kính nguyên tử tăng dần => Ca > Mg Trong cùng 1 chu kỳ thì từ trái sang phải, bán kính nguyên tử giảm => K > Ca và Mg > Al => K > Ca > Mg > Al <=> R > X > T > Y Câu hỏi 6 : Cho các nguyên tố : K( Z = 19), N (Z = 7), Si ( Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Ta có cấu hính e của cắc nguyên tố là K : [Ar]4s1 N : 1s22s22p3 Si [Ne]3s23p2 Mg [Ne]3s2 Trong cùng một phân nhóm thì theo chiểu tăng ĐTHN thì bán kính tăng dần bên bk của K > bán kính của một nguyên tố X có cấu hình e [Ne]3s1 Trong cùng 1 chu kì thì theo chiều tăng ĐTHN thì bán kính giảm dần nên bk của X >Mg>Si Lấy Y có nguyên tố có cấu hình e 1s22s22p2 thì nó cùng chu kì với N nên có bán kình lớn hơn N Mà Y cùng thuộc phân nhóm với Si nên bán kính của Y < Si Vậy K>X>Mg>Si>Y>N Đáp án C Câu hỏi 7 : Cho các nguyên tố : K ( Z = 19), Na ( Z = 11), Al (Z = 13), Si (Z = 14).Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần tính kim loại là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Ta có cấu hính e của cắc nguyên tố là K : [Ar]4s1 Ne : [Ne]3s1 Si [Ne]3s23p2 Al [Ne]3s23p1 Trong cùng một phân nhóm thì theo chiểu tăng ĐTHN thì tính kim loại tăng dần nên tính kim loại của K > nguyên tố Na có cấu hình e [Ne]3s1 Trong cùng 1 chu kì thì theo chiều tăng ĐTHN thì tính kim lại giảm dần nên tính kl của Na>Al>Si Vậy K>Na>Al>Si Đáp án A Câu hỏi 8 : R có hóa trị cao nhất với Oxi bằng hóa trị cao nhất với Hiđro. Hợp chất khí của R với Hiđro (R có hóa trị cao nhất) chứa 25% H về khối lượng. R là nguyên tố:
Đáp án: A Phương pháp giải: Với 1 nguyên tố ta luôn có: Hóa trị cao nhất với oxi + hóa trị với hidro = 8 Từ giữ kiện này tìm được hóa trị của R với oxi và hidro → công thức hợp chất với Hidro = ? có %H trong hợp chất , lập phương trình tìm được MR = ? Lời giải chi tiết: Đặt hóa trị của R cao nhất với Oxi là a → hóa trị của R cao nhất với Hidro là a Với 1 nguyên tố ta luôn có: Hóa trị cao nhất với oxi + hóa trị với hidro = 8 → a + a = 8 → a = 4 Vậy hóa trị của R với Hidro là 4 → công thức hợp chất với Hidro là: RH4 Theo bài, trong RH4 thì %H = 25% nên ta có: \(\% H = \frac{{{m_H}}}{{{m_{R{H_4}}}}}.100\% \Rightarrow \frac{{4.1}}{{{M_R} + 4.1}}.100\% = 25\% \Rightarrow {M_R} = 12\) MR = 12 → R là nguyên tố Cacbon. Đáp án A Câu hỏi 9 : Nguyên tố X có công thức oxit cao nhất là XO2, trong đó tỉ lệ khối lượng của X và O là 3/8. Công thức của XO2 là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A XO2 : tỉ lệ khối lượng của X và O là 3/8 ð ð X là C Lưu Ý . tỉ lệ về khối lượng phải đúng theo công thức . Công thức có 2 nguyên tố oxy thì khối lượng cũng phải có 2 oxy Câu hỏi 10 : X, Y, Z là các nguyên tố thuộc cùng một chu kì của bảng hệ thống tuần hoàn. Oxit của X tan trong nước tạo thành dung dịch làm hồng giấy quỳ tím. Y phản ứng với nước tạo thành dung dịch làm xanh giấy qùy tím. Z phản ứng được với cả axit lẫn kiềm. Nếu các nguyên tố được sắp xếp theo thứ tự tăng dần số hiệu nguyên tử thì thứ tự đúng sẽ là:
Đáp án: B Phương pháp giải: Từ đề bài xác định tính axit, bazo của các oxit của X, Y, Z. Từ đó xác định được thứ tự tăng dần số hiệu nguyên tử. Lời giải chi tiết: Oxit của X tan trong nước tạo thành dung dịch làm hồng giấy quỳ tím nên oxit của X có tính axit. Y phản ứng với nước tạo thành dung dịch làm xanh giấy qùy tím nên oxit của Y có tính bazơ. Z phản ứng được với cả axit lẫn kiềm nên oxit của Z có tính lưỡng tính. Trong cùng 1 chu kì, tính axit tăng theo thứ tự: oxit của Y < oxit của Z < oxit của X Theo định luật tuần hoàn, trong một chu kì, đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân: tính axit của hiđroxit tăng dần. Vậy số hiệu nguyên tử tăng theo thứ tự Y, Z, X. Đáp án B Câu hỏi 11 : Cho các nguyên tố sau ở cùng chu kì 3: Na (Z=11), S (Z=16) và Cl (Z=17). Độ âm điện của ba nguyên tố trên (đã bị đảo lộn) là: 3,16; 2,58; 0,93. Gắn các nguyên tố với độ âm điện đúng của chúng được kết quả như sau:
Đáp án: B Phương pháp giải: Từ số hiệu nguyên tử suy ra vị trí của các nguyên tố trên trong bảng tuần hoàn. Từ đó dựa vào quy luật biến đổi tuần hoàn độ âm điện của các nguyên tố theo chu kì để gắn các nguyên tố với độ âm điện đúng của chúng. Lời giải chi tiết: Cấu hình electron nguyên tử và vị trí của các nguyên tố lần lượt là: Na (Z=11):1s22s22p63s1 → Na thuộc chu kì 3, nhóm IA S (Z=16):1s22s22p63s23p4 → S thuộc chu kì 3, nhóm VIA Cl (Z=17):1s22s22p63s23p5 → Cl thuộc chu kì 3, nhóm VIA Theo định luật tuần hoàn: Trong cùng 1 chu kì, đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân thì độ âm điện của các nguyên tố tăng dần. Vì các nguyên tố Na, S, Cl đều thuộc chu kì 3, sắp xếp theo chiều tăng dần của điện tích hạt nhân nên độ âm điện tăng dần từ Na đến S và đến Cl. Do đó độ âm điện tương ứng của các nguyên tố là:Na: 0,93; S : 2,58; Cl : 3,16. Đáp án B Câu hỏi 12 : Những đại lượng và tính chất nào của nguyên tố hóa học sau đây biến đổi tuần hoàn theo chiều tăng của hạt nhân nguyên tử? 1) Khối lượng nguyên tử 2) Bán kính nguyên tử 3) Tính kim loại, tính phi kim 4) Năng lượng ion hóa thứ nhất 5) Tính axit- bazơ của các hiđroxit 6) Cấu hình electron lớp ngoài cùng
Đáp án: C Phương pháp giải: Dựa vào định luật tuần hoàn để xác định các đại lượng và tính chất của nguyên tố biến đổi tuần hoàn. Lời giải chi tiết: Những đại lượng và tính chất của nguyên tố hóa học biến đổi tuần hoàn theo chiều tăng của hạt nhân nguyên tử là: 2) Bán kính nguyên tử 3) Tính kim loại, tính phi kim 4) Năng lượng ion hóa thứ nhất 5) Tính axit- bazơ của các hiđroxit 6) Cấu hình electron lớp ngoài cùng Đáp án C Câu hỏi 13 : Hợp chất khí với hiđro của một nguyên tố là RH4. Oxit cao nhất của nó chứa 72,72% oxi về khối lượng. Tìm nguyên tố đó?
Đáp án: A Phương pháp giải: Từ công thức hợp chất khí với H, suy ra vị trí của R trong bảng tuần hoàn. Từ đó xác định công thức oxit cao nhất. Từ %oxi về khối lượng ta xác định được nguyên tử khối của R và tên của R. Lời giải chi tiết: Hợp chất khí với hiđro của một nguyên tố là RH4 nên R thuộc nhóm IVA. → Công thức oxit cao nhất là RO2 Vì oxit cao nhất của nó chứa 72,27% oxi về khối lượng nên ta có: \({{32} \over {32 + R}}.100\% = 72,72\% \) →R= 12 → R là nguyên tố cacbon. Đáp án A Câu hỏi 14 : Công thức oxit cao nhất của nguyên tố R là R2O7. Hợp chất khí của nguyên tố này với H chứa 97,26% R về khối lượng. Nguyên tố R là:
Đáp án: D Phương pháp giải: Từ công thức oxit cao nhất suy ra vị trí của R trong bảng tuần hoàn, từ đó xác định được công thức hợp chất khí với H. Từ %R trong hợp chất khí suy ra tên nguyên tố R. Lời giải chi tiết: Công thức oxit cao nhất của nguyên tố R là R2O7 nên R thuộc nhóm VIIA → Công thức hợp chất khí với H là RH. Hợp chất khí của nguyên tố này với H chứa 97,26% R về khối lượng nên ta có: \({R \over {R + 1}}.100\% = 97,26\% \) Giải phương trình trên ta có: R= 35,5 → R là Cl. Đáp án D Câu hỏi 15 : Nguyên tử nguyên tố R có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố R với hiđro, R chiếm 94,12% về khối lượng. Phần trăm khối lượng của nguyên tố R trong oxit cao nhất là:
Đáp án: D Phương pháp giải: Từ cấu hình electron suy ra vị trí của R trong bảng tuần hoàn, từ đó viết được công thức hợp chất khí với hiđro. Từ %R trong hợp chất khí với hiđro ta xác định được R. → Phần trăm khối lượng của nguyên tố R trong oxit cao nhất. Lời giải chi tiết: Nguyên tử nguyên tố R có cấu hình electron lớp ngoài cùng là ns2np4 nên R thuộc nhóm VIA → Công thức hợp chất với H là RH2. Trong hợp chất khí của nguyên tố R với hiđro, R chiếm 94,12% về khối lượng nên ta có: \({R \over {R + 2}}.100\% = 94,12\% \) Giải ra được R= 32 → R là lưu huỳnh. Mặt khác do lưu huỳnh thuộc nhóm VIA nên công thức oxit cao nhất là SO3. →%S= 40% Đáp án D Câu hỏi 16 : Công thức phân tử của hợp chất khí tạo bởi nguyên tố X và hiđro là XH3. Trong oxit mà X có hóa trị cao nhất thì X chiếm 43,66% về khối lượng. Nguyên tố X là:
Đáp án: D Phương pháp giải: Từ công thức hợp chất khí với H, suy ra vị trí của X trong bảng tuần hoàn. Từ đó xác định công thức oxit cao nhất. Từ %X về khối lượng ta xác định được nguyên tử khối của X và tên của X. Lời giải chi tiết: Hợp chất khí với hiđro của một nguyên tố là XH3 nên X thuộc nhóm VA. → Công thức oxit cao nhất là X2O5. Trong oxit mà X có hóa trị cao nhất thì X chiếm 43,66% về khối lượng. Ta có: \({{2X} \over {2X + 80}}.100\% = 43,66\% \) Giải ra X = 31→ X là photpho. Đáp án D Câu hỏi 17 : Hợp chất khí với hiđro của nguyên tố R là RH3. Tỉ lệ về khối lượng giữa hợp chất khí với hiđro và oxit cao nhất của R là 17:71. Tìm tên nguyên tố R.
Đáp án: B Phương pháp giải: Từ công thức hợp chất khí với H, suy ra vị trí của R trong bảng tuần hoàn. Từ đó xác định công thức oxit cao nhất. Từ tỉ lệ về khối lượng giữa hợp chất khí với hiđro và oxit cao nhất của R là 17:71 tìm được nguyên tử khối của R và tên nguyên tố R. Lời giải chi tiết: Hợp chất khí với hiđro của nguyên tố R là RH3 → R thuộc nhóm VA của bảng tuần hoàn. → Công thức oxit cao nhất là R2O5. Vì tỉ lệ về khối lượng giữa hợp chất khí với hiđro và oxit cao nhất của R là 17:71 nên ta có: \({{R + 3} \over {2R + 16.5}} = {{17} \over {71}}\) Giải phương trình trên ta có: R= 31 → R là photpho. Đáp án B Câu hỏi 18 : Nguyên tố R có công thức oxit cao nhất là RO3, trong đó oxi chiếm 60% về khối lượng. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là:
Đáp án: D Phương pháp giải: Từ %O trong oxit cao nhất, tìm được tên của R và vị trí của R trong bảng tuần hoàn. Lời giải chi tiết: Nguyên tố R có công thức oxit cao nhất là RO3, trong đó oxi chiếm 60% về khối lượng. \( \Rightarrow {{16.3} \over {R + 16.3}}.100\% = 60\% \) Giải ta ta có R= 32. Mà R thuộc nhóm VIA → R là lưu huỳnh có Z = 16 Cấu hình electron của S là 1s22s22p63s23p4 → S thuộc ô 16, chu kì 3, nhóm VIA. Đáp án D Câu hỏi 19 : Nguyên tố Y là phi kim thuộc chu kì 3, có công thức oxit cao nhất là YO3. Nguyên tố Y tạo với kim loại M hợp chất có công thức MY, trong đó M chiếm 63,64% về khối lượng. Kim loại M là:
Đáp án: D Phương pháp giải: Từ vị trí của Y và oxit cao nhất của Y để xác định tên nguyên tố Y. Từ % khối lượng của M trong hợp chất MY ta xác định được nguyên tử khối của M và tên của M. Lời giải chi tiết: Oxit cao nhất là YO3 suy ra hóa trị cao nhất bằng 6 → Y thuộc nhóm VIA Mặt khác Y là phi kim thuộc chu kì 3 nên Y là lưu huỳnh. Hợp chất MS có %S= 100%- 63,64%= 36,36% Ta có: \({{\% M} \over {\% S}} = {M \over {32}} = {{63,64} \over {36,36}} \to M = 56(Fe)\) Đáp án D Câu hỏi 20 : Hợp chất với hiđro của nguyên tố X có công thức XH3. Biết % về khối lượng của oxi trong oxit cao nhất của X là 56,34%. Nguyên tử khối của X là:
Đáp án: B Phương pháp giải: Từ công thức hợp chất khí với H, suy ra vị trí của X trong bảng tuần hoàn. Từ đó xác định công thức oxit cao nhất. Từ %X về khối lượng ta xác định được nguyên tử khối của X. Lời giải chi tiết: Hợp chất khí với hiđro của một nguyên tố là XH3 nên X thuộc nhóm VA. → Công thức oxit cao nhất là X2O5. Trong oxit mà X có hóa trị cao nhất thì oxi chiếm 56,34% về khối lượng. Ta có: \({{16.5} \over {2X + 80}}.100\% = 56,34\% \) Giải ra X = 31. Đáp án B Câu hỏi 21 : Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np5. Trong oxit mà X có hóa trị cao nhất thì oxi chiếm 61,2%. Xác định nguyên tố X.
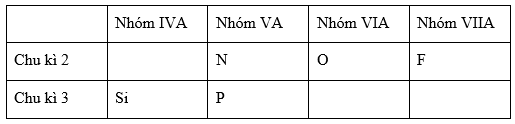
Đáp án: B Phương pháp giải: Từ cấu hình electron lớp ngoài cùng xác định được nhóm của nguyên tố X. Từ đó xác định được công thức oxit cao nhất. Từ %oxi trong công thức oxit cao nhất ta xác định được nguyên tử khối và tên của X. Lời giải chi tiết: Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np5 nên X thuộc nhóm VIIA → Công thức oxit cao nhất lả R2O7. Trong oxit mà X có hóa trị cao nhất thì oxi chiếm 61,2% nên ta có: \({{16.7} \over {2X + 16.7}}.100\% = 61,2\% \) Giải ra ta có X= 35,5. Vậy X là Clo. Đáp án B Câu hỏi 22 : Cho dãy các nguyên tố: 8O, 9F, 14Si, 15P. Sắp xếp các nguyên tố theo chiều giảm dần tính phi kim là:
Đáp án: A Phương pháp giải: Dựa vào quy luật biến đổi tính phi kim trong 1 chu kì và trong 1 nhóm. Lời giải chi tiết: 8O: 1s22s22p4 9F: 1s22s22p5 14Si: 1s22s22p63s23p2 15P: 1s22s22p63s23p3 Ta bổ sung thêm nguyên tố N thuộc chu kì 2, nhóm VA. Ta có bảng tuần hoàn rút gọn như sau
Trong cùng 1 chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân tính phi kim của các nguyên tố tăng dần nên Trong cùng chu kì 2: tính phi kim N <O < F. Trong cùng chu kì 3: tính phi kim Si <P Trong cùng 1 nhóm A, khi đi từ trên xuống dưới theo chiều tăng dần của điện tích hạt nhân tính phi kim của các nguyên tố giảm dần nên tính phi kim N > P Vậy từ các so sánh trên ta có tính phi kim: Si <P<N<O<F. Sắp xếp các nguyên tố theo chiều giảm dần tính phi kim là: F, O, P, Si. Đáp án A Câu hỏi 23 : Oxit cao nhất của nguyên tố hoá học R ( thuộc nhóm A) là R2O5 .Trong hợp chất khí với hiđro của R thì hiđro chiếm 8,82 % theo khối lượng . Xác định tên nguyên tố R . Phương pháp giải: Dựa vào công thức oxit cao nhất để xác định vị trí của R trong bảng tuần hoàn. Từ đó viết được công thức hợp chất khí với hiđro. Từ %H trong công thức hợp chất khí với hidro để xác định nguyên tố R. Lời giải chi tiết: Oxit cao nhất của nguyên tố hoá học R ( thuộc nhóm A ) là R2O5 nên R thuộc nhóm VA. → Công thức hợp chất khí với hiđro của RH3. Ta có %H= 3/(R + 3)=8,82/100. Suy ra R=31. R là Photpho (KH: P) Câu hỏi 24 : Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố X với hiđro, X chiếm 94,12% khối lượng. Nguyên tố X là:
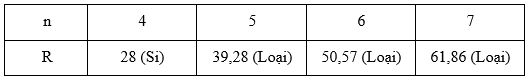
Đáp án: B Phương pháp giải: Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4 → Nguyên tố X thuộc nhóm VIA → Công thức hợp chất khí của nguyên tố X với hiđro là XH2. Từ %X trong hợp chất XH2 ta tìm được nguyên tử khối của X và tên của X. Lời giải chi tiết: Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4 → Nguyên tố X thuộc nhóm VIA → Công thức hợp chất khí của nguyên tố X với hiđro là XH2. Trong hợp chất khí của nguyên tố X với hiđro, X chiếm 94,12% khối lượng nên ta có biểu thức: \(\frac{X}{{X + 2}}.100\% = 94,12\% \) → X = 32 → X là lưu huỳnh. Đáp án B Câu hỏi 25 : Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro và trong oxit cao nhất tương ứng là a% và b%, với a : b = 15 : 8. Xác định nguyên tố R?
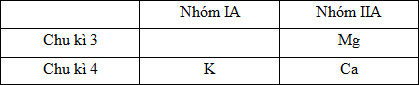
Đáp án: A Phương pháp giải: Giả sử nguyên tố R thuộc nhóm nA. Vì nguyên tố R tạo hợp chất khí với hiđro nên 4 ≤n≤7 Công thức hợp chất khí với hiđro của nguyên tố R là RH8-n Công thức oxit cao nhất của nguyên tố R là R2On Từ tỉ lệ phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro và trong oxit cao nhất ta biện luận tìm nguyên tử khối của R và tên của R. Lời giải chi tiết: Giả sử nguyên tố R thuộc nhóm nA. Vì nguyên tố R tạo hợp chất khí với hiđro nên 4 ≤ n ≤7 Công thức hợp chất khí với hiđro của nguyên tố R là RH8-n \(\% R = \frac{R}{{R + 8 - n}}.100\% = a\% \) Công thức oxit cao nhất của nguyên tố R là R2On \(\% R = \frac{{2R}}{{2R + 16n}}.100\% = b\% \) Theo đề bài a : b = 15 : 8 nên ta có: \(\frac{R}{{R + 8 - n}}:\frac{{2R}}{{2R + 16n}} = 15:8\) \(\begin{array}{l} Vì 4 ≤ n ≤7 nên ta xét:
Vậy R là nguyên tố Si. Đáp án A Câu hỏi 26 : Sắp xếp các nguyên tố sau theo chiều tính kim loại tăng dần (có giải thích): 20Ca; 19K; 12Mg Phương pháp giải: - Viết cấu hình electron để xác định vị trí của các nguyên tố trong bảng tuần hoàn. - Vận dụng quy luật biến đổi tính kim loại trong 1 chu kì và 1 nhóm A để sắp xếp các nguyên tố theo chiều tăng tính kim loại. Lời giải chi tiết: Cấu hình electron nguyên tử của các nguyên tố: 20Ca: 1s22s22p63s23p64s2 → Ca ở ô số 20, chu kì 4, nhóm IIA 19K: 1s22s22p63s23p64s1 → K ở ô số 19, chu kì 4, nhóm IA 12Mg: 1s22s22p63s2 → Mg ở ô số 12, chu kì 3, nhóm IIA Vậy có thể viết các nguyên tố vào bảng tuần hoàn dạng rút gọn như sau:
- Trong cùng 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm nên ta có tính kim loại: K > Ca. - Trong cùng 1 nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng nên ta có tính kim loại: Mg < Ca. Vậy từ đó ta có tính kim loại Mg < Ca < K. Câu hỏi 27 : Nguyên tố Cabon tạo với kim loại R một hợp chất trong đó R có số oxi hóa +3 và R chiếm 75% về khối lượng. Kim loại R là
Đáp án: D Phương pháp giải: Hợp chất của cacbon với R, trong đó R có số oxi hóa +3 → R có hóa trị III → Công thức hợp chất là R4C3 Lập phương trình với phần trăm R từ đó tìm được R Lời giải chi tiết: Cacbon có hóa trị IV Hợp chất của cacbon với R, trong đó R có số oxi hóa +3 → R có hóa trị III → Công thức hợp chất là R4C3 Ta có: \(\% R = {{4R} \over {4R + 3.12}}.100\% = 75\% \Rightarrow R = 27\) → R là kim loại Nhôm Đáp án D Câu hỏi 28 : Tổng số hạt trong nguyên tố R là 34 hạt, trong đó số hạt mang điện ít hơn số hạt không mang điện trong hạt nhân là 1 hạt. Công thức hidroxit của R là
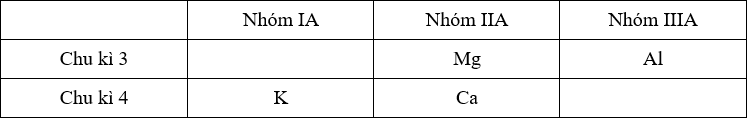
Đáp án: A Phương pháp giải: Lập hệ 2 ẩn với số p và số n dựa vào dữ kiện tổng số hạt là 34 và trong hạt nhân có số n hơn số p 1 hạt => giải được p và n. Từ đó xác định được R và suy ra được công thức hidroxit của R Lời giải chi tiết: Đặt số proton, notron của R lần lượt là p và n Nguyên tử trung hòa về điện nên số e = số p Có hệ: \(\left\{ \matrix{ Số khối A = p + n = 11 + 12 = 23 → R là Na → Công thức hidroxit là NaOH Đáp án A Câu hỏi 29 : Cho 3 nguyên tố X, Y, T. Trong đó X, Y thuộc cùng chu kì. - Hợp chất XH3 có chứa 8,82% khối lượng hiđro. - X kết hợp với T tạo ra hợp chất X2T5, trong đó T chiếm 56,34% về khối lượng. -Y kết hợp với T tạo thành hợp chất YT2, trong đó Y chiếm 50% về khối lượng. Xếp các nguyên tố X, Y, T theo chiều tăng dần tính phi kim là:
Đáp án: B Phương pháp giải: Từ % các nguyên tố trong các hợp chất trên ta tìm được tên của X, Y, T. Từ đó so sánh tính phi kim của các nguyên tố trong chu kì và nhóm để sắp xếp các nguyên tố X, Y, T theo chiều tăng dần tính phi kim. Lời giải chi tiết: Ta có: Hợp chất XH3: \({{\% X} \over {\% H}} = {X \over {1.3}} = {{100 - 8,82} \over {8,82}} \to X = 31(photpho)\) → X thuộc chu kì 3, nhóm VA Hợp chất P2T5: \({{\% T} \over {\% P}} = {{5.T} \over {2.31}} = {{56,34} \over {100 - 56,34}}\) → T=16 (oxi) → T thuộc chu kì 2, nhóm VIA Hợp chất YO2: \({{\% Y} \over {\% O}} = {Y \over {2.16}} = {{50} \over {100 - 50}}\) → Y=32 (Lưu huỳnh) →Y thuộc chu kì 3, nhóm VIA Tính phi kim: O > S (cùng nhóm VIA) Tính phi kim: S > P (cùng chu kì 3) Đáp án B Câu hỏi 30 : Cho X, Y, Z, T là các nguyên tố khác nhau trong 4 nguyên tố: 13Al, 12Mg, 19K, 20Ca. Bán kính nguyên tử của chúng được ghi trong bảng sau:
Phát biểu nào sau đây đúng?
Đáp án: A Phương pháp giải: Từ số hiệu nguyên tử, viết cấu hình electron nguyên tử để xác định vị trí của các nguyên tố trong bảng tuần hoàn sau đó dựa vào quy luật biến đổi bán kính nguyên tử trong 1 chu kì và trong 1 nhóm A để xác định X, Y, Z, T là các nguyên tố nào. + Trong 1 chu kì, đi từ trái sang phải theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần. + Trong 1 nhóm A, đi từ trên xuống dưới theo chiều tăng dần của điện tích hạt nhân thì bán kính nguyên tử tăng dần Lời giải chi tiết: Cấu hình electron và vị trí của các nguyên tố trong bảng tuần hoàn là: 13Al: 1s22s22p33s23p1 → Al thuộc chu kì 3, nhóm IIIA 12Mg: 1s22s22p33s2 → Mg thuộc chu kì 3, nhóm IIA 19K: 1s22s22p33s23p64s1 → K thuộc chu kì 4, nhóm IA 20Ca: 1s22s22p33s23p64s2 → Ca thuộc chu kì 4, nhóm IIA Ta có bảng tuần hoàn rút gọn như sau:
- Trong 1 chu kì, đi từ trái sang phải theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần. Do đó: + Với chu kì 3: bán kính nguyên tử của Mg > Al (1) + Với chu kì 4: bán kính nguyên tử của K > Ca (2) - Trong 1 nhóm A, đi từ trên xuống dưới theo chiều tăng dần của điện tích hạt nhân thì bán kính nguyên tử tăng dần nên trong nhóm IIA thì bán kính nguyên tử của Ca > Mg (3) Từ (1), (2), (3) suy ra bán kính nguyên tử của K > Ca > Mg > Al. Đối chiếu với số liệu về bán kính nguyên tử ta thấy: Z > X > T > Y → Z là K, X là Ca, T là Mg và Y là Al. Vậy phát biểu đúng là A. Đáp án A Quảng cáo
|














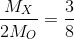 => Mx = 2 . 16 . 3 : 8 = 12
=> Mx = 2 . 16 . 3 : 8 = 12