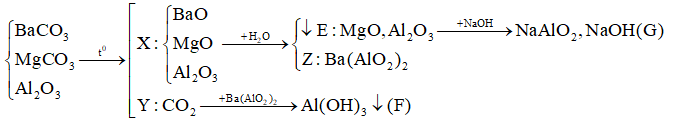Đề kiểm tra 15 phút - Đề số 1 - Chương III - Hóa học 11v Đề kiểm tra 15 phút - Đề số 1 - Chương III - Hóa học 11 Quảng cáo
Đề bài Câu 1: Khi đốt cháy than đá thu được hỗn hợp khí trong đí khi X( không màu, không mùi, độc) X là khí nào sau đây? A. SO2 B. NO2 C. CO D. CO2 Câu 2: Cho luồng khí C dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn còn lại là A. Cu, Fe, ZnO, MgO. B. Cu, Fe, Zn, Mg. C. Cu, Fe, Zn, MgO. D. Cu, FeO, ZnO, MgO. Câu 3: Cho các chất: O2 (1), CO2 (2), H2 (3), Fe2O3 (4), SiO2 (5), HCl (6), CaO (7), H2SO4 đặc (8), HNO3 (9), H2O (10), KCl (11). Cacbon phản ứng trực tiếp được với bao nhiêu chất? A. 8 B. 9 C. 7 D. 10 Câu 4: Trong nhóm IVA, theo chiều tăng của điện tích hạt nhân, nhận định nào sau đây sai ? A. Độ âm điện giảm dần B. Tính phi kim giảm dần, tính kim loại tăng dần. C. Bán kính nguyên tử giảm dần. D. Số oxi hoá cao nhất là +4. Câu 5: Nhiệt phân hoàn toàn hỗn hợp BaCO3, MgCO3, Al2O3 được rắn X và khí Y. Hoà tan rắn X vào nước thu được kết tủa E và dung dịch Z. Sục khí Y dư vào dung dịch Z thấy xuất hiện kết tủa F, hoà tan E vào dung dịch NaOH dư thấy tan một phần được dung dịch G. Các chất trong dung dịch G và kết tủa F là A. NaOH và Al(OH)3. B. NaOH, NaAlO2 và Al(OH)3. C. NaAlO2 và BaCO3. D. Ba(OH)2, NaOH và BaCO3. Câu 6: Có 3 muối dạng bột NaHCO3, Na2CO3 và CaCO3. Chọn hoá chất thích hợp để nhận biết mỗi chất A. Quỳ tím. B. Phenolphtalein. C. Nước và HCl. D. Axit HCl và quỳ tím. Câu 7: Dẫn luồng khí CO dư qua hỗn hợp CuO, Al2O3, CaO, MgO có số mol bằng nhau (nung nóng ở nhiệt độ cao) thu được chất rắn A. Hòa tan A vào nước dư còn lại chất rắn X. X gồm: A. Cu, Mg. B. Cu, Mg, Al2O3. C. Cu, Al2O3, MgO. D. Cu, MgO. Câu 8: Cho khí CO qua ống sứ chứa 10 gam hỗn hợp chất rắn X gồm CuO; Fe2O3; FeO; Fe3O4 và MgO nung nóng. Sau một thời gian thu được hỗn hợp khí Y và 8 gam rắn Z. Cho Y qua dung dịch nước vôi trong dư thu được m gam kết tủa. Giá trị m là A. 50,0. B. 12,5. C. 25,0. D. 20,0. Câu 9: Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng là: A. FeO; 75% B. Fe3O4; 75% C. Fe2O3; 65% D. Fe2O3; 75% Câu 10: Cho 5,6 lít CO2 (đktc) hấp thụ hoàn toàn trong dung dịch chứa 0,18 mol Ca(OH)2. Khối lượng kết tủa thu được là: A. 18 gam B. 11 gam C. 16 gam D. 14 gam Lời giải chi tiết Đáp án:
Câu 1: Khi đốt cháy than đá C ta thu được hỗn hợp khí CO2 và CO đều không màu không mùi. Nhưng X là một khí độc nên X là CO Đáp án C Câu 2: C chỉ khử được các oxit kim loại đứng sau Al => C khử được CuO, Fe2O3, ZnO và không khử được MgO Đáp án C Câu 3: C phản ứng trực tiếp được với các chất: O2, CO2, H2, Fe2O3, H2SO4 đặc, HNO3, H2O Đáp án C Câu 4: Nhận định sai là: bán kính nguyên tử giảm dần Vì theo chiều tăng của điện tích hạt nhân, độ âm điện giảm và số lớp e tăng => bán kính nguyên tử tăng Đáp án C Câu 5: (Vì E tan 1 phần trong kiềm => trong E chứa Al2O3 còn dư => dung dịch Z không còn Ba(OH)2 Đáp án B Câu 6: hoá chất thích hợp để nhận biết mỗi chất là Nước và HCl.
Đáp án C Câu 7: \(CO\,du + \left\{ \matrix{ CO + Cu \(\buildrel {{t^0}} \over\longrightarrow \)Cu + H2O CaO + H2O → Ca(OH)2 Ca(OH)2 + Al2O3 → Ca(AlO2)2 + H2O Vì các chất ban đầu có cùng số mol nên Al2O3 phản ứng hết với dd Ca(OH)2. Do vậy chất rắn sau phản ứng chỉ có Cu và MgO Đáp án D Câu 8: m rắn giảm = mO pư = 2 gam => nO = 0,125 mol CO + [O] → CO2 0,125 → 0,125 (mol) => nCaCO3 = nCO2 = 0,125 mol => mCaCO3 = 12,5 gam Đáp án B Câu 9: nCO ban đầu = 0,2 mol Mkhí sau phản ứng = 40 => khí sau phản ứng gồm CO2 (x mol) và CO dư (y mol) Bảo toàn C: nCO ban đầu = nCO2 + nCO dư => x + y = 0,2 (1) \(\bar M = \frac{{44x + 28y}}{{x + y}} = 40\,\,\,(2)\) Từ (1) và (2) => nCO2 = 0,15 mol và nCO dư = 0,05 mol => %CO2 = 75% Ta có: nO trong oxit = nCO2 = 0,15 mol mFe = moxit – mO trong oxit => nFe = (8 – 0,15.16) : 56 = 0,1 mol Gọi công thức của oxit là FexOy => x : y = 0,1 : 0,15 = 2 : 3 Đáp án D Câu 10: nCO2 = 0,25 mol; nOH- = 0,36 mol Xét tỉ lệ: nOH- / nCO2 = 0,36 / 0,25 = 1,44 => sau phản ứng thu được 2 muối Sử dụng công thức tính nhanh: \({n_{CO_3^{2 - }}} = {n_{O{H^ - }}} - {n_{C{O_2}}}\)= 0,36 – 0,25 = 0,11 mol => nCaCO3 = nCO3 = 0,11 mol => m = 11 gam Đáp án B Loigiaihay.com
|