Câu hỏi:
Cho phương trình hoá học: FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O. Khi cân bằng với hệ số nguyên tối giản thì hệ số của KHSO4 là
- A 18
- B 8
- C 16
- D 9
Phương pháp giải:
Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e
Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận.
cân bằng theo 4 bước
- Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi
- Bước 2: Viết các quá trình oxi hóa, quá trình khử.
- Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận
- Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự:
Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.)
Lời giải chi tiết:
FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
Các quá trình cho – nhận e
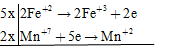
đặt hệ số của KHSO4 = a; K2SO4 = b => nH2O = a/2 (BTNT "H")
10FeSO4 + 2KMnO4 + aKHSO4 → 5Fe2(SO4)3 + 2MnSO4 +bK2SO4 + a/2H2O
Ta có:
=> 10FeSO4 + 2KMnO4 + 16KHSO4 → 5Fe2(SO4)3 + 2MnSO4 +9K2SO4 + 8H2O
=> hệ số tối giản của KHSO4 là 16
Đáp án C


















