Câu hỏi:
Cho phương trình phản ứng: \(Al + HN{O_3} \to Al{(N{O_3})_3} + {N_2} + {N_2}O + {H_2}O\) . Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3:2, hãy xác định tỉ lệ mol nAl : nN2O : nN2 trong các kết quả sau
- A 44 : 6 : 9
- B 46 : 9 : 6
- C 46 : 6 : 9
- D 44 : 9 : 6
Phương pháp giải:
Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e
Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận.
cân bằng theo 4 bước
- Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi
- Bước 2: Viết các quá trình oxi hóa, quá trình khử.
- Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận
- Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự:
Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.)
Lời giải chi tiết:
\(Al + HN{O_3} \to Al{(N{O_3})_3} + {N_2} + {N_2}O + {H_2}O\)
Các quá trình cho – nhận e
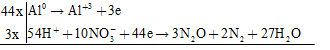
\(44Al + 162HN{O_3} \to 44Al{(N{O_3})_3} + 6{N_2} + 9{N_2}O + 81{H_2}O\)
\( \Rightarrow {n_{Al}}:{n_{{N_2}O}}:{n_{{N_2}}} = 44:9:6\)
Đáp án D


















