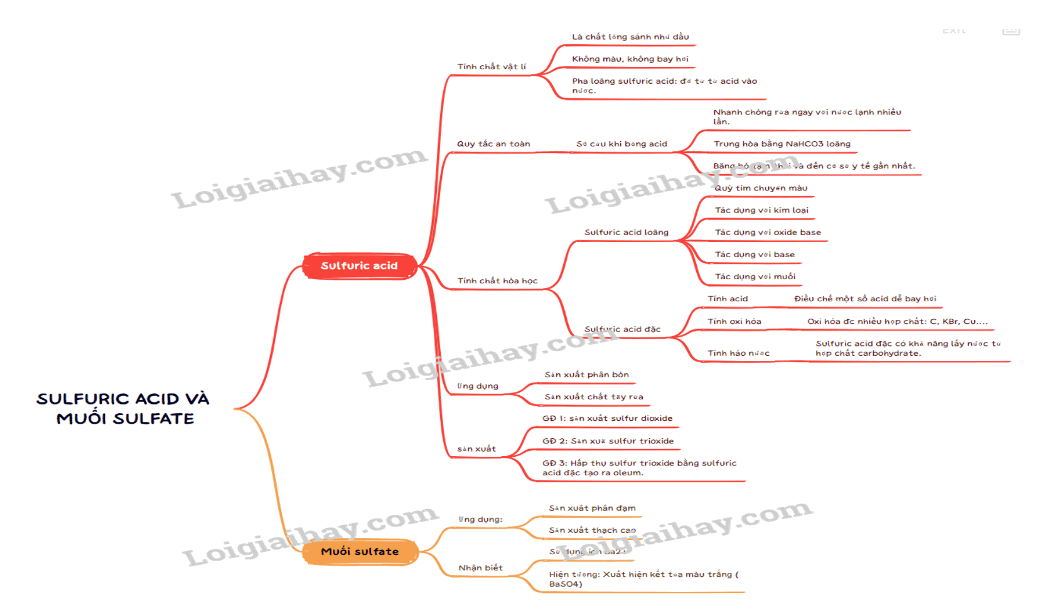
Lý thuyết Sulfuric acid và muối sulfate - Hóa học 11 - Kết nối tri thức- Sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi, có tính hút ẩm mạnh. - Tan vô hạn trong nước và tỏa rất nhiều nhiệt. - Cách pha loãng sulfuric acid đặc: rót từ từ dung dịch sulfuric acid đặc vào nước, vừa rót vừa khuấy đều. + Chú ý: Không làm ngược lại. Quảng cáo
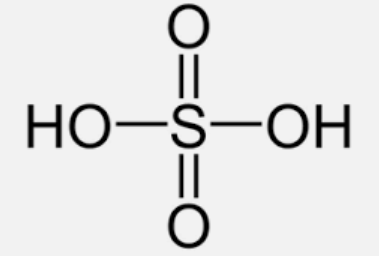
I. Sulfuric acid 1. Cấu tạo phân tử - Phân tử H2SO4 có công thức cấu tạo: - Liên kết hydrogen giữa các phân tử sulfuric acid: 2. Tính chất vật lí - Sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi, có tính hút ẩm mạnh. - Tan vô hạn trong nước và tỏa rất nhiều nhiệt. - Cách pha loãng sulfuric acid đặc: rót từ từ dung dịch sulfuric acid đặc vào nước, vừa rót vừa khuấy đều. + Chú ý: Không làm ngược lại. 3. Quy tắc an toàn a, Bảo quản - Bảo quản trong chai, lọ có nút đậy chặt. - Đặt các xa các lọ chứa chất dễ cháy nổ như permanganate, dichromate… b, Sử dụng Khi sử dụng tuân thủ các nguyên tắc: - Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm. - Cầm dụng cụ chắc chắn, thao tác cẩn thận. - Không tì, đè chai đựng acid lên miệng cốc, ống đông khi rót acid. - Sử dụng lượng acid vừa phải, lượng acid còn thửa phải thu hồi vào lọ đựng. - Không được đổ nước vào dung dịch acid đặc. c, Sơ cứu khi bỏng acid - Nhanh chóng rửa ngay với nước lạnh nhiều lần. - Trung hòa acid bằng dung dịch NaHCO3 loãng (2%). - Băng bó tạm thời bằng băng sạch, uống bù nước điện giải rồi đưa đến cơ sở y tết gần nhất. 4. Tính chất hóa học a, Dung dịch sulfuric acid loãng - Có đầy đủ tính chất của một acid mạnh. + Làm quỳ tím chuyển sang màu đỏ. + Tác dụng với kim loại. + Tác dụng với oxide base. + Tác dụng với base. + Tác dụng với muối. b, Dung dịch sulfuric acid đặc - Tính acid: Có tính acid mạnh, được sử dụng để chiều chế một số acid dễ bay hơi. VD: CaF2 + H2SO4→ CaSO4 + 2HF - Tính oxi hóa: Có tính oxi hóa mạnh. + Sulfuric acid đặc, nóng oxi hóa được nhiều kim loại, phi kim và hợp chất. VD: Cu + 2H2SO4→ CuSO4 + SO2 + 2H2O C + H2SO4→ CO2 + 2SO2 + 2H2O - Tính háo nước: H2SO4 đặc có khả năng lấy nước từ hợp chất carbohydrate và khiến chúng hóa đen. 5. Ứng dụng - Sản xuất phân bón. - Sản xuất chất tẩy rửa. - Chế biến dầu mỏ. - Sản xuất muối, acid. … 6. Sản xuất - GĐ 1: Sản xuất sulfur dioxide. S(s) +O2(g) → SO2(g) 4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g) - GĐ 2: Sản xuất sulfur trioxide. 2SO2(g) + O2(g) → 2SO3(g) - GĐ 3: Hấp thu sulfur trioxide bằng sulfuric acid đặc, tạo ra oleum. II. Muối sulfate 1. Ứng dụng - Sản xuất phân đạm. - Sản xuất thạch cao. - Sản xuất chất cản quang. - Sản xuất thạch cao. - Sản xuất khoảng chất bổ sung cho phân bón, thức ăn gia súc. 2. Nhận biết - Nhận biết ion SO42- bằng ion Ba2+. - Hiện tượng: Xuất hiện kết tủa trắng (BaSO4). SƠ ĐỒ TƯ DUY
|





















Danh sách bình luận