Bài 1. Khái niệm về cân bằng hóa học trang 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 Hóa học 11 Kết nối tri thứcPhản ứng hóa học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành chất đầu. Đối với những phản ứng này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 6
Phương pháp: Đối với những phản ứng có sản phẩm có thể phản ứng với nhau tạo thành chất ban đầu, để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng: vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier. Lời giải chi tiết: Đối với những phản ứng có sản phẩm có thể phản ứng với nhau tạo thành chất ban đầu, người ta thường vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier để chuyển dịch cân bằng theo mong muốn nhằm thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng. Theo nguyên lí Le Chatelier: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.” => Có thể điều chỉnh nồng độ chất tham gia hoặc sản phẩm, nhiệt độ, áp suất để phản ứng chuyển dịch theo chiều thuận, tạo ra nhiều sản phẩm hơn với hiệu suất cao hơn.
Ngoài ra, người ta còn sử dụng chất xúc tác để tăng tốc độ phản ứng.
Phương pháp: a) Phương trình hoá học của các phản ứng xảy ra: - Trong thí nghiệm 1: H2(g) + I2(g) ⇌ 2HI(g). - Trong thí nghiệm 2: 2HI(g) ⇌ H2(g) + I2(g). b) Giải thích: Phản ứng thuận nghịch. Lời giải chi tiết: a) Phương trình hoá học của các phản ứng xảy ra: - Trong thí nghiệm 1: H2(g) + I2(g) ⇌ 2HI(g). - Trong thí nghiệm 2: 2HI(g) ⇌ H2(g) + I2(g).
b) Trong cả hai thí nghiệm trên, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng. Do hai phản ứng trên là phản ứng thuận nghịch, trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành các chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành các chất ban đầu (phản ứng nghịch). Phản ứng hóa học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành chất đầu. Đối với những phản ứng này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng?
CH tr 7 Video hướng dẫn giải
Phương pháp: Phản ứng thuận: CaCO3 + H2CO3 → Ca(HCO3)2 Trong đó: CaCO3 là đá vôi; H2CO3 là carbonic acid tự nhiên có mặt trong nước và không khí. Phản ứng nghịch: Ca(HCO3)2 → CO2 + H2O + CaCO3 Trong đó: Ca(HCO3)2 là hợp chất có trong nước bị phân hủy, tạo ra CO2, H2O và CaCO3 (thạch nhũ, măng đá, cột đá). Lời giải chi tiết: 1. Phản ứng thuận: CaCO3 + H2CO3 → Ca(HCO3)2 Phản ứng nghịch: Ca(HCO3)2 → CO2 + H2O + CaCO3 CH tr 8 Video hướng dẫn giải
Phương pháp: 2. Phản ứng xảy ra khi cho khí Cl2 tác dụng với nước là: Cl2 + H2O ⇌ HClO + HCl 3. Đáp án C: Phản ứng một chiều có thể xảy ra hoàn toàn hoặc không hoàn toàn, phụ thuộc vào điều kiện phản ứng. Lời giải chi tiết: 2. Phương trình hoá học của phản ứng xảy ra khi cho khí Cl2 tác dụng với nước: Cl2(aq) + H2O(l) ⇌ HCl(aq) + HClO(aq) Phản ứng thuận: Cl2 + H2O → HCl + HClO Phản ứng nghịch: HCl + HClO → Cl2 + H2O 3. Đáp án C. vì phản ứng một chiều là phản ứng chỉ xảy ra một chiều, không có sự tạo lại chất ban đầu, nên phản ứng một chiều có thể xảy ra hoàn toàn hoặc không hoàn toàn. Ví dụ như phản ứng cháy là một phản ứng một chiều, có thể xảy ra hoàn toàn hoặc không hoàn toàn, tùy thuộc vào điều kiện phản ứng.
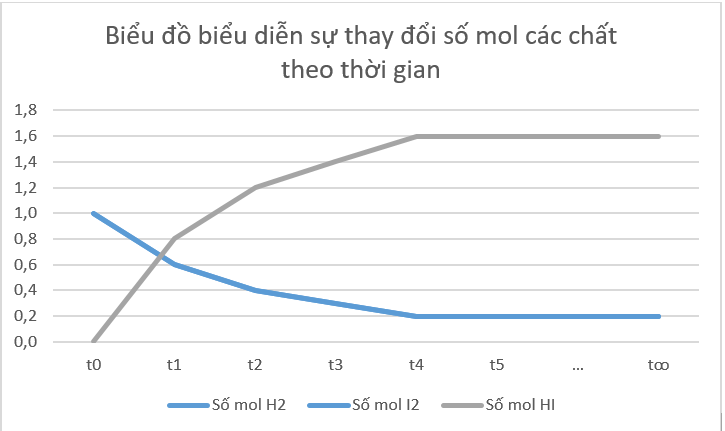
Phương pháp: a) Vẽ biểu đồ đường biểu diễn, trục tung là số mol, trục hoành là thời gian. b) Nhận xét: Ban đầu chưa có sản phẩm, sau đó số mol chất tham gia giảm dần, số mol sản phẩm tăng dần cho tới khi cân bằng, số mol các chất trong hệ không thay đổi nữa. c) Biểu thức định luật tác dụng khối lượng: - Đối với phản ứng thuận: vthuận = k.[A]a.[B]b - Đối với phản ứng nghịch: vnghịch = k.[C]c Dự đoán: dựa vào biểu thức định luật tác dụng khối lượng. Tốc độ phản ứng thuận phụ thuộc vào nồng độ chất tham gia, tốc độ phản ứng nghịch phụ thuộc vào nồng độ chất sản phẩm. d) Thời điểm phản ứng đạt trạng thái cân bằng thì số mol các chất không thay đổi nữa. Lời giải chi tiết: a)
b) Từ đồ thị ta thấy: Lúc đầu số mol sản phẩm bằng 0, theo thời gian, số mol chất tham gia (hydrogen, iodine) giảm dần, số mol chất sản phẩm (hydrogen iodide) tăng dần, đến khi số mol của các chất hydrogen, iodine, hydrogen iodide không thay đổi nữa. c) Biểu thức định luật tác dụng khối lượng: - Đối với phản ứng thuận: vthuận = \({\rm{k}}{\rm{.}}{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}}{\rm{.}}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}}\) - Đối với phản ứng nghịch: vnghịch = \({\rm{k'}}{\rm{.C}}_{{\rm{HI}}}^2\) Dự đoán: - Ban đầu tốc độ phản ứng thuận giảm dần, sau một thời gian tốc độ phản ứng thuận không thay đổi theo thời gian. - Ban đầu tốc độ phản ứng nghịch tăng dần, sau một thời gian tốc độ phản ứng nghịch không thay đổi theo thời gian. d) Tại thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì số mol các chất trong hệ phản ứng không thay đổi nữa. CH tr 9 Video hướng dẫn giải
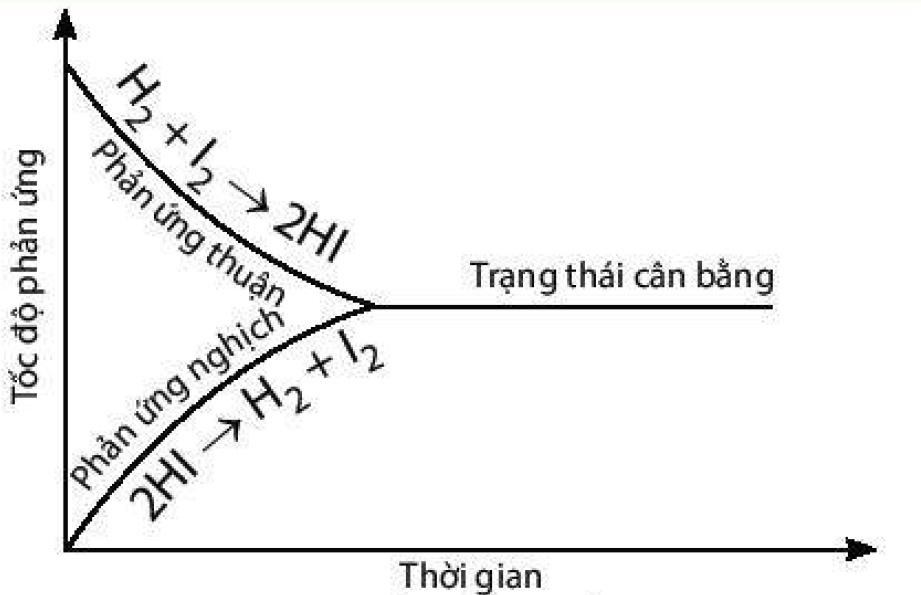
Phương pháp giải: 4. a) Đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian: b) Thời điểm phản ứng trên bắt đầu đạt trạng thái cân bằng là thời điểm tốc độ phản ứng thuận bắt đầu bằng tốc độ phản ứng nghịch. 5. Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau đề tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau đề tạo thành các chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cân bằng, nồng độ các chất không thay đồi. Lời giải chi tiết: 4. a) Đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian: b) Điểm cân bằng của phản ứng này là điểm giao nhau giữa đường cong biểu diễn tốc độ phản ứng thuận và đường cong biểu diễn tốc độ phản ứng nghịch. 5. Các nhận xét đúng là: a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi. Câu b và c sai bởi vì: b) Ở trạng thái cân bằng, các chất không phản ứng với nhau. Là sai bởi vì các chất tham gia phản ứng liên tục phản ửng với nhau đề tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau đề tạo thành các chất đầu. c) Ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu là sai bởi vì: nồng độ các chất ở trạng thái cân bằng có thể lớn hơn, bằng hoặc nhỏ hơn nồng độ các chất đầu.
Phương pháp: Áp dụng công thức \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}}\) Lời giải chi tiết: Giá trị hằng số cân bằng ở mỗi thí nghiệm: - Thí nghiệm 1: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,16}^2}}}{{0,02.0,02}} = 64\) - Thí nghiệm 2: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,18936}^2}}}{{0,00532.0,10532}} \approx 64\) - Thí nghiệm 3: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,19420}^2}}}{{0,20290.0,00290}} \approx 64\) Nhận xét: Hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng. CH tr 10 Video hướng dẫn giải
Phương pháp: 6. Áp dụng công thức: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {\rm{C}} \right)}^{\rm{c}}}{{\left( {\rm{D}} \right)}^{\rm{d}}}}}{{{{\left( {\rm{A}} \right)}^{\rm{a}}}{{\left( {\rm{B}} \right)}^{\rm{b}}}}}\) 7. Thay số vào công thức tìm được ở câu 6: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}^2}}}{{\left( {{{\rm{N}}_{\rm{2}}}} \right){{\left( {{{\rm{H}}_{\rm{2}}}} \right)}^3}}}\) Lời giải chi tiết: 6. Biểu thức hằng số cân bằng của các phản ứng: a) \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}^2}}}{{\left( {{{\rm{N}}_{\rm{2}}}} \right){{\left( {{{\rm{H}}_{\rm{2}}}} \right)}^3}}}\) b) KC = (CO2) Chú ý: Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng. 7. Hằng số cân bằng KC của phản ứng tại t oC là: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}^2}}}{{\left( {{{\rm{N}}_{\rm{2}}}} \right){{\left( {{{\rm{H}}_{\rm{2}}}} \right)}^3}}} = \frac{{{{0,62}^2}}}{{{\rm{0}}{\rm{,45}}{\rm{.0}}{\rm{,1}}{{\rm{4}}^3}}} = 311,31\)
Phương pháp: \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ < 0}}\) nên phản ứng thuận là phản ứng tỏa nhiệt. Lời giải chi tiết:
CH tr 11 Video hướng dẫn giải
Phương pháp: \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\)nên phản ứng thuận là phản ứng thu nhiệt. Lời giải chi tiết:
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng: CH3COONa + H2O ⇌CH3COOH + NaOH \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\)
CH tr 12 Video hướng dẫn giải
Phương pháp: Màu dung dịch trong ống nghiệm cho biết nồng độ sodium hydroxide tăng hay giảm, từ đó suy ra chiều chuyển dịch của cân bằng. Lời giải chi tiết:
CH tr 13 Video hướng dẫn giải
Phương pháp giải: 8. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ tức là chiều phản ứng thu nhiệt (\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\)), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại. + Cân bằng: CaCO3(s) ⇌ CaO(s) + CO2(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{176 kJ > 0}}\)⇒ Chiều thuận thu nhiệt. + Cân bằng: 2SO2(g) + O2(g) ⇌ 2SO3(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 198{\rm{ kJ < 0}}\) ⇒ Chiều thuận toả nhiệt. 9. Khi tăng nồng độ một chất trong phản ứng thì cân bằng hóa học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại. Lời giải chi tiết: 8. + Cân bằng: CaCO3(s) ⇌ CaO(s) + CO2(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{176 kJ > 0}}\)⇒ Chiều thuận thu nhiệt. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều thuận, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ. + Cân bằng: 2SO2(g) + O2(g) ⇌ 2SO3(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 198{\rm{ kJ < 0}}\) ⇒ Chiều thuận toả nhiệt. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ. 9. a) Tăng nồng độ của C2H5OH, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm giảm nồng độ của C2H5OH. b) Giảm nồng độ của CH3COOC2H5, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm tăng nồng độ CH3COOC2H5. CH tr 14 Video hướng dẫn giải
Phương pháp giải: 10. Khi tăng áp suất chung của hệ, thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại. 11. a) Cân bằng 1: C(s) + H2O(g) ⇌ CO(g) + H2(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{130 kJ > 0}}\)⇒ Chiều thuận thu nhiệt. Cân bằng 2: CO(g) + H2O(g) ⇌ CO2(g) + H2(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 42{\rm{ kJ < 0}}\)⇒ Chiều thuận toả nhiệt b) + Tăng lượng hơi nước ⇒ cân bằng chuyển dịch theo chiều thuận ⇒ tăng hiệu suất thu khí hydrogen. + Ngoài ra, hơi nước có giá thành rẻ hơn và không độc hại Lời giải chi tiết: 10. a) 2SO2(g) + O2(g) ⇌ 2SO3(g) Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí). b) CO(g) + H2O(g) ⇌ H2(g) + CO2(g) Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ. c) PCl5(g) ⇌ Cl2(g) + PCl3(g) Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều nghịch, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí). d) H2(g) + I2(g) ⇌ 2HI(g) Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ. 11. a) Cân bằng 1: C(s) + H2O(g) ⇌ CO(g) + H2(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{130 kJ > 0}}\)⇒ Chiều thuận thu nhiệt. Vậy để cân bằng (1) chuyển dịch theo chiều thuận cần tăng nhiệt độ của hệ. Cân bằng 2: CO(g) + H2O(g) ⇌ CO2(g) + H2(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 42{\rm{ kJ < 0}}\)⇒ Chiều thuận toả nhiệt Vậy để cân bằng (2) chuyển dịch theo chiều thuận cần giảm nhiệt độ của hệ. b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Do: + Tăng lượng hơi nước ⇒ cân bằng chuyển dịch theo chiều thuận (tức chiều làm giảm lượng hơi nước) ⇒ tăng hiệu suất thu khí hydrogen. + Ngoài ra, hơi nước có giá thành rẻ hơn và không độc hại so với sử dụng lượng dư carbon monoxide. c) Nếu tăng áp suất cân bằng (1) chuyển dịch theo chiều nghịch. Vì số mol khí của sản phẩm > mol khí tham gia.
(2) không thay đổi vì số mol khí của tham gia và sản phẩm bằng nhau CH tr 15 Video hướng dẫn giải
Phương pháp giải 12. a) Để oxygen lên não nhiều hơn thì hàm lượng oxygen hít vào phổi cũng phải nhiều hơn. b) Do ở trên núi cao, hàm lượng oxygen loãng. Cân bằng: Hb + O2 ⇌ HbO2 chuyển dịch theo chiều nghịch. Lời giải chi tiết 12. a) Để oxygen lên não nhiều hơn thì hàm lượng oxygen hít vào phổi cũng phải nhiều hơn. Một số biện pháp đề xuất để oxygen lên não nhiều hơn: + Tập thể dục và hít thở đúng cách. + Giảm lo âu, căng thẳng và có chế độ dinh dưỡng hợp lí. + Không hút thuốc lá, tránh xa nơi có khói thuốc. + Bảo vệ môi trường không khí trong lành, tránh ô nhiễm không khí. + Trồng nhiều cây xanh… b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Do ở trên núi cao, hàm lượng oxygen loãng, dẫn đến khi đến các mô cân bằng: Hb + O2 ⇌ HbO2 chuyển dịch theo chiều nghịch, giải phóng oxygen.
|





















Danh sách bình luận