Bài 9. Ôn tập chương 2 trang 55, 56 Hóa học 11 Kết nối tri thứcCâu 1: Phân tử nitrogen có cấu tạo là A. N═N. B. N☰N. C. N─N. D. N→N Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 56 CH1 Video hướng dẫn giải Phân tử nitrogen có cấu tạo là A. N═N. B. N☰N. C. N─N. D. N→N Phương pháp giải: Cấu trúc hình thang của phân tử nitrogen được biểu diễn bằng liên kết ba đôi (triple bond) giữa hai nguyên tử nitrogen (N), được biểu thị bởi ký hiệu hóa học N☰N. Khi liên kết này phân cực, các electron được chia sẻ chặt chẽ giữa hai nguyên tử, tạo nên một cấu trúc rất vững chắc. Lời giải chi tiết: Đáp án đúng là B. N☰N. CH tr 56 CH2 Phân tử ammonia có dạng hình học nào sau đây? A. Chóp tam giác. B. Chữ T. C. Chóp tứ giác. D. Tam giác đều. Phương pháp giải: Phân tử ammonia (NH3) có bốn electron chưa liên kết trên nguyên tử nitrogen (N) và một electron chưa liên kết trên mỗi nguyên tử hydrogen (H), tạo thành tổng cộng tám electron chưa liên kết. Trong phân tử ammonia, cả bốn electron của nguyên tử nitrogen liên kết với ba nguyên tử hydrogen, hình thành bốn liên kết đơn. Lời giải chi tiết: Đáp án đúng là A. Chóp tam giác. CH tr 56 CH3 Ammonia đóng vai trò chất khử khi tác dụng với chất nào sau đây? A. H2O. B. HCI. C. H3PO4. D. O2 (Pt, t°). Phương pháp giải: Khi ammonia tác dụng với O2 ở nhiệt độ phòng và có chất xúc tác là Pt (bạch kim), nó sẽ hoạt động như một chất khử và chuyển hóa O2 thành nước (H2O) và nitrogen (N2) theo phương trình hóa học sau: Lời giải chi tiết: Đáp án đúng là: D. CH tr 56 CH4 Khi so sánh phân tử ammonia với ion ammonium, nhận định nào sau đây là đúng? A. Đều chứa liên kết ion. B. Đều có tính acid yếu trong nước. C. Đều có tính base yếu trong nước. D. Đều chứa nguyên tử N có số oxi hoá là -3. Phương pháp giải: Trong NH3 và NH4+, nguyên tử N đều có số oxi hoá là -3. Lời giải chi tiết: Đáp án đúng là: D. CH tr 56 CH5 Cho vài giọt dung dịch BaCl2 vào dung dịch nào sau đây sẽ tạo kết tủa trắng? A. NaCl. B. Na2SO4. C. NaNO3. D. NaOH. Phương pháp giải: BaCl2 + Na2SO4 → BaSO4 + 2NaCl. BaSO4 là chất kết tủa, có màu trắng. Lời giải chi tiết: Đáp án đúng là: B. CH tr 56 CH6 Cho chất rắn nào sau đây vào dung dịch H2SO4 đặc thì xảy ra phản ứng oxi hoá - khử? A. KBr. B. NaCl. C. CaF2. D. CaCO3. Phương pháp giải:
Lời giải chi tiết: Đáp án đúng là: A. CH tr 56 CH7 Khi pha loãng dung dịch sulfuric cần tuân thủ thao tác nào sau đây để đảm bảo an toàn? A. Rót từ từ acid vào nước. C. Rót từ từ nước vào acid. B. Rót nhanh acid vào nước. D. Rót nhanh nước vào acid. Phương pháp giải: Khi pha loãng dung dịch sulfuric acid đặc, để đảm bảo an toàn phải rót từ từ dung dịch sulfuric acid đặc vào nước, vừa rót vừa khuấy (không làm ngược lại). Lời giải chi tiết: Đáp án đúng là: A CH tr 56 CH8 Xét phản ứng trong giai đoạn đầu của quá trình Ostwald: 4NH3(g) + 5O2(g) (Pt, t°) → 4NO(g) + 6H2O(g) a) Tính ΔrH0298 của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì? Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là -45,9 kJ/mol; 90,3 kJ/mol và -241,8 kJ/mol. b) Tính năng lượng liên kết trong phân tử NO. Biết năng lượng liên kết N─H, O═O, O─H lần lượt là 386 kJ/mol, 494 kJ/mol và 459 kJ/mol. Phương pháp giải:
Lời giải chi tiết:
|














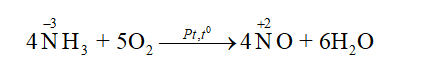
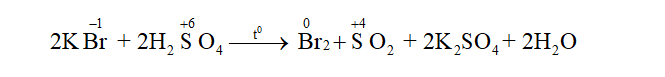
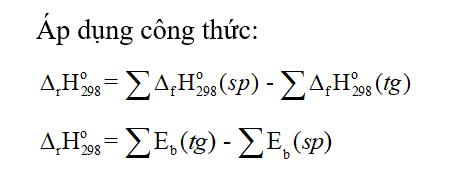







Danh sách bình luận