Bài 4. Dung dịch và nồng độ trang 11, 12, 13, 14 SBT Khoa học tự nhiên 8 Kết nối tri thứcKhối lượng H2O2 có trong 30 g dung dịch nồng độ 3% Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
4.1 Khối lượng H2O2 có trong 30 g dung dịch nồng độ 3% A. 10 g. B. 3 g. C. 0,9 g. D. 0,1 g. Phương pháp giải: Áp dụng: C% \( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% \) Lời giải chi tiết: ⇒mct = mH2O2 =\(\frac{{30.3 }}{{100 }} = 0,9(g)\) 4.2 Khối lượng NaOH có trong 300 m L dung dịch nồng độ 0,15 M là A. 1,8 g. B. 0,045 g. C. 4,5g. D. 0,125g. Phương pháp giải: Dựa vào tính nồng độ mol dung dịch. Lời giải chi tiết: Số mol NaOH: nNaOH = 0,3.0,15 = 0,045 (mol). Khối lượng NaOH: mNaOH = 0,045.40 = 1,8 (gam). Đáp án: A 4.3 Trong các câu sau đây, câu nào đúng, câu nào sai? a) Hai dung dịch đường và muối ăn có cùng khối lượng, cùng nồng độ phần trăm thì chứa khối lượng đường và muối ăn bằng nhau. b) Hai dung dịch đường và muối ăn có cùng khối lượng, cùng nồng độ phần trăm thì số mol đường và muối ăn bằng nhau. c) Hai dung dịch NaOH và H2SO4 có cùng thể tích, cùng nồng độ mol thì chứa khối lượng chất tan bằng nhau. d) Hai dung dịch NaOH và H2SO4 có cùng thể tích, cùng nồng độ mol thì chứa số mol chất tan bằng nhau. Phương pháp giải: Dựa vào nồng độ mol dung dịch. Lời giải chi tiết: a - đúng; b - sai; c - sai; d - đúng. 4.4 Ở 25 °C, một dung dịch có chứa 20 g NaCl trong 80 g nước. a) Tính nồng độ phần trăm của dung dịch trên. b) Dung dịch NaCl ở trên có phải dung dịch bão hoà không? Biết rằng độ tan của NaCl trong nước ở nhiệt độ này là 36 g. Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: a) Khối lượng dung dịch là: mdd = 20 + 80 = 100 (gam). Nồng độ phần trăm của dung dịch là: Áp dụng: C% \( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% = \frac{{20}}{{100}}.100\% = 20\% \) b) Nồng độ phần trăm của dung dịch NaCl bão hoà là: C% (bh) \( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% = \frac{{36}}{{36 + 100}}. 100\% = 26,47\% \) Ta thấy: C% < C% (bh) Vậy dung dịch NaCl ở câu a) không phải dung dịch bão hoà. 4.5 Ở 250C, độ tan của AgNO3 trong nước 222g a) Tính nồng độ phần trăm của dung dịch AgNO3 bão hòa ở 25oc b) Để pha được 50g dung dịch AgNO3 bão hòa ở 25oc, cần lấy bao nhiêu gam AgNO3 và bao nhiêu gam nước? Phương pháp giải: Áp dụng: C% \( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% \) Lời giải chi tiết: a) \(C\% = \frac{{222}}{{222 + 100}} = 68,94\% \) b) \({m_{AgNO3}} = {m_{{\rm{dd}}}}.\frac{{C\% }}{{100}} = 50.\frac{{68,94}}{{100}} = 34,47g\) Khối lượng nước cần lấy: \({m_{_{H2O}}} = {m_{{\rm{dd}}}} - {m_{AgNO3}} = 50 - 34,47 = 15,53(g)\) 4.6 Trộn 100 g dung dịch đường glucose nồng độ 10% (dung dịch A) với 150 g dung dịch đường glucose nồng độ 15% (dung dịch B) thu được dung dịch C. a) Tính khối lượng đường glucose trong dung dịch A, B và C. b) Tính nồng độ phần trăm của dung dịch C. Nhận xét về giá trị nồng độ phần trăm của dung dịch C so với nồng độ phần trăm của dung dịch A, B. Phương pháp giải: Áp dụng: C% \( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% \) Lời giải chi tiết: a) Khối lượng đường glucose trong dung dịch A: m1=\(\frac{{{m_{{\rm{dd}}}}.C\% }}{{100\% }} = \frac{{100.10}}{{10}} = 10g\) Khối lượng đường glucose trong dung dịch B: m2=\(\frac{{{m_{{\rm{dd}}}}.C\% }}{{100\% }} = \frac{{150.15\% }}{{100\% }} = 22,5g\)
Khối lượng đường glucose trong dung dịch C: m3 = m1 + m2 = 10 + 22,5 = 32,5 (gam). b) Nồng độ phần trăm dung dịch C: C%\( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% = \frac{{32,5}}{{100 + 150}}.100\% = 13\% \) Giá trị nồng độ dung dịch sau khi trộn nằm giữa giá trị nồng độ hai dung dịch ban đầu. 4.7 Rót từ từ 100 mL dung dịch sulfuric acid nồng độ 0,15 M vào 200 mL nước cất. Tính nồng độ của dung dịch thu được (coi thể tích dung dịch thu được bằng tổng thể tích dung dịch ban đẩu và nước cất). Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: Số mol sulfuric acid trong dung dịch: nH2SO4 = 0,15 . 0,1 = 0,015 (mol). Thể tích dung dịch sau khi pha nước: Vsau = 0,1 + 0,2 = 0,3 (L). Nồng độ dung dịch sau khi pha nước: CM(sau) \( = \frac{n}{{{V_{sau}}}} = \frac{{0,015}}{{0,3}} = 0,05M\) 4.8 Trong phòng thí nghiệm có 100 g dung dịch KCl. Một bạn lấy ra 5 g dung dịch trên, cho ra đĩa thuỷ tinh và cho vào tủ sấy. Khi nước bay hơi hết, trên đĩa thuỷ tinh còn lại chất bột màu trắng. Khối lượng đĩa thuỷ tinh tăng lên 0,25 g so với khối lượng đĩa ban đầu. a) Tính nồng độ phần trăm của dung dịch KCl. b) Tính số gam chất tan có trong 100 g dung dịch ban đầu. Phương pháp giải: Áp dụng: C% =\(\frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% \) Lời giải chi tiết: a) Khi nước bay hơi hết, chất bột màu trắng còn lại chính là KCl. Khối lượng đĩa thuỷ tinh tăng lên chính là khối lượng KCl có trong 5 g dung dịch. Nồng độ phần trăm của dung dịch KCl: C% =\(\frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% \) \( = \frac{{0,25}}{5}.100\% = 5\% \) b) Số gam chất tan trong 100 g dung dịch ban đầu: mct =\(\frac{{100}}{5}.0,25 = 5g\) 4.9 Trong phòng thí nghiệm có 150 mL dung dịch KNO3. Một bạn hút ra 4 mL dung dịch trên, cho ra đĩa thuỷ tinh và cho vào tủ sấy. Khi khối lượng đĩa thuỷ tinh giữ nguyên không thay đổi, bạn đó thấy trên đĩa thuỷ tinh còn lại chất bột màu trắng, khối lượng đĩa tăng lên 1,01 g so với ban đầu. a) Tính nồng độ mol của dung dịch KNO3. b) Tính số gam chất tan có trong 150 mL dung dịch ban đầu. Phương pháp giải: áp dụng CM=n:V Lời giải chi tiết: a) Khi nước bay hơi hết, còn lại KNO3 không bay hơi. Khối lượng đĩa thuỷ tinh tăng lên chính là khối lượng KNO3 có trong 4 mL dung dịch. nKNO3=\(\frac{{1,01}}{{101}} = 0,01(mol)\) Nồng độ dung dịch KNO3: CM(KNO3) \( = \frac{n}{V} = \frac{{0,01}}{{0,004}} = 2,5M\) b) Số gam chất tan có trong 150 mL dung dịch ban đầu. m =\(\frac{{150}}{4}.1,01 = 37,875(g)\) 4.10 Hòa tan hoàn toàn 4 g NaOH và 2,8 g KOH vào 118,2 g nước, thu được 125 mL dung dịch. a) Tính nồng độ phần trăm của NaOH; nồng độ phần trăm của KOH. b) Tính nồng độ mol của NaOH; nồng độ mol của KOH. Phương pháp giải: Áp dụng: C% =\(\frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% \) Lời giải chi tiết: a) Nồng độ phần trăm của NaOH: C%NaOH \( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% = \frac{4}{{118,2 + 4 + 2,8}}.100\% = 3,2\% \)
Nồng độ phần trăm của KOH: C%KOH \( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% = \frac{{2,8}}{{118,2 + 4 + 2,8}}.100\% = 2,24\% \) b) Số mol NaOH: nNaOH = 4:40 = 0,1 (mol). Nồng độ mol của NaOH: CM =\(\frac{n}{V} = \frac{{0,1}}{{0,125}} = 0,8M\) Số mol KOH: nKOH =\(\frac{{2,8}}{{56}} = 0,05(mol)\) Nồng độ mol của KOH: CM =\(\frac{{0,05}}{{0,125}} = 0,4M\) 4.11 a) Cần thêm bao nhiêu gam chất rắn Na2SO4 vào 50 mL dung dịch Na2SO4 0,5 M để thu được dung dịch có nồng độ 1 M (giả sử thể tích dung dịch không đổi khỉ thêm chất rắn). b) Cần thêm bao nhiêu gam chất rắn KOH vào 75 g dung dịch KOH 10% để thu được dung dịch có nồng độ 32,5%. Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: a) Số mol Na2SO4 trong dung dịch ban đầu: nNa2SO4(bd)=CM(Na2SO4bd) x V = 0,5 x 0,05 = 0,025 (mol) V = 0,5 x 0,05 = 0,025 (mol). Số mol Na2SO4 trong dung dịch lúc sau: nNa2SO4sau=CM(Na2SO4sau) x V = 1 x 0,05 = 0,05 (mol). Số mol Na2SO4 cần thêm vào: 0,05 – 0,025 = 0,25 (mol). Khối lượng Na2SO4 cần thêm là: mNa2SO4=nNa2SO4 x MNa2SO4= 0,025 x 142 = 3,55 (gam). b) Khối lượng KOH trong dung dịch ban đầu là: mKOH= mdd .\(\frac{{C\% }}{{100\% }} = 75.\frac{{10\% }}{{100\% }} = 7,5g\) Gọi khối lượng KOH cần thêm để dung dịch có nồng độ 32,5% là x (gam). Ta có nồng độ dung dịch khi đó: C%=\(\frac{{{m_{KOH}}}}{{{m_{{\rm{dd}}}}}}.100\% = \frac{{7,5 + x}}{{75 + x}}.100\% = 32,5\% \) Giải phương trình được x = 25. 4.12 Ở nhiệt độ phòng, độ tan của KCl trong nước là 40,1 g. Một dung dịch KCl nóng có chứa 75 g KCl trong 150 g nước được làm nguội về nhiệt độ phòng, thấy có KCl rắn tách ra. a) Có bao nhiêu gam KCl còn lại trong dung dịch ở nhiệt độ phòng? b) Có bao nhiêu gam KCl rắn bị tách ra? Phương pháp giải: Ta có công thức tính độ tan: S =\(\frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\) Lời giải chi tiết: Khối lượng chất tan có trong 150 g ở nhiệt độ phòng: mct =\(\frac{{S.{m_{H2O}}}}{{100}} = \frac{{40,1.150}}{{100}} = 60,15\) b) Khối lượng KCl bị tách ra: 75 - 60,15 = 14,85 (g). 4.13 Trong phòng thí nghiệm (nhiệt độ 30 °C) có dung dịch NaCl bão hoà. Một bạn học sinh ngâm dung dịch này vào cốc nước đá để làm lạnh. Hãy dự đoán hiện tượng xảy ra trong cốc đựng dung dịch. Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: Khi nhiệt độ giảm, độ tan của NaCl sẽ giảm đi. Vậy hiện tượng sẽ quan sát được là có chất rắn NaCl tách ra khỏi dung dịch. 4.14 Trong phòng thí nghiệm có một dung dịch Na2CO3, pipette, đĩa thuỷ tinh, cân, tủ sấy. Hãy nêu các bước thực nghiệm để xác định nồng độ phần trăm của dung dịch trên. Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: Các bước xác định nổng độ C% của dung dịch: Bước 1: Cân chính xác khối lượng 1 đĩa thuỷ tinh (m0). Bước 2: Hút khoảng 5 - 10 mL dung dịch Na2CO3 và cho lên đĩa thuỷ tinh. Cân lại tổng khối lượng đĩa thuỷ tinh và dung dịch (m1). Bước 3: Cho dung dịch trên đĩa thuỷ tinh vào tủ sấy. Thỉnh thoảng lấy ra, để nguội rồi cân lại. Khi khối lượng không thay đổi nữa tức là nước đã bay hơi hết, chỉ còn lại Na2CO3 không bay hơi. Cân lại khối lượng này (m2). Cách tính nồng độ như sau: Khối lượng dung dịch là: m1 - m0. Khối lượng chất tan là: m2 - m0. Nồng trăm dung dịch sẽ được tính theo công thức: C%=\(\frac{{{m_2} - {m_0}}}{{{m_1} - {m_0}}}.100\% \) Chú ý: Cách làm trên áp dụng để tính nồng độ các dung dịch chứa chất tan không bay hơi. Đối với dung dịch chứa chất tan bay hơi như HCl, NH3,... thì không áp dụng được. 4.15 Trong phòng thí nghiệm có cân, ống đong, dung dịch H2SO4 10%. Hãy trình bày các bước thực nghiệm để tính nồng độ CM của dung dịch H2SO4 trên. Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: Bước 1: Dùng ống đong lấy chính xác 1 thể tích dung dịch, kí hiệu là V mL (ví dụ: 10mL). Vậy: V’ = 0,001.V (mL). Bước 2: Cân thể tích dung dịch này để xác định khối lượng m. Cách tính nồng độ CM như sau: Khối lượng H2SO4 trong m g dung dịch (V mL): mH2SO4 =\(m.\frac{{C\% }}{{100\% }} = m.\frac{{10\% }}{{100\% }} = 0,1m\) Số mol H2SO4 trong m g dung dịch: nH2SO4 = \(\frac{{{m_{H2SO4}}}}{{{M_{H2SO4}}}} = \frac{{0,1m}}{{98}}\) Nồng độ mol của dung dịch: CM =\(\frac{{{n_{H2SO4}}}}{{0,001v}} = \frac{{0,1m}}{{98.0,001V}} = \frac{{100}}{{98}}.\frac{m}{V}\) 4.16 Hãy tính và trình bày cách pha chế 100 mLdung dịch HCl 0,25 M bằng cách pha loãng dung dịch HCl 5 M có sẵn (dụng cụ, hoá chất có đủ). Phương pháp giải: Dựa vào công thức CM=n:V Lời giải chi tiết: Số mol HCl trong 100 mL dung dịch 0,25 M: nHCl = CM . V = 0,25 . 0,1 = 0,025 (mol). Thể tích dung dịch HCl 5 M cần lấy để có 0,025 mol HCl: V=\(\frac{{{n_{HCl}}}}{{{C_M}}} = \frac{{0,025}}{5} = {5.10^{ - 3}}(L) = 5ml\) Cách pha loãng: Bước 1: Lấy chính xác 5 mL dung dịch HCl 5 M cho vào ống đong có giới hạn đo lớn hơn hoặc bằng 100 mL. Bước 2: Cho từ từ nước cất vào dung dịch trên, thỉnh thoảng lắc đều. Đến khi thể tích dung dịch là 100 mL thì dừng lại. 4.17 Hãy tính và trình bày cách pha chế 50 g dung dịch NaCl 0,9% bằng cách pha loãng dung dịch NaCl 15% có sẵn (dụng cụ, hoá chất có đủ). Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: Số gam NaCl trong 50 g dung dịch 0,9%: mNaCl= mdd .\(\frac{{C\% }}{{100\% }} = 50.\frac{{0,9\% }}{{100\% }} = 0,45(g)\) Khối lượng dung dịch NaCl 15% cẩn lấy để có 0,45 g NaCl: mdd= mNaCl .\(\frac{{100\% }}{{C\% }} = 0,45.\frac{{100\% }}{{15\% }} = 3g\) Khối lượng nước cần thêm vào để có 50 g dung dịch 0,9%: 50 - 3 = 47 (g). Cách pha loãng: Bước 1: Cân chính xác 3 g dung dịch NaCl 15% trong cốc thuỷ tinh. Bước 2: Cân chính xác 47 g nước, cho vào cốc thuỷ tinh và lắc đều. 4.18 Để xác định độ tan của KCl ở nhiệt độ phòng, người ta làm như sau: Bước 1: Đun khoảng 60 mL nước đến 80 °C, thêm khoảng 40 g KCl vào nước nóng, khuấy đều. Bước 2: Cân 1 đĩa thuỷ tinh, thấy khối lượng 9,8 g. Bước 3: Chờ hỗn hợp hạ xuống nhiệt độ phòng, sau đó hút một lượng dung dịch, cho vào đĩa thuỷ tinh và cân, thấy khối lượng (đĩa thuỷ tinh + dung dịch) là 19,6 g. Bước 4: Cho đĩa thuỷ tinh vào tủ sấy ở 90 °C, làm khô, cân lại được khối lượng 12,6g. a) Hãy tính độ tan của KCl ở nhiệt độ phòng. b) Nếu ở bước 1 lấy nhiều hơn 40 g KCl thì có được không? Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: a) Khối lượng dung dịch bão hoà đã lấy: mdd = 19,6 - 9,8 = 9,8 (g). Khối lượng KCl trong lượng dung dịch này: mKCl = 12,6 - 9,8 = 2,8 (g). Khối lượng nước trong dung dịch bão hoà: mnước = 9,8 - 2,8 = 7,0 (g). Vậy độ tan của KCl ở nhiệt độ phòng: S=\(\frac{{{m_{KCl}}}}{{{m_{H2O}}}}.100 = \frac{{2,8}}{{7,0}}.100 = 40(g/100{H_2}O)\) b) Ban đầu lấy hơn 40 g KCl cũng được (cần lấy lượng chất tan và dung môi để đảm bảo tạo được dung dịch bão hoà ở nhiệt độ phòng). 4.19 Trong phòng thí nghiệm có các loại ống đong và cốc thuỷ tinh. Hãy tính và trình bày cách pha chế 500 mL dung dịch H2SO4 có nồng độ 1 M từ dung dịch H2SO4 có nồng độ 98%, khối lượng riêng 1,84 g/mL. Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: Số mol H2SO4 có trong 500 mL dung dịch H2SO4 nồng độ 1 M: nH2SO4=CM x V = 1 x 0,5 = 0,5 (mol). Khối lượng H2SO4 cần lấy: mH2SO4=nH2SO4 x MH2SO4 = 0,5 x 98 = 49 (g) Khối lượng dung dịch H2SO4 98% cần lấy: mdd = mH2SO4 . \(\frac{{100\% }}{{C\% }} = 49.\frac{{100}}{{98}} = 50g\) Thể tích dung dịch H2SO4 98% cần lấy: V= \(\frac{m}{D} = \frac{{50}}{{1,84}} = 27,147ml\) Cách pha: Bước 1: Dùng ống đong lấy 27,2 mL dung dịch H2SO4 98%. Bước 2: Lấy khoảng 250 mL nước vào cốc (có giới hạn đo lớn hơn hoặc bằng 500 mL). Bước 3: Rót từ từ 27,2 mL dung dịch H2SO4 98% (đã lấy ở bước 1) vào cốc nước. Chú ý: không được làm ngược lại là đổ nước vào sulfuric acid đặc). Khuấy đều dung dịch thu được. Bước 4: Thêm từ từ nước vào cốc dung dịch trong bước 3 cho đến khi được 500 mL. 4.20 a) Trộn m1 g dung dịch chất X có nồng độ C1% với m2 g dung dịch chất X có nồng độ C2%. Tính nồng độ phần trăm của dung dịch thu được theo m1, m2, C1, C2. b) Trộn V1 mL dung dịch chất Y có nồng độ C1 M với V2 mL dung dịch chất Y có nồng độ C2 M. Tính nồng độ mol của dung dịch thu được theo Vl, V2, C1, C2 (coi thể tích dung dịch thu được bằng tổng thể tích hai dung dịch ban đầu). Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: a) Khối lượng chất tan có trong dung dịch 1: mct(1)= \({m_1}.\frac{{{C_1}\% }}{{100\% }}\) Khối lượng chất tan có trong dung dịch 2: mct(2)= \({m_2}.\frac{{{C_2}\% }}{{100\% }}\) Khối lượng chất tan có trong dung dịch sau trộn là: Mct = \({m_1}.\frac{{{C_1}\% }}{{100\% }}\)+\({m_2}.\frac{{{C_2}\% }}{{100\% }}\) Khối lượng dung dịch sau khi trộn là: mdd = m1 + m2. Nồng độ dung dịch thu được sau khi trộn: C% = \(\frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% = \frac{{{m_1}.{C_1} + {m_2}.{C_2}}}{{{m_1} + {m_2}}}\)
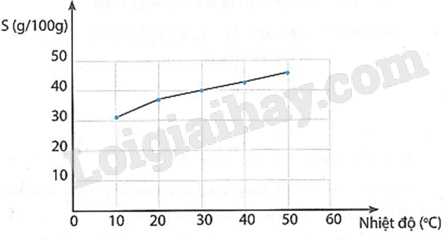
b) Số mol chất tan có trong dung dịch 1: n1=CM1.V1 Số mol chất tan có trong dung dịch 2: n2=CM2.V2 Số mol chất tan có trong dung dịch sau trộn: n = n1 + n2. Thể tích dung dịch sau khi trộn: V = V1 + V2. Nồng độ dung dịch thu được sau khi trộn: CM =\(\frac{n}{V} = \frac{{{C_{M1}}.{V_1} + {C_{M2}}.{V_2}}}{{{V_1} + {V_2}}}\) 4.21 Cho biết độ tan của KCl tại các nhiệt độ như sau:
a) Vẽ đồ thị mô tả mối quan hệ giữa độ tan của KCl và nhiệt độ (trục tung là độ tan, trục hoành là nhiệt độ). b) Nhận xét sự thay đổi độ tan theo nhiệt độ. c) Ước tính độ tan của KCl tại 25 °C. Phương pháp giải: Dựa vào dung dịch và nồng độ Lời giải chi tiết: a) Đồ thị
b) Khi nhiệt độ tăng, độ tan tăng lên. c) Ước tính độ tan của KCl tại 25 °C: khoảng 38,7 g/100 g nước (xác định trên đồ thị).
|




















Danh sách bình luận