Bài 18. Hợp chất carbonyl (aldehyde – ketone) trang 91, 92, 93, 94 SBT Hóa 11 Chân trời sáng tạoAldehyde no, đơn chức, mạch hở có công thức phân tử chung là Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
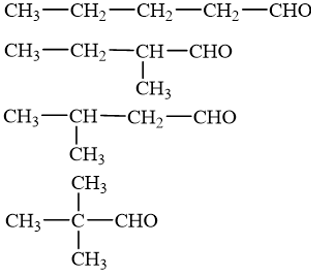
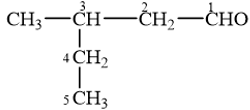
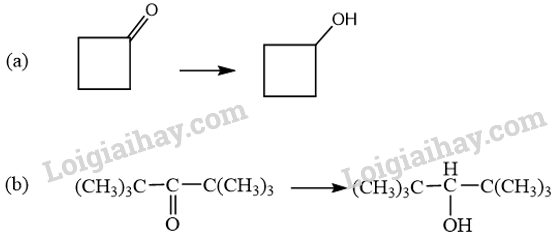
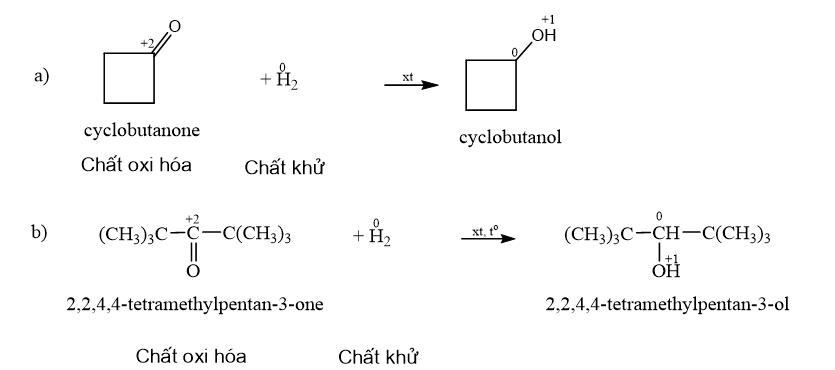
18.1 Aldehyde no, đơn chức, mạch hở có công thức phân tử chung là A. CnH2nO2 (n ≥ 1). B. CnH2nO (n ≥ 1). C. CnH2n-2O (n ≥ 3). D. CnH2n+2O (n ≥ 1). Phương pháp giải: Aldehyde no, đơn chức, mạch hở có công thức phân tử chung là CnH2nO (n ≥ 1) hoặc CnH2n+1CHO (n ≥ 1). Lời giải chi tiết: Aldehyde no, đơn chức, mạch hở có công thức phân tử chung là CnH2nO (n ≥ 1). → Chọn B. 18.2 Hợp chất có công thức C5H10O. Số đồng phân aldehyde của hợp chất là A. 2. B. 3. C. 4. D. 5. Phương pháp giải: Aldehyde là hợp chất hữu cơ trong phân tử có nhóm –CHO liên kết trực tiếp với nguyên tử carbon (của gốc hydrocarbon hoặc nhóm –CHO) hoặc nguyên tử hydrogen. Lời giải chi tiết: Đồng phân aldehyde của hợp chất có công thức C5H10O là → Chọn C. 18.3 Tên gọi của hợp chất với công thức cấu tạo CH3–CH(C2H5)CH2–CHO là A. 3-ethylbutanal. B. 3-methylpentanal. C. 3-methylbutanal. D. 3-ethylpentanal. Phương pháp giải: Tên theo danh pháp thay thế của aldehyde đơn chức mạch hở: Tên hydrocarbon tương ứng (bỏ kí tự e ở cuối) + al Đánh số các nguyên tử carbon ở mạch chính bắt đầu ở nguyên tử carbon của nhóm –CHO. Lời giải chi tiết: Tên gọi của hợp chất với công thức cấu tạo CH3–CH(C2H5)CH2–CHO là 3-methylpentanal. → Chọn B. 18.4 Formalin (còn gọi là formon) được dùng để ngâm xác động, thực vật, thuộc da, tẩy uế, diệt trùng, ... Formalin là A. dung dịch rất loãng của formaldehyde. B. dung dịch trong nước, chứa khoảng 37% – 40% acetaldehyde. C. dung dịch trong nước, chứa khoảng 37% – 40% formaldehyde. D. tên gọi khác của HCH=O. Phương pháp giải: Formaldehyde là chất khí không màu, mùi hắc và gây khó chịu. Dung dịch trong nước, chứa khoảng 37% formaldehyde gọi là formalin. Lời giải chi tiết: Formalin (còn gọi là formon) được dùng để ngâm xác động, thực vật, thuộc da, tẩy uế, diệt trùng, ... Formalin là dung dịch trong nước, chứa khoảng 37% – 40% formaldehyde. → Chọn C. 18.5 Thực hiện phản ứng khử hợp chất (X) bằng hydrogen có xúc tác thích hợp, thu được 2-methylpropan-1-ol (isobutyl alcohol). Công thức của (X) là A. CH3–CH2–CHO. B. CH2=CH-CH2-CH2OH. C. CH3–CH=C(CH3)CHO. D. CH2=C(CH3)–CHO. Phương pháp giải: Hợp chất aldehyde bị khử bởi hydrogen ở vị trí có các liên kết π. Đáp án đúng là aldehyde có khung carbon giống 2-methylpropan-1-ol. Lời giải chi tiết: Khử CH2=C(CH3)–CHO bằng hydrogen có xúc tác thích hợp, thu được 2-methylpropan-1-ol
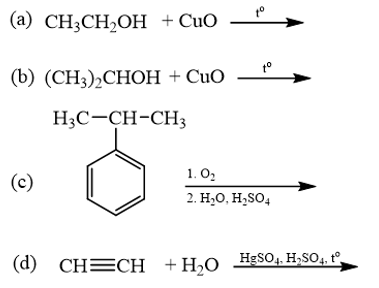
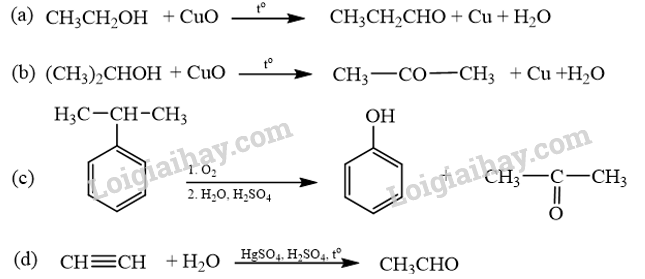
18.6 Cho các phản ứng sau:
Những phản ứng sản phẩm tạo thành aldehyde là A. (a). B. (c). C. (a) và (d). D. (b) và (c). Phương pháp giải: Các alcohol bậc bị oxi hóa bởi CuO tạo aldehyde. Phản ứng cộng nước vào alkyne thu được aldehyde. Lời giải chi tiết:
Những phản ứng sản phẩm tạo thành aldehyde là (a) và (d). → Chọn C. 18.7 Cho các phát biểu sau: (a) Aldehyde có nhóm carbonyl trong phân tử còn alcohol thì không. (b) Aldehyde phản ứng với nước bromine còn alcohol thì phản ứng dễ dàng với sodium. (c) Aldehyde có phản ứng với Cu(OH)2 trong môi trường base còn alcohol thì có phản ứng tráng bạc. (d) Aldehyde có phản ứng với hydrogen cyanide còn alcohol thì không. Những phát biểu đúng về sự khác biệt giữa aldehyde và alcohol là A. (a), (b). B. (a), (b) và (d). C. (a), (c) và (d). D. (b) và (c). Phương pháp giải: Aldehyde là hợp chất hữu cơ trong phân tử có nhóm –CHO liên kết trực tiếp với nguyên tử carbon (của gốc hydrocarbon hoặc nhóm –CHO) hoặc nguyên tử hydrogen. Tính chất hóa học: Phản ứng khử, phản ứng oxi hóa, phản ứng cộng, phản ứng tạo iodoform. Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no. Alcohol có khả năng tham gia phản ứng thế nguyên tử hydrogen của nhóm – OH; phản ứng tạo thành ether; phản ứng tạo thành alkene; phản ứng oxi hoá. Polyalcohol có các nhóm -OH kề nhau có thể tạo phức với Cu(OH)2. Lời giải chi tiết: (a) Aldehyde có nhóm carbonyl trong phân tử còn alcohol thì không. → Đúng. Aldehyde có nhóm carbonyl ( (b) Aldehyde phản ứng với nước bromine còn alcohol thì phản ứng dễ dàng với sodium. → Đúng. Aldehyde bị oxi hóa bởi nước bromine, kết quả làm nước bromine mất màu. Alcohol có phản ứng thế nguyên tử H của nhóm hydroxyl bởi kim loại kiềm (Na). (c) Aldehyde có phản ứng với Cu(OH)2 trong môi trường base còn alcohol thì có phản ứng tráng bạc. → Sai. Aldehyde có phản ứng với Cu(OH)2 trong môi trường base và phản ứng tráng bạc. Alcohol không có phản ứng tráng bạc. (d) Aldehyde có phản ứng với hydrogen cyanide còn alcohol thì không. → Đúng. Aldehyde phản ứng với hydrogen cyanide tạo cyanohydrin. Alcohol không có phản ứng với hydrogen cyanide. Những phát biểu đúng về sự khác biệt giữa aldehyde và alcohol là (a), (b) và (d). → Chọn B. 18.8 Cho các phát biểu sau: (a) Formaldehyde dùng làm nguyên liệu sản xuất nhựa phenol formaldehyde. (b) Có thể điều chế aldehyde trực tiếp từ bất kì alcohol nào. (c) Formalin hay formon là dung dịch của methanal trong nước. (d) Acetaldehyde được dùng để sản xuất acetic acid trong công nghiệp. Số phát biểu đúng là A. 2. B. 3. C. 1. D. 4. Phương pháp giải: - Formaldehyde: ứng dụng trong công nghiệp dệt, sản xuất nhựa phenol formaldehyde, chất dẻo, xây dựng, mỹ phẩm, keo dán, thuốc nổ, giấy than, mực máy photocopy, ... - Điều chế aldehyde từ alcohol bậc I: \[{\rm{R - C}}{{\rm{H}}_{\rm{2}}}{\rm{OH + CuO}} \to {\rm{R - CHO + }}{{\rm{H}}_{\rm{2}}}{\rm{O + Cu}}\] - Formalin (còn gọi là formon) được dùng để ngâm xác động, thực vật, thuộc da, tẩy uế, diệt trùng, ... Formalin là dung dịch trong nước, chứa khoảng 37% – 40% formaldehyde. - Trong công nghiệp, acetic acid được sản xuất bằng cách oxi hóa các alkane khai thác từ dầu mỏ. Lời giải chi tiết: (a) Formaldehyde dùng làm nguyên liệu sản xuất nhựa phenol formaldehyde. → Đúng. (b) Có thể điều chế aldehyde trực tiếp từ bất kì alcohol nào. → Sai. Chỉ điều chế aldehyde trực tiếp bằng alcohol bậc I. (c) Formalin hay formon là dung dịch của methanal trong nước. → Đúng. Formalin hay formon là dung dịch của methanal (formaldehyde) trong nước. (d) Acetaldehyde được dùng để sản xuất acetic acid trong công nghiệp. → Sai. Trong công nghiệp, acetic acid được sản xuất bằng cách oxi hóa các alkane khai thác từ dầu mỏ. Số phát biểu đúng là 2. → Chọn A. 18.9 Oxi hoá alcohol đơn chức (X) bằng CuO (đun nóng), sinh ra một sản phẩm hữu cơ duy nhất là ketone (Y) (tỉ khối hơi của (Y) so với khí hydrogen bằng 29). Công thức cấu tạo của (X) là A. CH3-CH(OH)-CH3. B. CH3-CH(OH)-CH2-CH3. C. CH3-CO-CH3. D. CH3-CH2-CH2-OH. Phương pháp giải: Alcohol bậc II bị oxi hóa bởi CuO (đun nóng) tạo ketone. Tìm công thức cấu tạo của ketone rồi suy ra công thức cấu tạo của X. Lời giải chi tiết: \({{\rm{d}}_{{\raise0.7ex\hbox{${\rm{Y}}$} \!\mathord{\left/ {\vphantom {{\rm{Y}} {{{\rm{H}}_{\rm{2}}}}}}\right.\kern-\nulldelimiterspace} \!\lower0.7ex\hbox{${{{\rm{H}}_{\rm{2}}}}$}}}} = 29 \Leftrightarrow \frac{{{{\rm{M}}_{\rm{Y}}}}}{{{{\rm{M}}_{{{\rm{H}}_{\rm{2}}}}}}} = 29 \Rightarrow {{\rm{M}}_{\rm{Y}}} = 29 \times 2 = 58\) Oxi hoá alcohol đơn chức (X) ta thu được ketone đơn chức (Y). Công thức phân tử của ketone đơn chức (Y) là CnH2nO (n ≥ 2). Ta có: \({{\rm{M}}_Y} = 12{\rm{n}} + 2{\rm{n}} + 16\) \(\begin{array}{l} \Leftrightarrow 58 = 14{\rm{n}} + 16\\ \Rightarrow {\rm{n}} = \frac{{58 - 16}}{{14}} = 3\end{array}\) \( \Rightarrow \)Công thức cấu tạo của Y là: CH3-CO-CH3. \( \Rightarrow \)Công thức cấu tạo của X là: CH3-CH(OH)-CH3. → Chọn A. 18.10 Cho 1 mL dung dịch AgNO3 1% vào ống nghiệm sạch, lắc nhẹ, sau đó nhỏ từ từ từng giọt dung dịch NH3 cho đến khi kết tủa sinh ra bị hoà tan hết. Nhỏ tiếp 3 – 5 giọt dung dịch (X), đun nóng nhẹ hỗn hợp ở khoảng 60 °C – 70 °C trong vài phút, trên thành ông nghiệm xuất hiện lớp bạc sáng như gương. Chất (X) là chất nào sau đây? A. Butanone. B. Ethanol. C. Formaldehyde. D. Glycerol. Phương pháp giải: Aldehyde phản ứng với thuốc thử Tollens (dung dịch AgNO3/ NH3) tạo lớp bạc bám (phản ứng tráng bạc). Lời giải chi tiết: Chất (X) có phản ứng với dung dịch AgNO3/ NH3 tạo lớp bạc, (X) là aldehyde. → Chọn C. 18.11 Acetone được điều chế bằng cách oxi hoá cumene nhờ oxygen, sau đó thuỷ phân trong dung dịch H2SO4 loãng. Để thu được 87 gam acetone thì lượng cumene cần dùng (giả sử hiệu suất quá trình điều chế đạt 80%) là A. 144 gam. B. 180 gam. C. 225 gam. D. 216 gam. Phương pháp giải: Sử dụng công thức: \[{{\rm{m}}_{{\rm{sp(tt)}}}} = {{\rm{m}}_{{\rm{sp(lt)}}}} \times \frac{{{\rm{H\% }}}}{{{\rm{100\% }}}}\] Lời giải chi tiết: Ta có: \[{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COC}}{{\rm{H}}_{\rm{3}}}}} = \frac{{87}}{{58}} = 1,5{\rm{ (mol)}}\]
\( \Rightarrow {{\rm{n}}_{{\rm{cumene}}}} = {{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{OC}}{{\rm{H}}_{\rm{3}}}}} = 1,5{\rm{ (mol)}}\) \(\begin{array}{l} \Rightarrow {{\rm{m}}_{{\rm{cumene (LT)}}}} = 1,5 \times 120 = 180{\rm{ (g)}}\\ \Rightarrow {{\rm{m}}_{{\rm{cumene (TT)}}}} = 180 \times \frac{{80\% }}{{100\% }} = 144{\rm{ (g)}}\end{array}\) → Chọn A. 18.12 Thực hiện phản ứng oxi hoá 4,958 L C2H4 (đkc) bằng O2 (xúc tác PdCl2, CuCl2) thu được chất (X) đơn chức. Cho toàn bộ lượng chất (X) tác dụng với hydrogen cyanide (HCN) dư, thu được 7,1 gam CH3CH(CN)OH (cyanohydrin). Hiệu suất quá trình tạo CH3CH(CN)OH từ C2H4 là A. 70%. B. 50%. C. 60%. D. 80%. Phương pháp giải: Aldehyde phản ứng với hydrogen cyanide tạo cyanohydrin: \[{\rm{R}} - {\rm{CH}} = {\rm{O}} + {\rm{HCN}} \to {\rm{R}} - {\rm{CH}}({\rm{CN}}) - {\rm{OH}}\] Sử dụng công thức: \[{\rm{H\% }} = \frac{{{{\rm{n}}_{{\rm{sp(tt)}}}}}}{{{{\rm{n}}_{{\rm{sp(lt)}}}}}} \times 100\% \] Lời giải chi tiết: Ta có: \({{\rm{n}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{4}}}}} = \frac{{4,958}}{{24,79}} = 0,2{\rm{ (mol); }}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{CH}}\left( {{\rm{CN}}} \right){\rm{OH (tt)}}}} = \frac{{7,1}}{{71}} = 0,1{\rm{ (mol)}}{\rm{.}}\) Sơ đồ phản ứng: \( \Rightarrow {{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{CH}}\left( {{\rm{CN}}} \right){\rm{OH (lt)}}}} = {{\rm{n}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{4}}}}} = 0,2{\rm{ (mol)}}\) \( \Rightarrow \)Hiệu suất quá trình tạo CH3CH(CN)OH từ C2H4 (tính theo CH3CH(CN)OH): \({\rm{H\% }} = \frac{{0,1}}{{0,2}} \times 100\% = 50\% \) → Chọn B. 18.13 Thực hiện thí nghiệm sau: Nhỏ từ từ dung dịch sodium hydroxide 10% vào ống nghiệm có chứa vài giọt dung dịch copper(II) sulfate 5% cho đến khi kết tủa xanh không tăng thêm nữa, nhỏ tiếp 2 – 3 mL dung dịch formaldehyde (HCHO) 10%. Đun nóng hỗn hợp xuất hiện kết tủa vàng, sau đó kết tủa chuyển sang màu đỏ gạch. Giải thích và viết phương trình hoá học minh hoạ. Phương pháp giải: Trong môi trường kiềm, Cu(OH)2 oxi hoá hầu hết các aldehyde thành muối carboxylate và sinh ra kết tủa Cu2O có màu đỏ gạch. Lời giải chi tiết: Khi cho dung dịch NaOH vào dung dịch CuSO4 đến khi kết tủa không tăng thêm nữa, ta thu được kết tủa xanh lam Cu(OH)2 – Copper(II) hydroxide. 2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4 Nhỏ vào ống nghiệm trên dung dịch HCHO, đun nóng nhẹ hỗn hợp trong ống nghiệm trên ngọn lửa đèn cồn, xuất hiện kết tủa vàng Cu(OH). HCHO + 2Cu(OH)2 + NaOH --> HCOONa + Cu(OH) + 3H2O Tiếp tục đun nóng nhẹ hỗn hợp trong ống nghiệm trên ngọn lửa đèn cồn, kết tủa vàng Cu(OH) chuyển sang màu đỏ gạch của Cu2O. 2Cu(OH) --> Cu2O HCHO + 4Cu(OH)2 + 2NaOH --> Na2CO3+ 2Cu2O + 6H2O 18.14 Cho hỗn hợp (X) gồm 0,1 mol propenal và khí hydrogen qua ống sứ nung nóng có chứa Ni làm xúc tác, thu được hỗn hợp (Y) gồm propanal, propan-1-ol, propenal và 0,15 mol khí hydrogen. a) Viết các phản ứng hoá học xảy ra. b) Tính số mol khí hydrogen trong hỗn hợp (X) ban đầu, biết tỉ khối hơi của hỗn hợp (Y) so với CH4 bằng 1,55. Phương pháp giải: a) Hợp chất aldehyde bị khử bởi hydrogen ở vị trí có các liên kết π. b) Tính số mol của (Y) và khối lượng của (Y). Tính khối lượng H2 trong (X) rồi suy ra số mol H2 trong (X). Lời giải chi tiết: a) Hỗn hợp (Y) gồm propanal, propan-1-ol, propenal và hydrogen. Các phản ứng hóa học xảy ra:
b) Ta có: \({{\rm{n}}_{{\rm{propanal}}}} + {{\rm{n}}_{{\rm{propan - 1 - ol}}}} + {{\rm{n}}_{{\rm{propenal}}}} = {{\rm{n}}_{{\rm{propenal/X}}}} = 0,1{\rm{ (mol)}}\) \(\begin{array}{l} \Rightarrow {{\rm{n}}_{\rm{Y}}} = {{\rm{n}}_{{\rm{propanal}}}} + {{\rm{n}}_{{\rm{propan - 1 - ol}}}} + {{\rm{n}}_{{\rm{propenal}}}} + {{\rm{n}}_{{{\rm{H}}_{\rm{2}}}}}\\{\rm{ = 0,1 + 0,15 = 0,15 (mol)}}\end{array}\) Vì \({{\rm{d}}_{{\raise0.7ex\hbox{${\rm{Y}}$} \!\mathord{\left/ {\vphantom {{\rm{Y}} {{\rm{C}}{{\rm{H}}_{\rm{4}}}}}}\right.\kern-\nulldelimiterspace} \!\lower0.7ex\hbox{${{\rm{C}}{{\rm{H}}_{\rm{4}}}}$}}}} = 1,55 \Leftrightarrow \frac{{{{\rm{M}}_{\rm{Y}}}}}{{{{\rm{M}}_{{\rm{C}}{{\rm{H}}_{\rm{4}}}}}}} = 1,55 \Rightarrow {{\rm{M}}_{\rm{Y}}} = 1,55 \times 16 = 24,8{\rm{ (g)}}\) \( \Rightarrow {{\rm{m}}_{\rm{Y}}} = 0,25 \times 24,8 = 6,2{\rm{ (g)}}\) Bảo toàn khối lượng, ta có khối lượng hỗn hợp trước và sau phản ứng bằng nhau nên: \({{\rm{m}}_{\rm{X}}}{\rm{ = }}{{\rm{m}}_{\rm{Y}}} = 6,2{\rm{ (g)}}\) Mặt khác: \({{\rm{m}}_{\rm{X}}}{\rm{ = }}{{\rm{m}}_{{\rm{propenal}}}} + {{\rm{m}}_{{{\rm{H}}_{\rm{2}}}}}\) \(\begin{array}{l} \Rightarrow {{\rm{m}}_{{{\rm{H}}_{\rm{2}}}}} = {{\rm{m}}_{\rm{X}}} - {\rm{ }}{{\rm{m}}_{{\rm{propenal}}}} = 6,2 - 0,1 \times 56 = 0,6{\rm{ (g)}}\\ \Rightarrow {{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{/X}}}} = \frac{{0,6}}{2} = 0,3{\rm{ (mol)}}\end{array}\) 18.15 Có nhiều vụ tai nạn giao thông xảy ra do người lái xe sử dụng rượu, bia khi tham gia giao thông. Theo Nghị định 100/2019/NĐ-CP, người điều khiển giao thông không được có nồng độ cồn trong máu hoặc hơi thở. Để xác định hàm lượng rượu trong máu người lái xe, người ta sử dụng phương pháp chuẩn độ ethanol có trong mẫu huyết tương bằng K2Cr2O7 môi trường acid. Khi đó \(\mathop {{\rm{Cr}}}\limits^{ + 6} \)bị khử thành (đối từ màu vàng cam sang xanh), C2H5OH bị oxi hoá thành CH3CHO. a) Hãy viết phương trình hoá học của phản ứng. b) Khi chuẩn độ 5 mL mẫu huyết tương máu của một người lái xe cần dùng 2 mL dung dịch K2Cr2O7 0,01 M. Vậy người này có vi phạm luật khi tham gia điều khiển phương tiện giao thông hay không? Tại sao? Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7. Phương pháp giải: a) Chất phản ứng: K2Cr2O7, C2H5OH, H2SO4. Sản phẩm: CH3CHO, Cr2(SO4)3, K2SO4, H2O. b) Tính số mol K2Cr2O7, từ đó tính số mol của C2H5OH và khối lượng C2H5OH. Lời giải chi tiết: a) Phương trình hóa học: \({\rm{3C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{OH}} + {{\rm{K}}_{\rm{2}}}{\rm{C}}{{\rm{r}}_{\rm{2}}}{\rm{O}}{}_{\rm{7}} + {\rm{ }}4{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to 3{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{CHO}} + {\rm{C}}{{\rm{r}}_{\rm{2}}}{{\rm{(S}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}} + {{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} + 7{{\rm{H}}_{\rm{2}}}{\rm{O}}\) b) Ta có: \({{\rm{n}}_{{{\rm{K}}_{\rm{2}}}{\rm{C}}{{\rm{r}}_{\rm{2}}}{{\rm{O}}_{\rm{7}}}}} = 0,01 \times 2 \times {10^{ - 3}} = 2 \times {10^{ - 5}}{\rm{ (mol)}}\) Theo phương trình hóa học: \({{\rm{n}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = 3{{\rm{n}}_{{{\rm{K}}_{\rm{2}}}{\rm{C}}{{\rm{r}}_{\rm{2}}}{{\rm{O}}_{\rm{7}}}}} = 2 \times {10^{ - 5}}{\rm{ (mol)}}\) \( \Rightarrow {{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = 46 \times 6 \times {10^{ - 5}}{\rm{ = 2,76}} \times {\rm{1}}{{\rm{0}}^{ - 3}}{\rm{ (g)}}\) Trong 100 mL máu của người này có: \({{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = {\rm{2,76}} \times {\rm{1}}{{\rm{0}}^{ - 3}} \times \frac{{100}}{5} = 0,0552{\rm{ (g) = 55,2 (mg)}}\) Vậy người này vi phạm luật khi tham gia điều khiển phương tiện giao thông vì có nồng độ cồn trong máu. 18.16 Cho nhận định sau: Sự biến đổi aldehyde thành alcohol là sự khử, không phải sự oxi hoá. Giải thích nhận định trên và viết phương trình hoá học của phản ứng minh hoạ cho nhận định vừa nêu. Phương pháp giải: - Chất khử là chất nhường electron hay là chất có số oxi hoá tăng sau phản ứng. - Chất oxi hoá là chất nhận electron hay chất có số oxi hoá giảm sau phản ứng. - Sự oxi hoá (quá trình oxi hóa) của một chất là làm cho chất đó nhường electron hay làm tăng số oxi hoá chất đó. - Sự khử (quá trình khử) của một chất là làm cho chất đó nhận electron hay làm giảm số oxi hoá chất đó. Lời giải chi tiết:
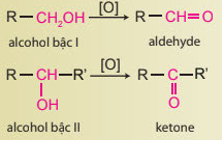
Trong phản ứng trên, số oxi hóa của C trong aldehyde giảm. Do đó aldehyde là chất oxi hóa. Quá trình thay đổi số oxi hóa của C là quá trình khử: \(\mathop {\rm{C}}\limits^{ + 1} + 2{\rm{e}} \to \mathop {\rm{C}}\limits^{ - 1} \) Vậy nên sự biến đổi aldehyde thành alcohol là sự khử. 18.17 Hoàn thành phương trình hoá học của các phản ứng theo sơ đồ sau:
Xác định các chất oxi hoá và chất khử. Gọi tên các chất phản ứng và sản phẩm của các phản ứng. Phương pháp giải: - Chất khử là chất nhường electron hay là chất có số oxi hoá tăng sau phản ứng. - Chất oxi hoá là chất nhận electron hay chất có số oxi hoá giảm sau phản ứng. Lời giải chi tiết:
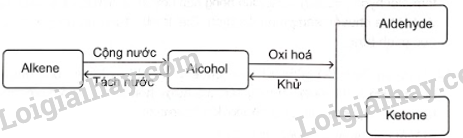
18.18 Cho sơ đồ phản ứng sau:Từ alkene ban đầu là C3H6 hãy viết các phản ứng tạo ra sản phẩm như sơ đồ trên (kèm điều kiện phản ứng).
Phương pháp giải: - Alkene không đối xứng tác dụng với hydrogen halide (HX) tạo thành hỗn hợp sản phẩm, trong đó sản phẩm chính tuân theo quy tắc Markovnikov: “Nguyên tử hydrogen ưu tiên cộng vào nguyên tử carbon chưa no có nhiều hydrogen hơn, còn nguyên tử X ưu tiên cộng vào nguyên tử carbon chưa no có ít hydrogen hơn". - Phản ứng tách nước từ alkanol tạo alkene. Có thể dự đoán sản phẩm chính và phụ của phản ứng dựa vào quy tắc Zaitsev. - Trong điều kiện thích hợp, một số alcohol bị oxi hóa không hoàn toàn thành aldehyde hoặc ketone. - Aldehyde bị khử bằng NaBH4 hoặc LiAlH4 sinh ra alcohol bậc một; ketone bị khử bằng NaBH4 hoặc LiAlH4 sinh ra alcohol bậc hai. Lời giải chi tiết:
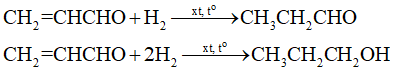
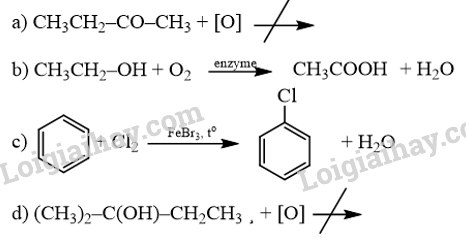
18.19 Nấu rượu nếp là một truyền thống phổ biến ở các làng quê Việt Nam. Rượu thành phẩm được nhiều người ưa chuộng bởi hương vị, mùi thơm đặc trưng của loại nếp cái hoa vàng, nếp cẩm chất lượng. Tuy nhiên, trong rượu vẫn còn một lượng aldehyde gây ảnh hưởng đến sức khoẻ người sử dụng, do các cơ sở sản xuất không đảm bảo quy trình được lọc đúng cách, làm cho rượu thành phẩm có lượng aldehyde vượt mức cho phép. a) Thành phần aldehyde trong rượu được tạo ra như thế nào? b) Aldehyde trong rượu ảnh hưởng như thế nào đến sức khoẻ người sử dụng? c) Giới hạn an toàn cho nồng độ aldehyde trong rượu uống là bao nhiêu? Phương pháp giải: a) Alcohol ethylic trong rượu bị oxi hóa tạo acetaldehyde. b) CH3CHO là nguyên nhân gây đau đầu, chóng mặt, sốc rượu khi uống bởi chất này kích thích hệ tiêu hóa vè hệ tuần hoàn hoạt động mạnh mẽ, làm tăng huyết áp đột ngột. c) Theo Tiêu chuẩn Việt Nam 7043 – 3013, hàm lượng aldehyde trong rượu trắng được quy định đạt chuẩn (không gây hại) không được phép vượt quá 50 mg trên 1 L rượu (tính theo đơn vị rượu 100°). Lời giải chi tiết: a) Aldehyde được hình do sự oxi hóa của ethanol: b) CH3CHO là nguyên nhân gây đau đầu, chóng mặt, sốc rượu khi uống bởi chất này kích thích hệ tiêu hóa vè hệ tuần hoàn hoạt động mạnh mẽ, làm tăng huyết áp đột ngột. Nếu hàm lượng aldehyde trong rượu vượt ngưỡng cho phép có thể ảnh hưởng tới não bộ, dẫn đến nhiều biến chứng nguy hiểm cần chữa trị ở các cơ sở Y tế một cách kịp thời. c) Theo Tiêu chuẩn Việt Nam 7043 – 3013, hàm lượng aldehyde trong rượu trắng được quy định đạt chuẩn (không gây hại) không được phép vượt quá 50 mg trên 1 L rượu (tính theo đơn vị rượu 100°). Ví dụ xét đến 1 L rượu nếp 40° thì hàm lượng aldehyde trong rượu không được vượt quá 20 mg. 18.20 Trong các phản ứng sau đây, phản ứng nào không thể xảy ra? Hoàn thành phương trình hoá học các phản ứng xảy ra.
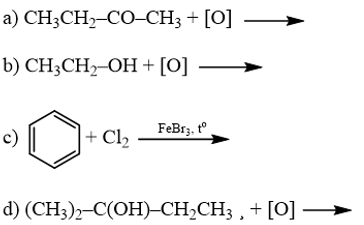
Phương pháp giải: Không có phản ứng oxi hóa ketone và alcohol bậc III. Oxi hóa ethanol tạo acetic acid. Phản ứng thế benzene bằng chlorine thu được dẫn xuất halogen. Lời giải chi tiết:
18.21 Cho 50 gam dung dịch acetaldehyde tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 21,6 gam Ag. Tính nồng độ phần trăm của acetaldehyde trong dung dịch đã sử dụng. Phương pháp giải: Phản ứng tráng bạc của aldehyde: RCH=O + 2[Ag(NH3)2]OH --> RCOONH4 + 2Ag + 3NH3 + H2O Sử dụng công thức: \[{\rm{C\% }} = \frac{{{{\rm{m}}_{{\rm{ct}}}}}}{{{{\rm{m}}_{{\rm{dd}}}}}} \times 100\% \] Lời giải chi tiết: Ta có: \[{{\rm{n}}_{{\rm{Ag}}}} = \frac{{21,6}}{{108}} = 0,2{\rm{ }}({\rm{mol}})\]
Theo phương trình hóa học, ta có: \[{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{CHO}}}} = \frac{1}{2}{{\rm{n}}_{{\rm{Ag}}}} = \frac{1}{2} \times 0,2 = 0,1{\rm{ }}({\rm{mol}})\] \[\begin{array}{l} \Rightarrow {{\rm{m}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{CHO}}}} = 0,1 \times 44 = 4,4{\rm{ }}({\rm{g}})\\ \Rightarrow {\rm{C}}{{\rm{\% }}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{CHO}}}} = \frac{{4,4}}{{50}} \times 100\% = 8,8\% \end{array}\] 18.22 Aldehyde (X) no đơn chức mạch hở không nhánh. Phân tử khối của (X) được xác định thông qua kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất ở hình dưới đây. a) Hãy xác định công thức phân tử và viết công thức cấu tạo của aldehyde (X). b) Gọi tên (X) theo danh pháp thay thế. Phương pháp giải: Phân tử khối của (X) được xác định thông qua kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất. Aldehyde no, hở, đơn có công thức phân tử chung là CnH2nO (n ≥ 1). Tên theo danh pháp thay thế của aldehyde đơn chức mạch hở: Tên hydrocarbon tương ứng (bỏ kí tự e ở cuối) + al Đánh số các nguyên tử carbon ở mạch chính bắt đầu ở nguyên tử carbon của nhóm -CHO. Lời giải chi tiết: a) Công thức phân tử của aldehyde (X) là CnH2nO (n ≥ 1). Vì phân tử khối của (X) là kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất. Nên ta có: Phân tử khối của (X) là 72. \[\begin{array}{l} \Leftrightarrow {{\rm{M}}_{{{\rm{C}}_{\rm{n}}}{{\rm{H}}_{{\rm{2n}}}}{\rm{O}}}} = 72\\ \Leftrightarrow 12{\rm{n}} + 2{\rm{n}} + 16 = 72\\ \Leftrightarrow 14{\rm{n + 16}} = 72\\ \Rightarrow {\rm{n}} = \frac{{72 - 16}}{{14}} = 4\end{array}\] \[ \Rightarrow \] Công thức phân tử của aldehyde (X) là C4H8O. Vì aldehyde (X) có mạch không phân nhánh nên công thức cấu tạo của (X) là: CH3CH2CH2CHO. b) Tên gọi của (X) theo danh pháp thay thế là butanal.
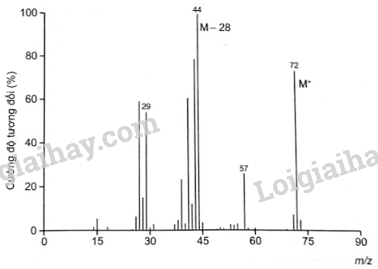
|














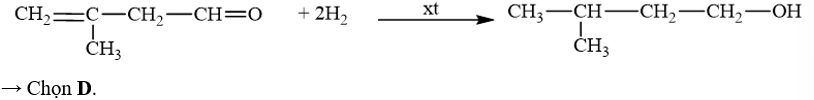
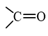 ), alcohol có nhóm hydroxyl (-OH) không có nhóm carbonyl.
), alcohol có nhóm hydroxyl (-OH) không có nhóm carbonyl.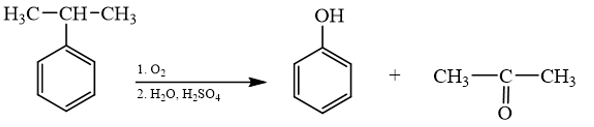

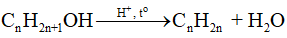
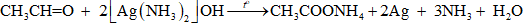






Danh sách bình luận