Bài 15. Dẫn xuất halogen trang 70, 71, 72, 73, 74 SBT Hóa 11 Chân trời sáng tạoHợp chất thuộc loại dẫn xuất halogen của hydrocarbon là Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
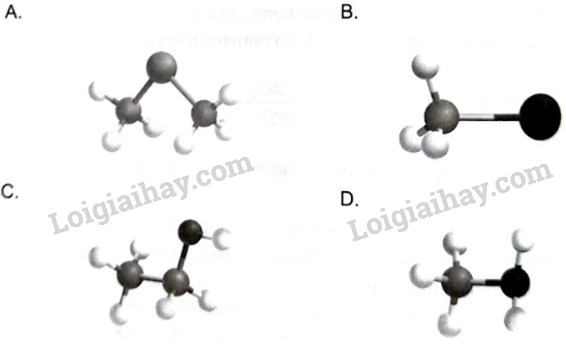
15.1 Hợp chất thuộc loại dẫn xuất halogen của hydrocarbon là A. HIO4. B. C3H3N. C. CH2BrCl. D. C6H6O. Phương pháp giải: Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng một hay nhiều nguyên tử halogen, ta được dẫn xuất halogen của hydrocarbon. Lời giải chi tiết: Hợp chất thuộc loại dẫn xuất halogen của hydrocarbon là CH2BrCl. → Chọn C. 15.2 Số liên kết của nguyên tử halogen trong phân tử dẫn xuất halogen của hydrocarbon là A. 1. B. 2. C. 3. D. 4. Phương pháp giải: Các nguyên tử nhóm halogen có hóa trị I. Do đó, số liên kết của nguyên tử halogen trong phân tử dẫn xuất halogen của hydrocarbon là 1. Lời giải chi tiết: Số liên kết của nguyên tử halogen trong phân tử dẫn xuất halogen của hydrocarbon là 1. → Chọn A. 15.3 Mô hình phân tử nào là dẫn xuất halogen của hydrocarbon?
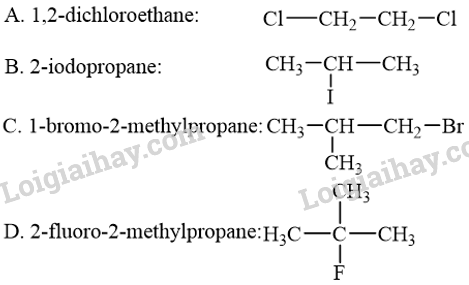
Phương pháp giải: Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng một hay nhiều nguyên tử halogen, ta được dẫn xuất halogen của hydrocarbon. Lời giải chi tiết: Trong dẫn xuất halogen của hydrocarbon, nguyên tử halogen liên kết trực tiếp với nguyên tử carbon và halogen chỉ tạo được 1 liên kết trong phân tử. Do đó, mô hình B là dẫn xuất halogen của hydrocarbon. → Chọn B. 15.4 Bậc của dẫn xuất halogen là bậc của nguyên tử carbon liên kết với nguyên tử halogen. Bậc của dẫn xuất halogen nào sau đây là không phù hợp? A. Dẫn xuất halogen bậc I. B. Dẫn xuất halogen bậc II. C. Dẫn xuất halogen bậc III. D. Dẫn xuất halogen bậc IV. Phương pháp giải: Bậc của một nguyên tử carbon trong phân tử alkane được xác định bằng số nguyên tử carbon liên kết trực tiếp với nguyên tử carbon đó. Bậc của dẫn xuất halogen chính là bậc của nguyên tử C liên kết trực tiếp với nguyên tử halogen. Lời giải chi tiết: Carbon có hóa trị IV. Khi nguyên tử C liên kết trực tiếp với nguyên tử halogen thì nguyên tử C này chỉ có thể liên kết tối đa với 3 nguyên tử carbon khác, có nghĩa là chỉ có dẫn xuất halogen bậc I, II, III. Không có dẫn xuất halogen bậc IV. → Chọn D. 15.5 Dẫn xuất halogen bậc II có tên và công thức cấu tạo phù hợp là
Phương pháp giải: - Bậc của dẫn xuất halogen chính là bậc của nguyên tử C liên kết trực tiếp với nguyên tử halogen. - Tên thay thế của dẫn xuất halogen:
Lời giải chi tiết: Các dẫn xuất halogen trong đáp án A, C và D lần lượt là dẫn xuất halogen bậc I, I và III. Dẫn xuất halogen trong đáp án B là dẫn xuất halogen bậc II. → Chọn B. 15.6 Công thức cấu tạo nào sau đây ứng với tên gọi không đúng? A. CH3Cl: chloromethane. B. ClCH2Br: chlorobromomethane. C. CH3CH2l: iodoethane. D. CH3CH(F)CH3: 2-fluoropropane. Phương pháp giải: Phương pháp: Tên thay thế của dẫn xuất halogen:
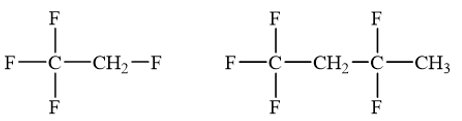
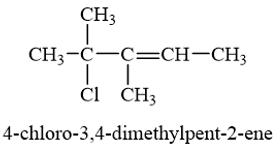
Lời giải chi tiết: Công thức cấu tạo ClCH2Br: chlorobromomethane. Vì theo thứ tự chữ cái, “b” đứng trước “c”, do đó tên gọi của dẫn xuất halogen trên là “bromochloromethane”. → Chọn B. 15.7 Nhiệt độ sôi của các dẫn xuất halogen được sắp xếp theo thứ tự: CH3F < CH3Cl < CH3Br < CH3I. Nguyên nhân dẫn đến sự tăng dần nhiệt độ sôi từ CH3F đến CH3I là do A. sự phân cực của liên kết carbon – halogen giảm dần từ CH3F đến CH3I. B. độ âm điện của các halogen trong dẫn xuất giảm dần từ F đến I. C. tương tác van der Waals tăng dần từ CH3F đến CH3I. D. độ dài liên kết carbon – halogen tăng dần từ CH3F đến CH3I. Phương pháp giải: Nhiệt độ sôi của các dẫn xuất halogen có xu hướng tăng dần theo chiều tăng khối lượng phân tử vì tương tác van der Waals tăng dần theo chiều tăng khối lượng phân tử. Lời giải chi tiết: Nhiệt độ sôi của các dẫn xuất halogen được sắp xếp theo thứ tự: CH3F < CH3Cl < CH3Br < CH3I. Nguyên nhân dẫn đến sự tăng dần nhiệt độ sôi từ CH3F đến CH3I là do tương tác van der Waals tăng dần từ CH3F đến CH3I. → Chọn C. 15.8 Phát biểu nào sau đây không phù hợp với tính chất vật lí của dẫn xuất halogen? A. Trong điều kiện thường, dẫn xuất halogen tồn tại ở 3 thể rắn, lỏng hoặc khí. B. Dẫn xuất halogen không tan trong nước và các dung môi hữu cơ, C. Một số dẫn xuất halogen có hoạt tính sinh học. D. Các dẫn xuất halogen có khối lượng phân tử nhỏ thường là chất khí ở điều kiện thường. Phương pháp giải: Tính chất vật lí của dẫn xuất halogen: + Trong điều kiện thường, dẫn xuất halogen tồn tại ở 3 thể rắn, lỏng hoặc khí. + Nhiệt độ sôi của các dẫn xuất halogen có xu hướng tăng dần theo chiều tăng khối lượng phân tử. + Dẫn xuất halogen không tan trong nước nhưng tan trong các dung môi hữu cơ như alcohol, ether, benzene. + Một số dẫn xuất halogen có hoạt tính sinh học được sử dụng để sản xuất các loại thuốc bảo vệ thực vật, thuốc tăng trưởng thực vật,… Lời giải chi tiết: Lời giải chi tiết: Dẫn xuất halogen không tan trong nước nhưng tan trong các dung môi hữu cơ như alcohol, ether, benzene. Phát biểu B không đúng. → Chọn B. 15.9 Sản phẩm chính của phản ứng nào sau đây không đúng? A. CH3CH(Cl)CH3 + NaOH → CH3CH(OH)CH3 + NaCl B. CH3CH2Cl + KOH → CH2=CH2 + KCl + H2O C. CH3Br+ KOH → CH3OH + KBr D. CH3CH2CH(Br)CH3 + KOH(ethanol) → CH3CH=CHCH3 + KBr + H2O Phương pháp giải: - Dẫn xuất halogen mà nguyên tử halogen liên kết với nguyên tử carbon no có phản ứng thế nhóm –OH trong dung dịch kiềm, đun nóng. - Trong phản ứng tách hydrogen halide, cho biết nguyên tử hydrogen ở nguyên tử carbon nào được tách cùng với nguyên tử halogen ra khỏi dẫn xuất (điều kiện phản ứng: ethanol) Lời giải chi tiết: Phản ứng B không chính xác. Đây là phản ứng thế nhóm –OH, không phải là phản ứng tách nước do đó sản phẩm chính của phản ứng này là CH3-CH2-OH. → Chọn B. 15.10 Trong thể thao, khi các vận động viên bị chấn thương do va chạm, không gây ra vết thương hở, gãy xương, thường được nhân viên y tế dùng...loại thuốc xịt, xịt vào chỗ bị thương để gây tê cục bộ và vận động viên có thể quay trở lại thi đấu. Hợp chất chính có trong thuốc xịt là A. carbon dioxide. B. hydrogen chloride. C. chloromethane. D. chloroethane. Phương pháp giải: Chloroethane được dùng trong thuốc gây tê. Lời giải chi tiết: Hợp chất chính có trong thuốc xịt gây tê cục bộ là chloroethane. → Chọn D. 15.11 a) Các nhà hoá học đã tìm ra một số dẫn xuất halogen không chứa chlorine như: CF3CH2F, CF3CH2CF2CH3 .... đang được sử dụng trong công nghiệp nhiệt lạnh, vì sự phân huỷ các hợp chất này nhanh chóng sau khi phát tán vào không khí nên ảnh hưởng rất ít đến tầng ozone hay sự ấm lên toàn cầu thấp. Gọi tên theo danh pháp thay thế 2 hợp chất đó. b) Vẽ công thức cấu tạo của hợp chất có tên: 4-chloro-3,4-dimethylpent-2-ene. c) Viết đồng phân và gọi tên các dẫn xuất halogen bậc I của hợp chất có công thức C4H9Br. Phương pháp giải: Tên thay thế của dẫn xuất halogen:
Lời giải chi tiết: a) b) c) Các dẫn xuất halogen bậc I của hợp chất có công thức C4H9Br:
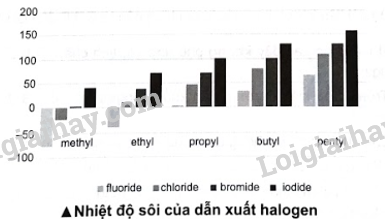
15.12 So sánh nhiệt độ sôi của methane và các dẫn xuất halogen của methane: CH4, CH3Cl, CH2Cl2, CHCl3 và CCl4. Giải thích. Phương pháp giải: Nhiệt độ sôi của các dẫn xuất halogen có xu hướng tăng dần theo chiều tăng khối lượng phân tử vì tương tác van der Waals tăng dần theo chiều tăng khối lượng phân tử. Lời giải chi tiết: Tương tác van der Waals ảnh hưởng đến nhiệt độ sôi của các dẫn xuất halogen, từ trái sang, số lượng nguyên tử chlorine tăng làm cho tương tác van der Waals tăng. Thứ tự nhiệt độ sôi tăng dần theo chiều CH4 < CH3Cl < CH2Cl2 < CHCl3 < CCl4. 15.13 Biểu đồ dưới đây biểu diễn nhiệt độ sôi (°C) của một số loại dẫn xuất halogen. Quan sát và trả lời các câu hỏi:
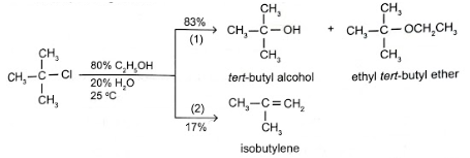
a) Trong điều kiện chuẩn (25 °C, 1 bar), liệt kê tên hoặc công thức một số dẫn xuất halogen ở thể khí. b) Nhận xét nhiệt độ sôi các dẫn xuất halogen của hydrocarbon. Giải thích nguyên nhân dẫn đến xu hướng biến đổi nhiệt độ sôi các dẫn xuất. Phương pháp giải: a) Các chất có nhiệt độ sôi thấp hơn 25 °C ở thể khí trong điều kiện chuẩn. Để xác định các chất ở thể khí, ta làm như sau: xác định điểm ở giữa nhiệt độ 0 °C và 50 °C, dùng bút chì vẽ đường thẳng song song với đường nằm ngang, biểu diễn đường nhiệt độ 25 °C. b) Tương tác van der Waals tăng, nhiệt độ sôi của các dẫn xuất halogen tăng. Lời giải chi tiết: a) Trong điều kiện thường (25 °C, 1 bar), một số dẫn xuất halogen ở thể khí fluoromethane (CH3F), chloromethane (CH3Cl), bromomethane (CH3Br), fluoroethane (CH3CH2F), chloroethane (CH3CH2Cl) và fluoropropane (CH3CH2CH2F). b) * Nhận xét về nhiệt độ sôi các dẫn xuất halogen của hydrocarbon: - Với các dẫn xuất cùng loại halogen, nhiệt độ sôi tăng dần từ gốc methyl đến pentyl. - Với các dẫn xuất halogen cùng gốc alkyl, nhiệt độ sôi tăng từ dẫn xuất fluorine đến dẫn xuất iodine. * Giải thích: Trong dẫn xuất halogen, tương tác van der Waals càng lớn thì nhiệt độ sôi càng cao: - Cùng gốc alkyl, tương tác van der Waals tăng từ dẫn xuất fluoride đến iodide nên nhiệt độ sôi tăng. - Cùng dẫn xuất halogen, khối lượng gốc alkyl tăng từ methyl đến pentyl làm cho tương tác van der Waals tăng nên nhiệt độ sôi tăng. 15.14 Tiến hành thí nghiệm nghiên cứu khả năng phản ứng của dẫn xuất tert-butyl chloride với dung dịch ethanol 80% ở 25 °C. Kết quả thí nghiệm thể hiện trong sơ đồ:
Xác định loại phản ứng (1) và (2). Cho biết phản ứng nào chiếm ưu thế trong thí nghiệm trên. Phương pháp giải: - Dẫn xuất halogen mà nguyên tử halogen liên kết với nguyên tử carbon no có phản ứng thế nhóm –OH trong dung dịch kiềm, đun nóng. - Trong phản ứng tách hydrogen halide, cho biết nguyên tử hydrogen ở nguyên tử carbon nào được tách cùng với nguyên tử halogen ra khỏi dẫn xuất (điều kiện phản ứng: ethanol) Lời giải chi tiết: Phản ứng (1) thuộc loại phản ứng thế, phản ứng (2) thuộc loại phản ứng tách. Dựa vào kết quả thí nghiệm: 83% sản phẩm của phản ứng thế và 17% sản phẩm của phản ứng tách, nên phản ứng thế chiếm ưu thế hơn. 15.15 Tính chất hoá học chung của dẫn xuất halogen thể hiện qua 2 loại phản ứng thế halogen bởi nhóm hydroxy và phản ứng tách hydrogen halide. Trong đó, độ dài liên kết và năng lượng liên kết ảnh hưởng trực tiếp đến khả năng phản ứng của 2 loại phản ứng này. Quan sát biểu đồ bên dưới và trả lời câu hỏi.
a) Nhận xét sự tương quan giữa độ dài liên kết và năng lượng liên kết C−X trong dẫn xuất halogen của hydrocarbon. b) Độ dài liên kết và năng lượng liên kết ảnh hưởng như thế nào đến khả năng phản ứng của dẫn xuất halogen. Lấy ví dụ cụ thể cho 2 hợp chất iodoethane và bromoethane. Phương pháp giải: a) Năng lượng liên kết càng lớn thì độ dài liên kết càng nhỏ. b) Độ dài liên kết càng nhỏ thì khả năng phản ứng càng yếu, nguyên nhân là do liên kết bền, cần năng lượng lớn để phá vỡ liên kết cũ để hình thành liên kết mới. Lời giải chi tiết: a) Trong dẫn xuất halogen, các liên kết C−X có năng lượng liên kết càng lớn thì độ dài liên kết càng nhỏ. b) Dẫn xuất halogen có năng lượng liên kết C−X càng lớn, độ dài liên kết C−X càng nhỏ thì khả năng phản ứng càng yếu, nguyên nhân là do liên kết bền, cần năng lượng lớn để phá vỡ liên kết cũ để hình thành liên kết mới. Ví dụ: Đối với 2 hợp chất CH3CH2Br và CH3CH2I, năng lượng liên kết của liên kết C—Br lớn hơn của liên kết C−I nên khả năng phản ứng thế và phản ứng tách của hợp chất CH3CH2I dễ dàng hơn CH3CH2Br. 15.16 Cho phương trình hoá học của phản ứng tổng quát: R-X + NaOH → R-OH + NaX Tốc độ phản ứng thế của dẫn xuất halogenoalkane với dung dịch kiềm của một số hợp chất cho giá trị tương đối thể hiện trong bảng sau:
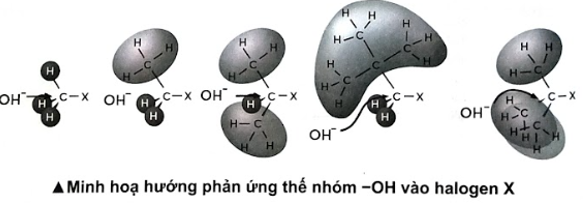
a) So sánh khả năng phản ứng thế bởi nhóm –OH của các halogenoalkane theo thứ tự từ 1 đến 5. b) Quan sát hình bên dưới, cho biết yếu tố nào ảnh hưởng đến khả năng phản ứng thế nhóm –OH của các halogenoalkane trên? Phương pháp giải: a) Tốc độ phản ứng càng lớn, khả năng phản ứng càng lớn. b) Yếu tố không gian ảnh hưởng lớn đến khả năng phản ứng thế nhóm –OH của các halogenoalkane. Lời giải chi tiết: a) Tốc độ phản ứng thế của dẫn xuất halogenoalkane với dung dịch kiềm theo thứ tự từ thí nghiệm 1 đến 5 cho các giá trị giảm dần, nên khả năng phản ứng của các chất giảm. b) Các gốc methyl, ethyl, isopropyl, neopentyl và tert-butyl tăng dần mức độ cồng kềnh của gốc hydrocarbon, làm tăng sự che chắn nhóm –OH thế vào vị trí halogen.
|

























Danh sách bình luận