Bài 14. Ôn tập chương 3 trang 36, 37 SBT Hóa 10 Kết nối tri thức với cuộc sốngQuy tắc octet không đúng với trường hợp phân tử chất nào sau đây? Phát biểu nào sau đây không đúng về liên kết có trong phân tử HCl? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
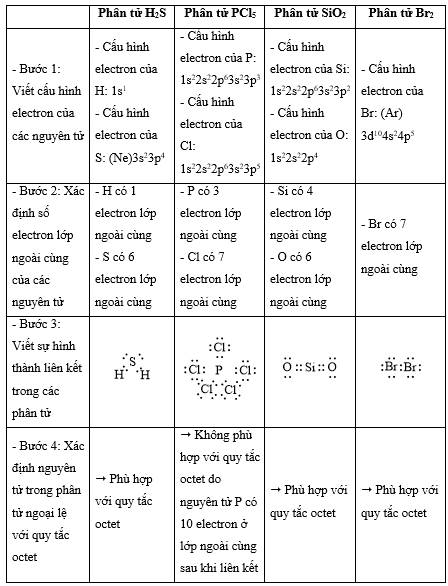
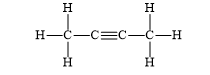
Nhận biết 14.1 Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây? A. H2S. B. PCl5. C. SiO2. D. Br2. Phương pháp giải: Dựa vào - Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium) - Các bước thực hiện: + Bước 1: Viết cấu hình electron của các nguyên tử + Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử + Bước 3: Viết sự hình thành liên kết trong các phân tử + Bước 4: Xác định nguyên tử trong phân tử ngoại lệ với quy tắc octet Lời giải chi tiết: Nhận biết 14.2 Phát biểu nào sau đây không đúng về liên kết có trong phân tử HCl? A. Giữa nguyên tử H và Cl có một liên kết đơn. B. Các electron tham gia liên kết đồng thời bị hút về phía hai hạt nhân. C. Phân tử có một moment lưỡng cực. D. Một electron của nguyên tử hydrogen và một electron của nguyên tử chlorine được góp chung và cách đều hai nguyên tử. Lời giải chi tiết: - Đáp án: D - Giải thích: Độ âm điện của chlorine cao hơn hydrogen " cặp electron dùng chung sẽ lệch về phía nguyên tử chlorine Nhận biết 14.3 : Liên kết ion khác với liên kết cộng hoá trị ở điểm nào sau đây? A. Tính bão hoà lớp electron ở vỏ nguyên tử. B. Tuân theo quy tắc octet. C. Tạo ra hợp chất bền vững hơn. D. Tính không định hướng. Phương pháp giải: Dựa vào sự khác nhau giữa hai loại liên kết Lời giải chi tiết: - Đáp án: D - Giải thích: Trong dung dịch, ion dương/ion âm có thể liên kết với 1 trong các ion âm/ion dương xung quanh Nhận biết 14.4 Cho chất hữu cơ A có công thức cấu tạo sau: Số liên kết σ trong phần tử A là A. 6. B. 8. C. 9. D. 11. Phương pháp giải: Dựa vào: - Các liên kết cộng hóa trị đơn đều là liên kết σ - 1 liên kết đôi gồm 1 liên kết σ và 1 liên kết π - 1 liên kết ba gồm 1 liên kết σ và 2 liên kết π Lời giải chi tiết: - Đáp án: C Nhận biết 14.5 Cho giá trị độ âm điện của một số nguyên tố sau: Na (0,93); Li (0,98), Mg (1,31); Al (1,61); P (2,19); S (2,58); Br (2,96) và C1 (3,16). Phân tử nào sau đây có liên kết ion A. Na3P. B. MgS. C. AlCl3. D. LiBr. Phương pháp giải: Dựa vào hiệu độ âm điện:
Lời giải chi tiết:
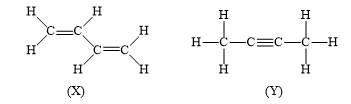
=> Đáp án: D Nhận biết 14.6 Cho hai chất hữu cơ X và Y có công thức cấu tạo sau: Nhận xét nào sau đây là đúng? A. X và Y có số liên kết σ và số liên kết π bằng nhau. B. X có số liên kết σ và số liên kết π nhiều hơn Y. C. X có số liên kết σ nhiều hơn, nhưng số liên kết π ít hơn Y. D. X có số liên kết σ ít hơn, nhưng số liên kết π nhiều hơn Y. Phương pháp giải: Dựa vào: - Các liên kết cộng hóa trị đơn đều là liên kết σ - 1 liên kết đôi gồm 1 liên kết σ và 1 liên kết π - 1 liên kết ba gồm 1 liên kết σ và 2 liên kết π Lời giải chi tiết: - Đáp án: A Nhận biết 14.7 Nguyên tố X ở nhóm IA và nguyên tố Y ở nhóm VIIA của bảng tuần hoàn X và Y có thể tạo thành hợp chất R. Liên kết giữa các nguyên tử trong R thuộc loại liên kết nào sau đây? A. Ion. B. Cộng hoá trị phân cực. C. Cộng hoá trị không phân cực. D. Hydrogen. Phương pháp giải: Dựa vào: - Liên kết cộng hóa trị được hình thành giữa các nguyên tử giống hoặc gần giống nhau về bản chất hóa học - Liên kết ion được hình thành giữa các nguyên tử kim loại điển hình và các nguyên tử phi kim điển hình Lời giải chi tiết: - Đáp án: A - Giải thích: nguyên tố nhóm IA là kim loại điển hình, nguyên tố nhóm VIIA là phi kim điển hình Thông hiểu 14.8 X, Y, Z là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 19, 16. Các cặp nguyên tố có thể tạo thành liên kết ion và cộng hóa trị phân cực lần lượt là A. (X, Y); (X, Z) và (Y, Z). B. (X, Z); (Y, Z) và (X, Y). C. (X, Y); (Y, Z) và (X, Z). D. (Z, Y); (Y, X) và (X, Z). Phương pháp giải: Dựa vào: - Liên kết cộng hóa trị được hình thành giữa các nguyên tử giống hoặc gần giống nhau về bản chất hóa học - Liên kết ion được hình thành giữa các nguyên tử kim loại điển hình và các nguyên tử phi kim điển hình Lời giải chi tiết: - Cấu hình electron của nguyên tử X là: 1s22s22p4 => X thuộc nhóm VIA, chu kì 2 " X là oxygen (O) - Cấu hình electron của nguyên tử Y là: 1s22s22p63s23p64s1 => Y thuộc nhóm IA, chu kì 4 " Y là potassium (K) - Cấu hình electron của nguyên tử Z là: 1s22s22p63s23p4 => Z thuộc nhóm VIA, chu kì 3 " Z là sulfur (S) => Cặp nguyên tố tạo liên kết ion là X, Y và Y, Z => Cặp nguyên tố tạo liên kết cộng hóa trị là X, Z => Đáp án: C Thông hiểu 14.9 Cho các chất sau: N2, H2, NH3, NaCl, HCl, H2O. Số chất mà phân tử chỉ chứa liên kết cộng hoá trị không phân cực là A. 2. B. 4. C. 5. D. 3. Phương pháp giải: Dựa vào hiệu độ âm điện:
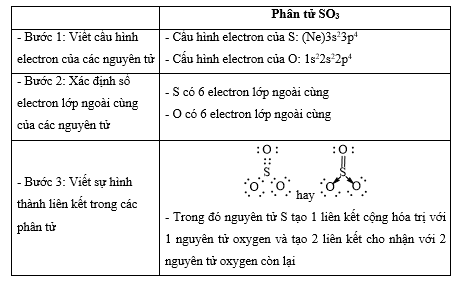
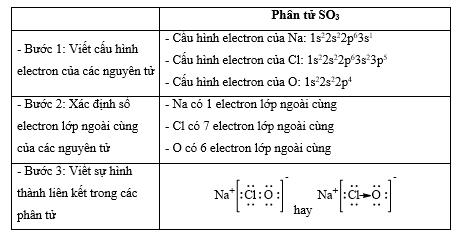
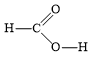
- Các phân tử được cấu tạo từ cùng 1 nguyên tố " chỉ chứa liên kết cộng hóa trị không phân cực Lời giải chi tiết: - Đáp án: A (N2 và H2) Thông hiểu 14.10 Cho các chất sau: (1) H2S; (2) SO2; (3) NaCl; (4) CaO; (5) NH3; (6) HBг; (7) CO2; (8) K2S. Dãy nào sau đây gồm các chất có liên kết cộng hoá trị? A. (1); (2); (3); (4); (7). B. (1); (2); (5); (6); (7). C. (1); (3); (5); (6); (7). D. (1); (2); (5); (7); (8). Phương pháp giải: Dựa vào - Liên kết cộng hóa trị được hình thành giữa các nguyên tử giống hoặc gần giống nhau về bản chất hóa học - Liên kết ion được hình thành giữa các nguyên tử kim loại điển hình và các nguyên tử phi kim điển hình Lời giải chi tiết: - Đáp án: B - Giải thích: các chất (1); (2); (5); (6); (7) chỉ gồm các phi kim " chỉ chứa liên kết cộng hóa trị Thông hiểu 14.11 Dùng công thức Lewis để biểu diễn phân tử SO3 sao cho phù hợp với quy tắc octet. Chỉ rõ các liên kết trong phân tử thuộc loại liên kết nào. Phương pháp giải: Dựa vào - Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium) - Các bước thực hiện: + Bước 1: Viết cấu hình electron của các nguyên tử + Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử + Bước 3: Viết sự hình thành liên kết trong các phân tử Lời giải chi tiết: Thông hiểu 12.12 Hợp chất NaClO là thành phần của chất tẩy rửa, sát trùng có tên gọi là “Nước Javen”. Áp dụng quy tắc octet để giải thích sự hình thành các liên kết trong hợp chất đó. Phương pháp giải: Dựa vào - Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium) - Các bước thực hiện: + Bước 1: Viết cấu hình electron của các nguyên tử + Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử + Bước 3: Viết sự hình thành liên kết trong các phân tử Lời giải chi tiết: Thông hiểu 14.13 Tính số liên kết σ và liên kết π trong các phân tử sau: a) C2H4; b) C2H2; c) HCN; d) HCOOH. Phương pháp giải: Dựa vào công thức cấu tạo của các phân tử và - Các liên kết cộng hóa trị đơn đều là liên kết σ - 1 liên kết đôi gồm 1 liên kết σ và 1 liên kết π - 1 liên kết ba gồm 1 liên kết σ và 2 liên kết π Lời giải chi tiết: a) Công thức cấu tạo của C2H4 là: Phân tử C2H4 có: 5 liên kết σ và 1 liên kết π b) Công thức cấu tạo của C2H2 là: Phân tử C2H2 có: 3 liên kết σ và 2 liên kết π c) Công thức cấu tạo của HCN là: Phân tử HCN có: 2 liên kết σ và 2 liên kết π d) Công thức cấu tạo của HCOOH là: Phân tử HCOOH có: 4 liên kết σ và 1 liên kết π
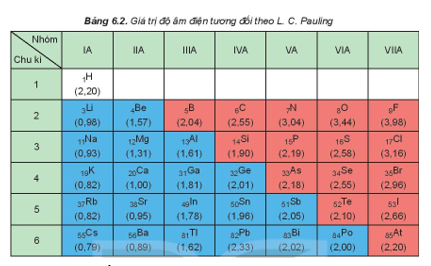
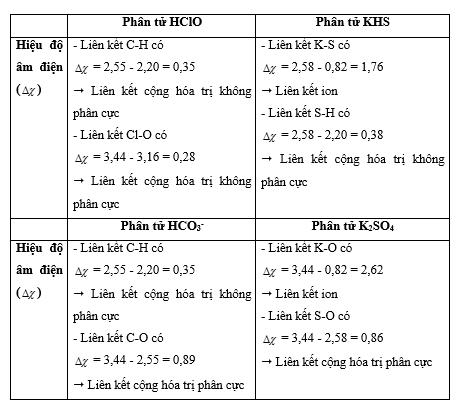
Vận dụng 14.14 Dựa vào giá trị của độ âm điện ở Bảng 6.2 trong sách giáo khoa Hóa học 10, hãy nêu bản chất liên kết trong các phân tử và ion sau: HClO, KHS, HCO3-, K2SO4. Phương pháp giải: Dựa vào hiệu độ âm điện:
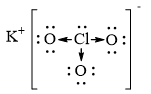
Lời giải chi tiết: Vận dụng 14.15 Cho dãy các chất kèm theo nhiệt độ sôi (°C) sau: HF (19,5); HCl (-85), HBr (-66); HI (-35). a) Nêu xu hướng biến đổi nhiệt độ sôi trong dãy chất trên. b) Đề xuất lí do nhiệt độ sôi của HF không theo xu hướng này. Phương pháp giải: Dựa vào ảnh hưởng của liên kết hydrogen và tương tác van der Waals đến nhiệt độ sôi và nhiệt độ nóng chảy của các chất - Các chất có liên kết hydrogen đều có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn các chất không có liên kết hydrogen - Đặc điểm của tương tác van der Waals: + Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất + Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng Lời giải chi tiết: a) Xu hướng biến đổi nhiệt độ sôi: HF có nhiệt độ sôi cao bất thường, sau đó nhiệt độ sôi tăng dần từ HCl đến HI b) Giải thích: HF có liên kết hydrogen => nhiệt độ sôi cao nhất Vận dụng 14.16 Cho biết tổng số electron trong anion AB32- là 42. Trong các hạt nhân A cũng như B có số proton bằng số neutron. a) Tính số khối của A, B. b) Đề xuất cấu tạo Lewis cho anion AB32- sao cho phù hợp với quy tắc octet. Phương pháp giải: - Xác định số electron của mỗi nguyên tử A và B - Các bước thực hiện viết cấu tạo Lewis: + Bước 1: Viết cấu hình electron của các nguyên tử + Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử + Bước 3: Viết sự hình thành liên kết trong các phân tử Lời giải chi tiết: a) - Gọi số hạt proton, electron và neutron trong nguyên tử A lần lượt là p1, e1, n1 - Có số hạt proton, electron và neutron trong B lần lượt là p2, e2, n2 - Có tổng số electron trong anion AB32- là 42 => p1 + 3p2 + 2 = 42 => \(3{p_2} = 40 - {p_1}\) " \({p_2} < \frac{{40}}{3} = 13,333\) - Do trong các hạt nhân A cũng như B có số proton bằng số neutron => p2 = 8 => p1 = 16 => A là nguyên tố sulfur (S) và B là nguyên tố oxygen (O) - Số khối của S = 16 + 16 = 32 - Số khối của O = 8 + 8 = 16 b) Vận dụng 14.17 Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp nhãn ra hoa,... X có khối lượng mol bằng 122,5 g/mol, chứa ba nguyên tố, trong đó nguyên tố s có 7 electron s, nguyên tố p có 11 electron p và nguyên tố p có 4 electron p. Thành phần phần trăm khối lượng nguyên tố có 4 electron p trong X bằng 39,19%. a) Xác định công thức phân tử của X. b) Viết công thức cấu tạo Lewis, chỉ rõ loại liên kết có trong X. Phương pháp giải: - Nguyên tố s có 7 electron s => cấu hình electron là: 1s22s22p63s23p64s1 -> Đây là nguyên tố potassium (K) - Nguyên tố p có 11 electron p -> cấu hình electron là: 1s22s22p63s23p5 -> Đây là nguyên tố chlorine (Cl) - Nguyên tố p có 4 electron p -> cấu hình electron là: 1s22s22p4 -> Đây là nguyên tố oxygen (O) => Công thức tổng quát của X có dạng KxClyOz - Có => z = 3 - Có x.39 + y.35,5 + 3.16 = 122,5 -> x = y = 1 => Công thức phân tử của X là KClO3 Lời giải chi tiết: - Nguyên tố s có 7 electron s => cấu hình electron là: 1s22s22p63s23p64s1 -> Đây là nguyên tố potassium (K) - Nguyên tố p có 11 electron p -> cấu hình electron là: 1s22s22p63s23p5 -> Đây là nguyên tố chlorine (Cl) - Nguyên tố p có 4 electron p -> cấu hình electron là: 1s22s22p4 -> Đây là nguyên tố oxygen (O) => Công thức tổng quát của X có dạng KxClyOz - Có => z = 3 - Có x.39 + y.35,5 + 3.16 = 122,5 -> x = y = 1 => Công thức phân tử của X là KClO3
b)- Công thức Lewis của KClO3 là: -> Trong đó ion K+ liên kết với ion ClO3- bằng liên kết ion, các liên kết giữa Cl - O là liên kết cộng hóa trị
|

















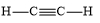

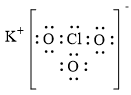






Danh sách bình luận