Phương pháp giải một số bài toán về hạt nhân nguyên tử, đồng vịPhương pháp giải một số bài toán ngắn gọn, dễ hiểu. Quảng cáo
Dạng 1: Xác định A, Z trong nguyên tử và kí hiệu nguyên tử nguyên tố hóa học Lý thuyết cần nhớ: - Nguyên tử trung hoà về điện nên số proton trong hạt nhân bằng số electron của nguyên Số đơn vị điện tích hạt nhân Z = số proton = số electron - Số khối (kí hiệu là A) là tổng số hạt proton (kí hiệu là Z) và tổng số hạt nơtron (kí hiệu là N) của hạt nhân đó : A = Z + N - Kí hiệu nguyên tử: \({}_Z^AX\) X: Nguyên tố hóa học A: Số khối của nguyên tố X Z: Số đơn vị điện tích hạt nhân của nguyên tố X Một số ví dụ điển hình Ví dụ 1: Tổng số các hạt cơ bản (p, n, e) của một nguyên tử X là 28. Số hạt mang điện nhiều hơn số hạt không mang điện là 8. Xác định ký hiệu và tên nguyên tử X. Hướng dẫn giải: Tổng số các hạt cơ bản (p, n, e) của một nguyên tử X là 28 => n + p + e = 28 => 2p + n = 28 (1) Số hạt mang điện nhiều hơn số hạt không mang điện là 8 => p + e – n = 8 => 2p – n = 8 (2) Từ (1) và (2) => p = 9, n = 10 p = 9 => X là F => AF = p + n = 9 + 10 = 19 Ký hiệu nguyên tử của F là: \({}_9^{19}F\) Ví dụ 2: Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện. Xác định tên của R và các định số khối của R Hướng dẫn giải: Trong R, tổng số hạt mang điện và không mang điện là 34 => p + n + e = 34 => 2p + n = 34 (1) Mặt khác, số hạt mang điện gấp 1,833 lần số hạt không mang điện => p + e = 1,833n => 2p = 1,833n (2) Từ (1) và (2) => p = 11, n =12 Z = 11 => R là Al AR = 11 + 12 = 23 Ví dụ 3: Hợp chất có công thức phân tử là M2X với: Tổng số hạt cơ bản trong một phân tử là 116, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36. Khối lượng nguyên tử của X lớn hơn M là 9. Tổng số hạt trong X2- nhiều hơn trong M+ là 17. Xác định số khối của M, X. Hướng dẫn giải: Trong phân tử chất trên có 2 nguyên tử M và 1 nguyên tử X. Gọi số hạt cơ bản có trong nguyên tử M là: pM, eM, nM. Số hạt cơ bản có trong nguyên tử X là: pX, eX, nX. Theo đề bài, tổng số hạt cơ bản trong một phân tử là 116 => 2 * (pM + eM + nM.) + pX + eX + nX = 116 => 4pM + 2nM + 2pX + nX = 116 (I) Số hạt mang điện nhiều hơn số hạt không mang điện là 36 => 4pM + 2pX – (2nM + nX) = 36 (II) Khối lượng nguyên tử của X lớn hơn của M là 9 => pX + nX – (pM + nM) = 9 (III) Tổng số hạt trong X2- nhiều hơn trong M+ là 17. => 2pX + nX + 2 – (2pM + nM – 1) = 17 (IV) Từ (I), (II) ,(III), (IV) => pX =16, nX=16, pM =11, nM =12 => AM = pM + nM = 11 + 12 = 23. => AX = pX + nX = 16 + 16 = 32. Dạng 2: Bài toán về đồng vị Lý thuyết cần nhớ: Các đồng vị của cùng một nguyên tố hoá học là những nguyên tử có cùng số proton nhưng khác nhau vể số nơtron. - Nguyên tử khối trung bình = \(\mathop M\limits^ - = \dfrac{{aX + bY}}{{100}}\) với a, b là % số nguyên tử của hai đồng vị X, Y. Một số ví dụ điển hình: Ví dụ 1: Cho hai đồng vị hiđro với tỉ lệ % số nguyên tử : \({}_{1}^{1}H\) (99,984%), \({}_{1}^{2}H\) (0,016%) và hai đồng vị của clo : \({}_{17}^{35}Cl\)(75,53%), \({}_{17}^{37}Cl\) (24,47%). a. Tính nguyên tử khối trung bình của mỗi nguyên tố. b. Có thể có bao nhiêu loại phân tử HCl khác nhau được tạo nên từ hai loại đồng vị của hai nguyên tố đó. Hướng dẫn giải a. Nguyên tử khối trung bình của hiđro và clo là : \(\begin{array}{l}{\overline M _H} = {\overline A _H} = 1.\frac{{99,984}}{{100}} + 2.\frac{{0,016}}{{100}} = 1,00016;\\{\overline M _{Cl}} = {\overline A _{Cl}} = 35.\frac{{75,53}}{{100}} + 37.\frac{{24,47}}{{100}} = 35,4894.\end{array}\) b. Trong phân tử HCl, có 1 nguyên tử H và 1 nguyên tử Cl. Nguyên tố H và Cl đều có 2 đồng vị. Nên để chọn nguyên tử H thì có 2 cách chọn, tương tự ta thấy có 2 cách chọn nguyên tử Cl. Do đó có 2.2 = 4 loại phân tử HCl khác nhau. Ví dụ 2: Biết rằng nguyên tố agon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng : 0,34% ; 0,06% và 99,6%. Tính số khối của đồng vị A của nguyên tố agon, biết rằng nguyên tử khối trung bình của agon bằng 39,98. Hướng dẫn giải Áp dụng cách tính nguyên tử khối trung bình ta có: 36 * 0,34% + 38 * 0,06% + A * 99,6% = 39,98 => A = 40 Ví dụ 3 : Nguyên tử khối trung bình của đồng bằng 63,54. Đồng tồn tại trong tự nhiên dưới hai dạng đồng vị \({}_{29}^{63}Cu\) và \({}_{29}^{65}Cu\)Tính thành phần phần trăm về số nguyên tử của mỗi loại đồng vị. Hướng dẫn giải Sử dụng công thức tính nguyên tử khối trung bình = \(\mathop M\limits^ - = \dfrac{{aX + bY}}{{100}}\) Gọi phần trăm số nguyên tử của đồng vị \({}_{29}^{63}Cu\) là x, phần trăm đồng vị \({}_{29}^{65}Cu\) là (100 – x). Ta có \(\frac{63x+(100-x)65}{100}\) = 63,54 => x = 73 Vậy % số nguyên tử của đồng vị \({}_{29}^{63}Cu\)và \({}_{29}^{65}Cu\) lần lượt là 73% và 27%. Ví dụ 4 : Trong tự nhiên kali có hai đồng vị \(_{19}^{39}K\) và \({}_{19}^{41}K.\) Tính thành phần phần trăm về khối lượng của có trong KClO4. Biết nguyên tử khối trung bình của K là 39,13; O là 16 và Cl là 35,5. Hướng dẫn giải Gọi phần trăm về số nguyên tử đồng vị (phần trăm về số mol) của \(_{19}^{39}K\) và \(_{19}^{41}K\) là x1 và x2 ta có : => Đồng vị \(_{19}^{39}K\) chiếm 93,5% tổng số nguyên tử K. Giả sử có 1 mol KClO4 thì tổng số mol các đồng vị của K là 1 mol, trong đó số mol \(_{19}^{39}K\) là 1.0,935 =0,935 mol. Vậy thành phần phần trăm về khối lượng của có trong KClO4 là : \(\% _{19}^{39}K = \frac{{0,935.39}}{{39,13 + 35,5 + 16.4}}.100 = 26,3\% \) Ví dụ 5: Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau : Đồng vị \({}^{24}Mg\) \({}^{25}Mg\) \({}^{26}Mg\) % 78,6 10,1 11,3 a. Tính nguyên tử khối trung bình của Mg. b. Giả sử trong hỗn hợp nói trên có 50 nguyên tử , thì số nguyên tử tương ứng của hai đồng vị còn lại là bao nhiêu ? Hướng dẫn giải : a. Tính nguyên tử khối trung bình của Mg : \({{\overline{M}}_{Mg}}=24.\frac{78,6}{100}+25.\frac{10,1}{100}+26.\frac{11,3}{100}=24,33.\) b. Tính số nguyên tử của các đồng vị \({}^{24}Mg\) và \({}^{26}Mg\): Ta có : Trong x nguyên tử Mg có chứa 50 nguyên tử \({}^{25}Mg\) => 50 nguyên tử Mg chiếm 10,1 % của x nguyên tử Mg => x = 50 : 10,1 * 100 = 495 (nguyên tử) Số nguyên tử \({}^{24}Mg\) = 495 * 78,1 : 100 = 389 (nguyên tử). Số nguyên tử \({}^{26}Mg\) = 495* 11,3 : 100 = 56 (nguyên tử). Loigiaihay.com
|














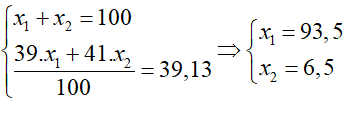






Danh sách bình luận