Lý thuyết hạt nhân nguyên tử, nguyên tố hoá học, đồng vịHạt nhân nguyên tử, nguyên tố hóa học và đồng vị Quảng cáo
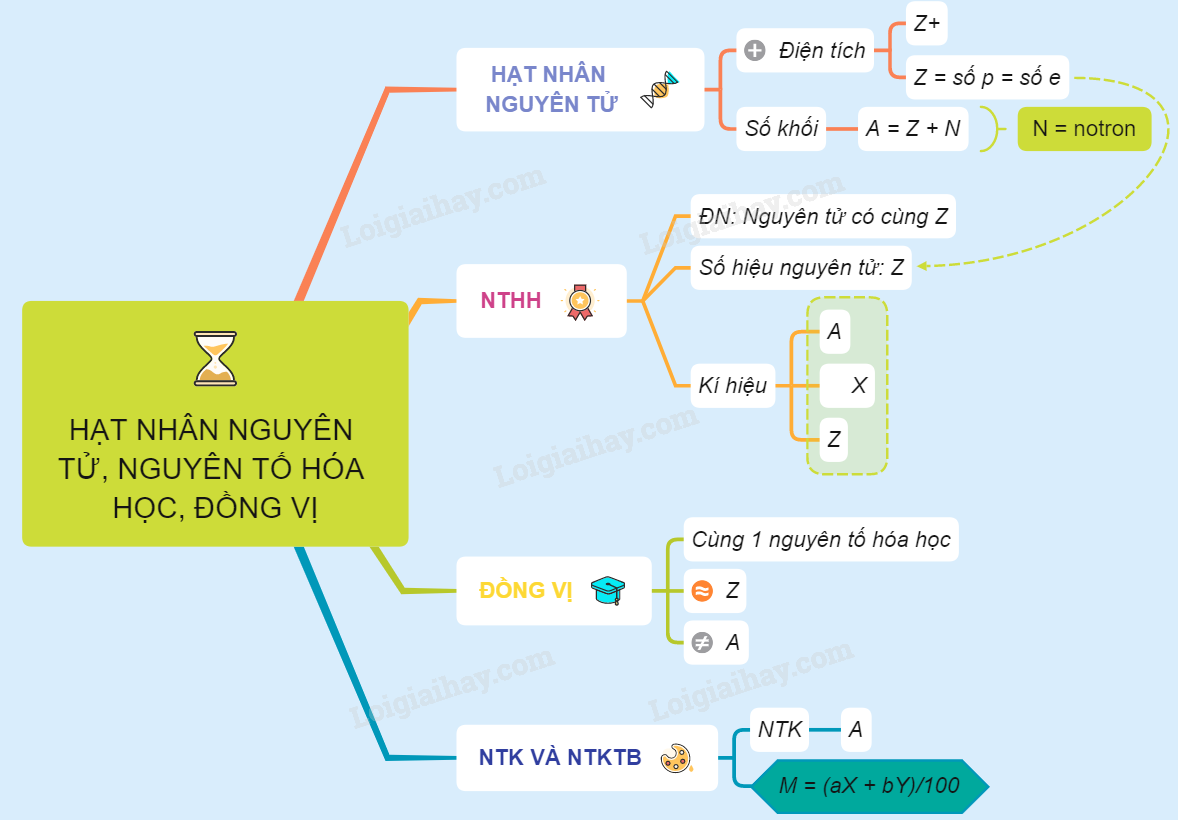
I. HẠT NHÂN NGUYÊN TỬ 1. Điện tích hạt nhân - Proton mang điện tích 1+ => Có Z proton thì điện tích của hạt nhân bằng Z+ và số đơn vị điện tích hạt nhân bằng Z. - Nguyên tử trung hoà về điện nên số proton trong hạt nhân bằng số electron của nguyên tử Số đơn vị điện tích hạt nhân Z = số proton = số electron Ví dụ: Nguyên tử Na có: Z =11 => Nguyên tử Na có 11 proton và 11 electron. 2. Số khối Số khối (kí hiệu là A) là tổng số hạt proton (kí hiệu là Z) và tổng số hạt nơtron (kí hiệu là N) của hạt nhân đó A = Z + N Ví dụ: Hạt nhân nguyên tử Nhôm có 13 proton và 14 notron. ⇒ Số khối A = 13 + 14 = 27 II. NGUYÊN TỐ HOÁ HỌC 1. Định nghĩa Nguyên tố hoá học là những nguyên tử có cùng điện tích hạt nhân. 2. Số hiệu nguyên tử - Là số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố. - Số hiệu nguyên tử cho biết: + Số proton trong hạt nhân nguyên tử + Số electron trong nguyên tử + Từ đó cũng xác định được số notron trong nguyên tử Z = số proton = số electron = E (Nguyên tử trung hòa về điện) N = A – Z (A là số khối, Z là số hiệu nguyên tử) 3. Kí hiệu nguyên tử Số đơn vị điện tích hạt nhân và số khối được coi là những đặc trưng cơ bản của nguyên tử. Kí hiệu nguyên tử: \({}_Z^AX\) X: Nguyên tố hóa học A: Số khối của nguyên tố X Z: Số đơn vị điện tích hạt nhân của nguyên tố X Video mô phỏng - Tạo dựng nguyên tử III. ĐỒNG VỊ - Các nguyên tử của cùng một nguyên tố hoá học có thể có số khối khác nhau vì hạt nhân của các nguyên tử đó có số proton như nhau nhưng có thể có số nơtron khác nhau. - Các đồng vị của cùng một nguyên tố hoá học là những nguyên tử có cùng số proton nhưng khác nhau vể số nơtron. => A của các đồng vị sẽ khác nhau. - Các đồng vị được xếp vào cùng 1 ô nguyên tố trong bảng tuần hoàn hóa học. * Ngoài khoảng 340 đồng vị tự nhiên, người ta còn tổng hợp thêm 2400 đồng vị nhân tạo dùng trong y học, nông nghiệp. Video mô phỏng - Đồng vị là gì? IV. NGUYÊN TỬ KHỐI VÀ NGUYÊN TỬ KHỐI TRUNG BÌNH CỦA CÁC NGUYÊN TỐ HOÁ HỌC 1. Nguyên tử khối - Nguyên tử khối là khối lượng tương đối của nguyên tử và cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử. - Khối lượng của một nguyên tử bằng tổng khối lượng của proton, nơtron và electron trong nguyên tử đó, nhưng do khối lượng của electron quá nhỏ bé so với hạt nhân nên khối lượng một nguyên tử coi như bằng hạt nhân nguyên tử => Nguyên tử khối coi như bằng số khối (A) 2. Nguyên tử khối trung bình - Nguyên tử khối trung bình = \(\mathop M\limits^ - = \dfrac{{aX + bY}}{{100}}\) với a, b là % số nguyên tử của hai đồng vị X, Y. Sơ đồ tư duy: Hạt nhân nguyên tử, nguyên tố hoá học, đồng vị
Loigiaihay.com
|