Lý thuyết Tính chất hóa học của kim loại - Hóa 12 Cánh diềuNhiều kim loại tác dụng được với các phi kim như oxygen, lưu huỳnh, halogen,… Quảng cáo
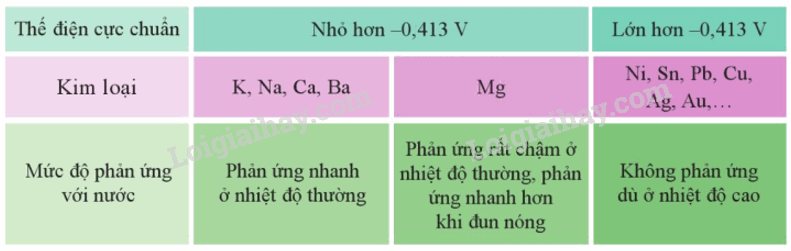
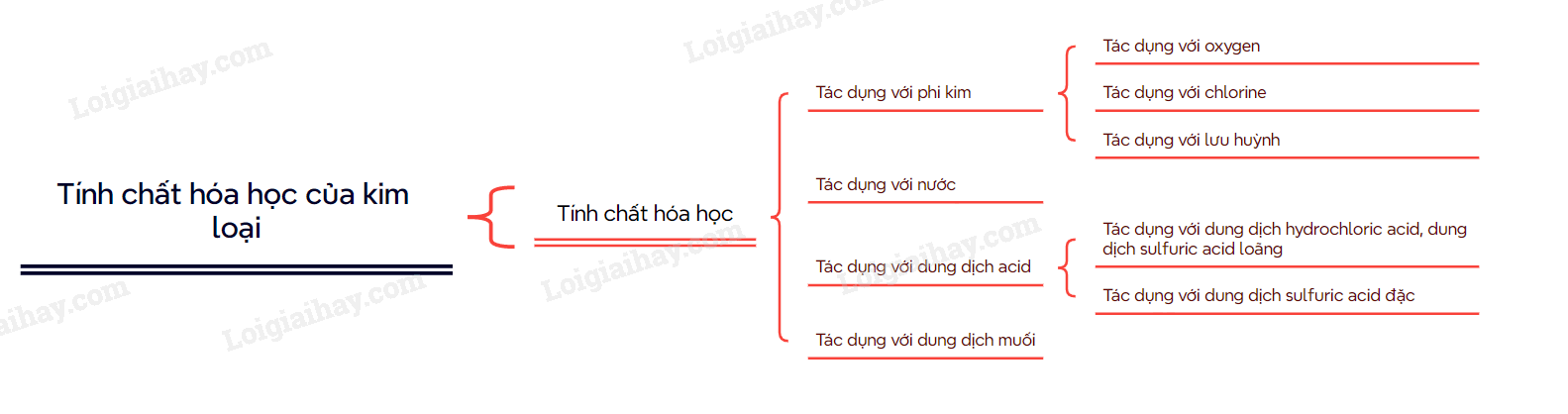
I. Tác dụng với phi kim Nhiều kim loại tác dụng được với các phi kim như oxygen, lưu huỳnh, halogen,… Ví dụ: \(4{\rm{A}}l(s) + 3{O_2}(g) \to 2{\rm{A}}{l_2}{O_3}(s)\) II. Tác dụng với nước Trong môi trường trung tính, có: 2H2O + 2e \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)H2 + OH- với E2H2O/2OH-+H2 = -0,413V Cặp oxi hóa – khử Mn+/M có giá trị thế điện cực chuẩn nhỏ hơn – 0,413V thì kim loại M có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen III. Tác dụng với dung dịch muối Kim loại không tan trong nước và có giá trị thế điện cực chuẩn nhỏ hơn thường tác dụng được với dung dịch muối của kim loại có giá trị thế điện cực lớn hơn ở điều kiện chuẩn. Ví dụ: Zn(s) + CuSO4(aq) \( \to \) ZnSO4(aq) + Cu(s) IV. Tác dụng với dung dịch acid 1. Tác dụng với dung dịch hydrochloric acid, dung dịch sulfuric acid loãng Do \(E_{2{H^ + }/{H_2}}^o = 0V\)nên kim loại M có giá trị thế điện cực chuẩn \(E_{{M^{n + }}/M}^o < 0V\)có theẻ khử được ion H+ trong dung dịch hydrchloric acid hoặc dung dihcj sulfuric acid loãng, tạo thành khí H2 Ví dụ: Zn(s) + 2H+(aq) \( \to \) Zn2+ (aq) + H2(g) Do giá trị thế điện cực chuẩn dương nên các kim loại như Cu, Ag,… không tác dụng với dung dịch hydrochloric acid hoặc dung dịch sulfuric acid loãng. 2. Tác dụng với dung dịch sulfuric acid đặc Hầu hết các kim loại (trừ Au và Pt) phản ứng được với dung dịch sulfuric acid đặc. Phản ứng này thường tạo thành muối sulfate, nước và sulfur dioxide. Phản ứng diễn ra mạnh hơn khi hỗn hợp phản ứng được đun nóng Ví dụ: SƠ ĐỒ TƯ DUY
|














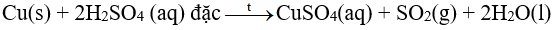






Danh sách bình luận