Lý thuyết Sự điện li trong dung dịch nước, thuyết Bronsted - Lowry về acid - base - Hóa học 11 - Cánh diều- Sự điện li là quá trình phân li các chất trong nước tạo thành ion. Quảng cáo
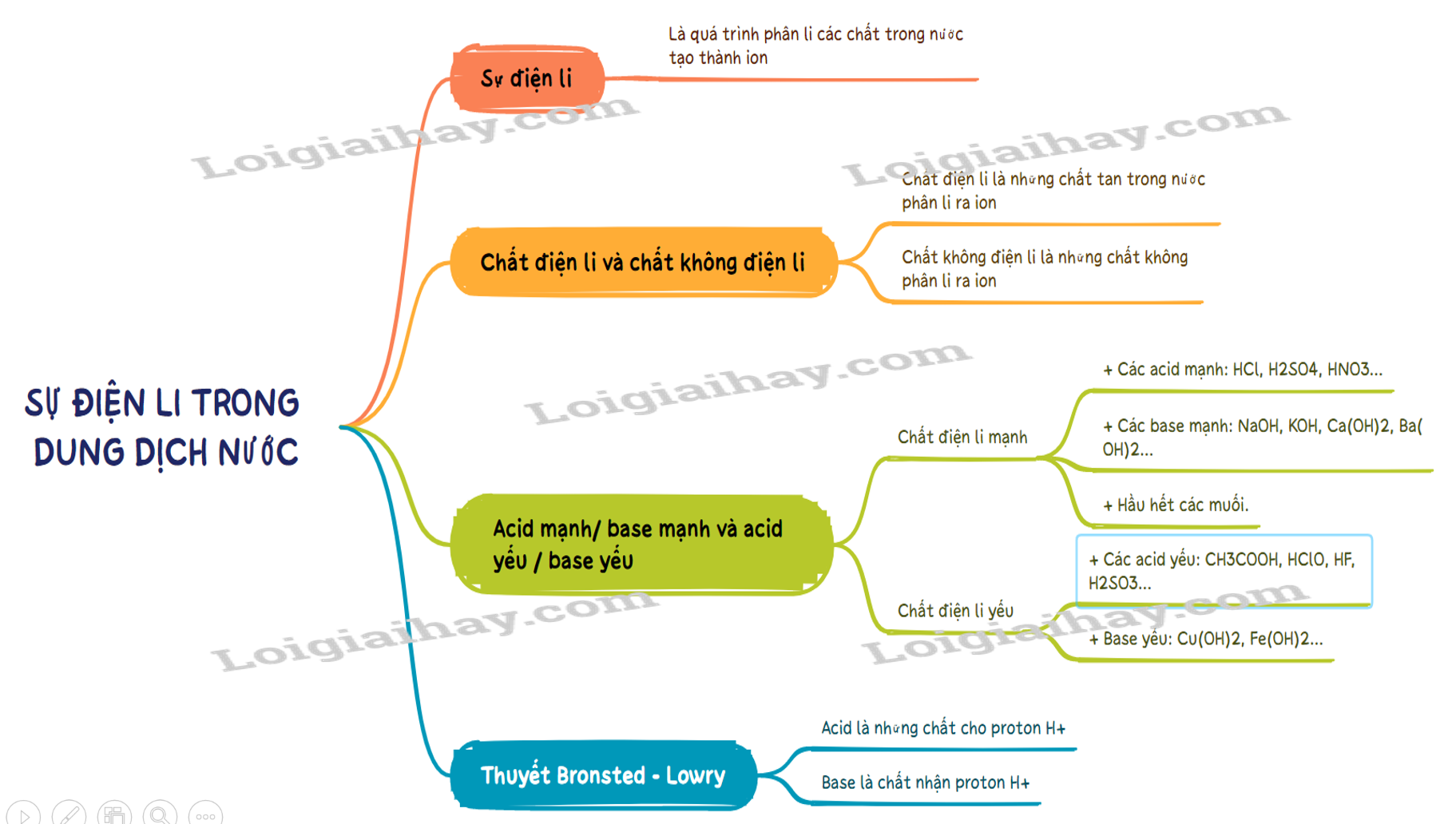
I. Sự điện li, chất điện li và chất không điện li 1. Sự điện li - Sự điện li là quá trình phân li các chất trong nước tạo thành ion. 2. Chất điện li và chất không điện li - Chất điện li là những chất khi tan trong nước phân li ra các ion - Chất điện li là những chất tan trong nước phân li ra các ion. VD: hydrochloric acid, sodium hydroxide, .. - Chất không điện li là chất không phân li ra các ion. VD: saccarose, ethanol…. II. Thuyết Bronsted – Lowry về acid – base 1. Thuyết Bronsted – Lowry về acid – base a. Khái niệm acid – base theo thuyết Bronsted – Lowry. - Acid là chất cho proton (H+). - Base là chất nhận proton (H+). b. Ưu điểm của thuyết Bronsted – Lowry. Tổng quát hơn thuyết Arhenius. (Phân tử không có nhóm –OH như NH3 hay CO3- cũng là base). 2. Acid mạnh / base mạnh và acid yếu / base yếu - Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Thường gặp là: + Các acid mạnh: HCl, H2SO4, HNO3… + Các base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2… + Hầu hết các muối. Phản ứng: Một chiều. VD: HNO3 → H+ + NO3-. - Chất điện li yếu là chất khi tan trong nước chỉ có một phần phân tử chất tan phân li ra ion. Thường gặp là: + Các acid yếu: CH3COOH, HClO, HF, H2SO3… + Base yếu: Cu(OH)2, Fe(OH)2… Phản ứng: Thuận nghịch. Biểu diễn: Hai nửa mũi tên ngược nhau (⇆) VD: CH3COOH ⇆ CH3COO- + H+. SƠ ĐỒ TƯ DUY
|




















Danh sách bình luận