Bài 1. Mở đầu về cân bằng hóa học trang 6, 7, 8, 9, 10, 11, 12, 13, 14 Hóa học 11 Cánh diềuKhí NO2 (màu nâu đỏ) liên tục chuyển hoá thành khí N2O4 (không màu) và ngược lại, tại một điều kiện xác định. Tại điều kiện này, khí NO2 cũng như khí N2O4 trong các bình riêng biệt (Hình 1.1), sau một thời gian đều chuyển thành hỗn hợp khí có thành phần như nhau và không đổi theo thời gian. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 6 Video hướng dẫn giải
Phương pháp: Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng. Lời giải chi tiết: Phản ứng: 2NO2(g) ⇌ N2O4(g) (nâu đỏ) (không màu) Tại thời điểm hỗn hợp khí trong hai bình có thành phần như nhau, có hai phản ứng diễn ra trong hai bình này: - Phản ứng chuyển hóa NO2 thành N2O4. - Phản ứng chuyển hóa N2O4 thành NO2. CH tr 7 Video hướng dẫn giải
Phương pháp: Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng. Lời giải chi tiết:
Phương pháp: Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng. Chiều từ trái sang phải (chiều các chất ban đầu tạo thành chất sản phẩm) được gọi là chiều thuận. Chiều từ phải sang trái (chiều các chất sản phẩm tạo thành chất ban đầu) được gọi là chiều nghịch. Lời giải chi tiết: Phản ứng thuận nghịch không xảy ra hoàn toàn được vì khi các chất ban đầu phản ứng với nhau tạo sản phẩm thì các sản phẩm lại phản ứng với nhau để tạo thành chất phản ứng.
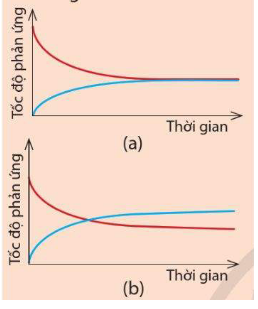
Phương pháp: Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng. Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Tuy nhiên, ở trạng thái cân bằng, phản ứng thuận và phản ứng nghịch vẫn tiếp diễn với tốc độ bằng nhau nhưng nồng độ của một chất bất kì trong phản ứng không đổi là do lượng mất đi và lượng sinh ra chất đó là bằng nhau. Như vậy, cân bằng hoá học là cân bằng động. Lời giải chi tiết: H2(g) + I2(g) ⇌ 2HI(g) Không màu Tím Không màu a) Màu tím của hỗn hợp khí lại nhạt dần so với lúc mới bắt đầu trộn hai khí H2 và I2, với nhau vì khi trộn H2 và I2 phản ứng thuận diễn ra tạo khí HI không màu. b) Sau một khoảng thời gian, màu tím của hỗn hợp không thay đổi, chứng tỏ nồng độ của I2 không thay đổi CH tr 8 Video hướng dẫn giải
Phương pháp: Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng. Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Tuy nhiên, ở trạng thái cân bằng, phản ứng thuận và phản ứng nghịch vẫn tiếp diễn với tốc độ bằng nhau nhưng nồng độ của một chất bất kì trong phản ứng không đổi là do lượng mất đi và lượng sinh ra chất đó là bằng nhau. Như vậy, cân bằng hoá học là cân bằng động. Lời giải chi tiết: Sau một khoảng thời gian, màu tím của hỗn hợp khí không thay đổi, chứng tỏ nồng độ I2 không thay đổi. Nghĩa là sau một thời gian, lượng I2 sinh ra từ phản ứng nghịch và lượng I2 mất đi từ phản ứng thuận bằng nhau. Hay tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Do đó đồ thị (a) thể hiện đúng Ví dụ 2. Đường màu xanh biểu diễn tốc độ phản ứng nghịch. Ban đầu phản ứng, chưa sinh ra HI nên tốc độ phản ứng nghịch bằng 0. Sau một thời gian, lượng HI sinh ra càng nhiều, tốc độ phản ứng nghịch tăng. Sau đó, lượng HI sinh ra từ phản ứng thuận bằng lượng HI mất đi từ phản ứng nghịch, tức tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch nên đường đồ thị màu xanh trùng với đường đồ thị màu đỏ.
Phương pháp: - Công thức tính tốc độ phản ứng aA+bB → cC + dD dựa vào định luật tác dụng khối lượng: \[{\rm{v = kC}}_{\rm{A}}^{\rm{a}}{\rm{C}}_{\rm{B}}^{\rm{b}}\] Lời giải chi tiết: H2(g) + I2(g) ⇌ 2HI \[\begin{array}{l}{{\rm{v}}_{\rm{t}}}{\rm{ = }}{{\rm{k}}_{\rm{t}}}{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}}\\{{\rm{v}}_{\rm{n}}}{\rm{ = }}{{\rm{k}}_{\rm{n}}}{\rm{C}}_{{\rm{HI}}}^{\rm{2}}\end{array}\] Với kt và kn lần lượt là hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch. kt và kn chỉ phụ thuộc vào nhiệt độ nên giá trị \[\frac{{{{\rm{k}}_{\rm{t}}}}}{{{{\rm{k}}_{\rm{n}}}}}\] là một hằng số ở nhiệt độ xác định. CH tr 9 Video hướng dẫn giải
Phương pháp: Với một phản ứng thuận nghịch bất kì: aA + bB ⇌ mM + nM KC được gọi là hằng số cân bằng (tính theo nồng độ mol), giá trị của KC chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ. Khi đó biểu thức tính KC như sau: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[M]}}}^{\rm{m}}}{{{\rm{[N]}}}^{\rm{n}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\] Trong đó: a, b, m, n lần lượt là hệ số tỉ lượng tương ứng của các chất A, B, M, N trong phương trình hoá học; [A], [B], [M], [N] lần lượt là nồng độ mol của các chất A, B, M, N ở trạng thái cân bằng. Lưu ý: Trong công thức tính hằng số cân bằng KC, chỉ xét những chất ở thể khí và chất tan trong dung dịch. Lời giải chi tiết: a) a, N2(g) + 3H2(g) ⇌ 2NH3(g) \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[N}}{{\rm{H}}_3}{\rm{]}}}^2}}}{{{\rm{[}}{{\rm{N}}_2}{\rm{][}}{{\rm{H}}_2}{{\rm{]}}^3}}}\] b) CaCO3 (s) ⇌ CaO (s) + CO2 (g) \[{{\rm{K}}_{\rm{C}}}{\rm{ = [C}}{{\rm{O}}_{\rm{2}}}{\rm{]}}\]
Phương pháp: Với một phản ứng thuận nghịch bất kì: aA + bB ⇌ mM + nM KC được gọi là hằng số cân bằng (tính theo nồng độ mol), giá trị của KC chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ. Khi đó biểu thức tính KC như sau: \({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{(M)}}}^{\rm{m}}}{{{\rm{(N)}}}^{\rm{n}}}}}{{{{{\rm{(A)}}}^{\rm{a}}}{{{\rm{(B)}}}^{\rm{b}}}}}\) Trong đó: a, b, m, n lần lượt là hệ số tỉ lượng tương ứng của các chất A, B, M, N trong phương trình hoá học; (A), (B), (M), (N) lần lượt là nồng độ mol của các chất A, B, M, N ở trạng thái cân bằng. Lưu ý: Trong công thức tính hằng số cân bằng KC, chỉ xét những chất ở thể khí và chất tan trong dung dịch. Lời giải chi tiết: - Trong phản ứng (*): \({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{(HI)}}}^{\rm{2}}}}}{{{\rm{(}}{{\rm{H}}_{\rm{2}}}{\rm{)(}}{{\rm{I}}_{\rm{2}}}{\rm{)}}}}\) - Trong phản ứng (**): \({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{\rm{(HI)}}}}{{{{{\rm{(}}{{\rm{H}}_{\rm{2}}}{\rm{)}}}^{\frac{1}{2}}}{{{\rm{(}}{{\rm{I}}_{\rm{2}}}{\rm{)}}}^{\frac{1}{2}}}}}\) Giá trị hai hằng số cân bằng này không bằng nhau.
Phương pháp: Với một phản ứng thuận nghịch bất kì: aA + bB ⇌ mM + nM KC được gọi là hằng số cân bằng (tính theo nồng độ mol), giá trị của KC chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ. Khi đó biểu thức tính KC như sau: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[M]}}}^{\rm{m}}}{{{\rm{[N]}}}^{\rm{n}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\] Trong đó: a, b, m, n lần lượt là hệ số tỉ lượng tương ứng của các chất A, B, M, N trong phương trình hoá học; (A), (B), (M), (N) lần lượt là nồng độ mol của các chất A, B, M, N ở trạng thái cân bằng. Lưu ý: Trong công thức tính hằng số cân bằng KC, chỉ xét những chất ở thể khí và chất tan trong dung dịch. Lời giải chi tiết: a) \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{]}}}^{\rm{3}}}{\rm{[CO]}}}}{{{\rm{[C}}{{\rm{H}}_{\rm{4}}}{\rm{][}}{{\rm{H}}_{\rm{2}}}{\rm{O]}}}} = \frac{{{{1,150}^3}.0,126}}{{0,126.0,242}} \approx 6,285\] b) CH4 (g) + H2O (g) ⇌ 3H2 (g) + CO (g) Ban đầu: x x Phản ứng: 0,2 ← 0,2 ← 0,6 → 0,2 Cân bằng: (x – 0,2) (x - 0,2) 0,6 0,2 Ở 760 °C: \[\begin{array}{l}{{\rm{K}}_{\rm{C}}}{\rm{ = }}6,285\\ \Leftrightarrow \frac{{{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{]}}}^{\rm{3}}}{\rm{[CO]}}}}{{{\rm{[C}}{{\rm{H}}_{\rm{4}}}{\rm{][}}{{\rm{H}}_{\rm{2}}}{\rm{O]}}}} = 6,285\\ \Leftrightarrow \frac{{{{0,6}^3}.0,2}}{{(x - 0,2)(x - 0,2)}} = 6,285\\ \Rightarrow x \approx 0,283(M)\end{array}\] CH tr 10 Video hướng dẫn giải
Phương pháp: aA + bB ⇌ mM + nM Khi đó biểu thức tính hằng số cân bằng KC như sau: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[M]}}}^{\rm{m}}}{{{\rm{[N]}}}^{\rm{n}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\] Trong đó: a, b, m, n lần lượt là hệ số tỉ lượng tương ứng của các chất A, B, M, N trong phương trình hoá học; (A), (B), (M), (N) lần lượt là nồng độ mol của các chất A, B, M, N ở trạng thái cân bằng. Hằng số cân bằng càng lớn (hay nhỏ) cho biết mức độ phản ứng thuận diễn ra thuận lợi hay không thuận lợi. Lời giải chi tiết: N2 (g) + 3H2 (g) ⇌ 2NH3 (g) \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[N}}{{\rm{H}}_3}{\rm{]}}}^2}}}{{{\rm{[}}{{\rm{N}}_2}{\rm{][}}{{\rm{H}}_2}{{\rm{]}}^3}}}\] Ta thấy, KC càng lớn, phản ứng thuận tạo ra NH3 diễn ra càng thuận lợi, các chất ở trạng thái cân bằng chủ yếu là chất sản phẩm. Do đó người ta tăng nồng độ N2 và H2 để lượng NH3 sinh ra nhiều hơn.
Phương pháp: Với một phản ứng thuận nghịch bất kì: aA + bB ⇌ mM + nM KC được gọi là hằng số cân bằng (tính theo nồng độ mol), giá trị của KC chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ. Khi đó biểu thức tính KC như sau: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[M]}}}^{\rm{m}}}{{{\rm{[N]}}}^{\rm{n}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\] Trong đó: a, b, m, n lần lượt là hệ số tỉ lượng tương ứng của các chất A, B, M, N trong phương trình hoá học; (A), (B), (M), (N) lần lượt là nồng độ mol của các chất A, B, M, N ở trạng thái cân bằng. Lưu ý: Trong công thức tính hằng số cân bằng KC, chỉ xét những chất ở thể khí và chất tan trong dung dịch. Lời giải chi tiết: HA ⇌ H+ + A- Ban đầu: 0,5 Phản ứng: x → x → x Cân bằng: (0,5 – x) x x \[\begin{array}{l}{\rm{ }}{{\rm{K}}_{{\rm{C(HA)}}}} = {\rm{ }}0,2\\ \Leftrightarrow \frac{{{\rm{[}}{{\rm{H}}^{\rm{ + }}}{\rm{][}}{{\rm{A}}^{\rm{ - }}}{\rm{]}}}}{{{\rm{[HA]}}}}{\rm{ = 0}}{\rm{,2}}\\ \Leftrightarrow \frac{{{\rm{x}}{\rm{.x}}}}{{{\rm{(0}}{\rm{,5 - x)}}}}{\rm{ = 0}}{\rm{,2}}\\ \Rightarrow {\rm{x}} \approx {\rm{0}}{\rm{,232 (M) = [}}{{\rm{H}}^{\rm{ + }}}{\rm{]}}\end{array}\] HB ⇌ H+ + B- Ban đầu: 0,5 Phản ứng: y → y → y Cân bằng: (0,5 – y) y y \[\begin{array}{l}{\rm{ }}{{\rm{K}}_{{\rm{C(HB)}}}} = {\rm{ }}0,1\\ \Leftrightarrow \frac{{{\rm{[}}{{\rm{H}}^{\rm{ + }}}{\rm{][}}{{\rm{B}}^{\rm{ - }}}{\rm{]}}}}{{{\rm{[HB]}}}}{\rm{ = 0}}{\rm{,1}}\\ \Leftrightarrow \frac{{{\rm{y}}{\rm{.y}}}}{{{\rm{(0}}{\rm{,5 - y)}}}}{\rm{ = 0}}{\rm{,1}}\\ \Rightarrow {\rm{y}} \approx {\rm{0}}{\rm{,179 (M) = [}}{{\rm{H}}^{\rm{ + }}}{\rm{]}}\end{array}\] Ta thấy nồng độ H+ trong sinh ra trong phản ứng phân li HA lớn hơn nồng độ nồng độ H+ trong sinh ra trong phản ứng phân li HB và KC(HA) > KC(HB), chứng tỏ hằng số cân bằng (hằng số phân li acid) càng lớn, acid càng dễ tạo thành H+, acid càng mạnh. CH tr 11 Video hướng dẫn giải
Phương pháp: aA + bB ⇌ mM + nM Khi đó biểu thức tính hằng số cân bằng KC như sau: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[M]}}}^{\rm{m}}}{{{\rm{[N]}}}^{\rm{n}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\] Trong đó: a, b, m, n lần lượt là hệ số tỉ lượng tương ứng của các chất A, B, M, N trong phương trình hoá học; (A), (B), (M), (N) lần lượt là nồng độ mol của các chất A, B, M, N ở trạng thái cân bằng. Hằng số cân bằng càng lớn (hay nhỏ) cho biết mức độ phản ứng thuận diễn ra thuận lợi hay không thuận lợi. Lời giải chi tiết: Ở 25oC, K(C) (1) > K(C) (2) nên tốc độ xảy ra phản ứng thuận (tạo thành methanol) của phản ứng (1) lớn hơn phản ứng (2). Do đó phản ứng thích hợp để điều chế CH3OH là phản ứng (1).
Phương pháp: Khi một phản ứng thuận nghịch ở trạng thái cân bằng, nếu thay đổi nhiệt độ thì cân bằng cũ sẽ bị phá vỡ, cân bằng mới được hình thành theo chiều làm giảm sự thay đổi nhiệt độ đó. Ta gọi đây là sự chuyển dịch cân bằng (từ cân bằng cũ sang cân bằng mới). Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\] > 0: Phản ứng thu nhiệt. \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\] < 0: Phản ứng tỏa nhiệt. Lời giải chi tiết: a) Dựa vào màu sắc của hỗn hợp khí, ta biết được trạng thái cân bằng của phản ứng (8) bị chuyển dịch khi thay đổi nhiệt độ. b) 2NO2(g) ⇌ N2O4(g) (8) \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= -58 kJ (nâu đỏ) (không màu) Theo chiều thuận: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= -58 kJ < 0 → Chiều thuận tỏa nhiệt. Theo chiều nghịch: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= 58 kJ > 0 → Chiều nghịch thu nhiệt. Khi tăng nhiệt độ, hỗn hợp có màu nâu đậm hơn, cân bằng chuyển dịch theo tạo ra NO2 hay cân bằng chuyển dịch theo chiều thu nhiệt. Khi hạ nhiệt độ, hỗn hợp trở nên nhạt màu hơn, cân bằng chuyển dịch theo chiều tạo ra N2O4 hay cân bằng chuyển dịch theo chiều tỏa nhiệt. CH tr 12 Video hướng dẫn giải
Phương pháp: Khi một phản ứng thuận nghịch ở trạng thái cân bằng, nếu thay đổi nhiệt độ thì cân bằng cũ sẽ bị phá vỡ, cân bằng mới được hình thành theo chiều làm giảm sự thay đổi nhiệt độ đó. Ta gọi đây là sự chuyển dịch cân bằng (từ cân bằng cũ sang cân bằng mới). Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Lời giải chi tiết: CH3COO- + H2O ⇌ CH3COOH + OH- (9) Sau khi đun nóng ống nghiệm B, màu hồng trong ống nghiệm B đậm hơn ống nghiệm A. Chứng tỏ, trong ống nghiệm B, khi tăng nhiệt độ cân bằng chuyển dịch theo chiều thuận tạo NaOH, nồng độ NaOH tăng, làm chỉ thị phenolphthalein hóa hồng đậm hơn.
Phương pháp: Khi một phản ứng thuận nghịch ở trạng thái cân bằng, nếu thay đổi nhiệt độ thì cân bằng cũ sẽ bị phá vỡ, cân bằng mới được hình thành theo chiều làm giảm sự thay đổi nhiệt độ đó. Ta gọi đây là sự chuyển dịch cân bằng (từ cân bằng cũ sang cân bằng mới). Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Lời giải chi tiết: Theo chiều thuận: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= -197,8 kJ < 0 → Chiều thuận tỏa nhiệt. Theo chiều nghịch: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= 197,8 kJ > 0 → Chiều nghịch thu nhiệt. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm tác động của việc tăng nhiệt độ, nghĩa là cân bằng chuyển dịch theo chiều thu nhiệt (chiều nghịch).
Phương pháp: Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Lời giải chi tiết: Số mol khí vế trái: 2 mol. Số mol khí vế phải: 1 mol. Khi tăng áp suất của hỗn hợp (bằng cách nén hỗn hợp) ở điều kiện nhiệt độ không đổi, cân bằng chuyển dịch theo chiều làm giảm áp suất, nghĩa là cân bằng chuyển dịch theo chiều làm giảm số mol khí - cân bằng chuyển dịch theo chiều thuận. CH tr 13 Video hướng dẫn giải
Phương pháp: Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Lời giải chi tiết: N2(g) + 3H2(g) ⇌ 2NH3(g) Tổng số mol khí ở vế trái: 1 + 3 = 4 (mol) Số mol khí ở vế phải: 2 (mol) Khi tăng áp suất, hệ cân bằng chuyển dịch theo chiều làm giảm áp suất của hệ (giảm số mol khí của hệ). Cân bằng trên chuyển dịch theo chiều thuận (chiều tạo NH3). Khi giảm áp suất, hệ cân bằng chuyển dịch theo chiều làm tăng áp suất của hệ (tăng số mol khí của hệ). Cân bằng trên chuyển dịch theo chiều nghịch (chiều phân hủy NH3). Vậy để thu được NH3 với hiệu suất cao, người ta thực hiện phản ứng ở áp suất cao. Thực tế, phản ứng tổng hợp NH3 ở các nhà máy thường được thực hiện ở áp suất 200 – 300 atm.
Phương pháp: Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Lời giải chi tiết: Khi tăng nồng độ của các chất phản ứng như \[{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}{\rm{, ROH}}\]- cân bằng chuyển dịch theo chiều làm giảm nồng độ \[{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}{\rm{, ROH}}\]nghĩa là cân bằng chuyển dịch theo chiều thuận (chiều tạo thành ester). Khi giảm nồng độ của các chất \[{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOR}}{\rm{, }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\]- cân bằng chuyển dịch theo chiều làm tăng nồng độ \[{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOR}}{\rm{, }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\]nghĩa là cân bằng cân bằng chuyển dịch theo chiều thuận (chiều tạo thành ester). CH tr 14 Video hướng dẫn giải
Phương pháp: Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Tuy nhiên, ở trạng thái cân bằng, phản ứng thuận và phản ứng nghịch vẫn tiếp diễn với tốc độ bằng nhau nhưng nồng độ của một chất bất kì trong phản ứng không đổi là do lượng mất đi và lượng sinh ra chất đó là bằng nhau. Như vậy, cân bằng hoá học là cân bằng động. Lời giải chi tiết: Phát biểu sai: C Khi phản ứng thuận nghịch đạt trạng thái cân bằng, nồng độ mol của chất phản ứng và các chất sản phẩm không đổi. Tùy thuộc vào hệ số tỉ lượng của phương trình phản ứng và thời điểm đạt trạng thái cân bằng, không phải lúc nồng độ mol của chất phản ứng cũng bằng nồng độ mol của chất sản phẩm phản ứng.
Phương pháp: aA + bB ⇌ mM + nM Khi đó biểu thức tính hằng số cân bằng KC như sau: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[M]}}}^{\rm{m}}}{{{\rm{[N]}}}^{\rm{n}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\] Trong đó: a, b, m, n lần lượt là hệ số tỉ lượng tương ứng của các chất A, B, M, N trong phương trình hoá học; (A), (B), (M), (N) lần lượt là nồng độ mol của các chất A, B, M, N ở trạng thái cân bằng. Lời giải chi tiết: \[{{\rm{C}}_{{\rm{M(S}}{{\rm{O}}_{\rm{2}}}{\rm{)}}}}{\rm{ = }}\frac{{{\rm{0}}{\rm{,4}}}}{{\rm{1}}}{\rm{ = 0}}{\rm{,4 (M); }}{{\rm{C}}_{{\rm{M(}}{{\rm{O}}_{\rm{2}}}{\rm{)}}}}{\rm{ = }}\frac{{{\rm{0}}{\rm{,6}}}}{{\rm{1}}}{\rm{ = 0}}{\rm{,6 (M); [S}}{{\rm{O}}_{\rm{3}}}{\rm{] = }}\frac{{{\rm{0}}{\rm{,3}}}}{{\rm{1}}}{\rm{ = 0}}{\rm{,3(M)}}\] Theo tỉ lệ phản ứng; 2 : 1 : 2 2SO2 (g) + O2 (g) ⇌ 2SO3 (g) Ban đầu: 0,4 0,6 Phản ứng: 0,3 ← 0,15 ← 0,3 Cân bằng: 0,1 0,45 0,3 \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[S}}{{\rm{O}}_{\rm{3}}}{\rm{]}}}^{\rm{2}}}}}{{{{{\rm{[S}}{{\rm{O}}_{\rm{2}}}{\rm{]}}}^{\rm{2}}}{\rm{[}}{{\rm{O}}_{\rm{2}}}{\rm{]}}}} = \frac{{{{0,3}^2}}}{{{{0,1}^2}.0,45}} = 20\]
Phương pháp: Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Lời giải chi tiết: Phản ứng hình thành thạch nhũ là phản ứng xảy ra theo chiều thuận. Nếu nồng độ CO2 hoà tan trong nước tăng lên, cân bằng chuyển dịch theo chiều làm giảm nồng độ CO2 – cân bằng chuyển dịch theo chiều nghịch, không thuận lợi cho sự hình thành nhũ đá.
|














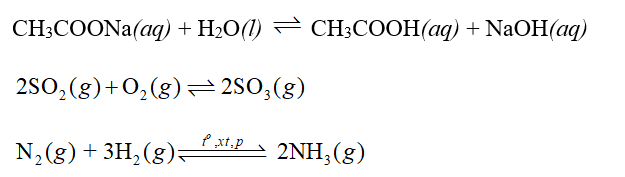






Danh sách bình luận