Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạoNhận định nào không đúng về cấu tạo và tính chất của các kim loại nhóm IIA? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
18.1 Nhận định nào không đúng về cấu tạo và tính chất của các kim loại nhóm IIA? A. Khối lượng riêng tương đối nhỏ, là những kim loại nhẹ hơn nhôm (trừ Ba). B. Độ cứng cao hơn kim loại nhóm IA, nhưng mềm hơn kim loại nhôm. C. Mạng tinh thể của chúng đều có kiểu lập phương tâm khối. D. Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp ( trừ Be). Phương pháp giải: Dựa vào cấu trúc tinh thể của kim loại nhóm IIA. Lời giải chi tiết: Vì Be, Mg là kiểu lục phương; Ca, Sr là kiểu lập phương tâm diện; Ba là kiểu lập phương tâm khối. Đáp án C 18.2 Phương trình hóa học của phản ứng nào sau đây không đúng? A. Ca + 2H2O → Ca(OH)2 + H2 B. BeO + H2O → Be(OH)2 C. Mg + H2SO4→ MgSO4 + H2 D. Be + 2NaOH → Na2BeO2 + H2 Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: Vì Be và BeO không tác dụng với nước ở bất kì điều kiện nào. Đáp án B 18.3 Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường, tạo ra dung dịch có môi trường kiềm là A. Na, Ba, K. B. Na, Fe, K. C. Be, Na, Ca. D. Na, Cr, K. Phương pháp giải: Dựa vào tính chất hóa học của kim loại IA, IIA. Lời giải chi tiết: Na, Ba, K đều tan được trong nước tạo ra dung dịch có môi trường kiềm. Đáp án A 18.4 Cho phương trình hóa học của phản ứng nhiệt phân sau:
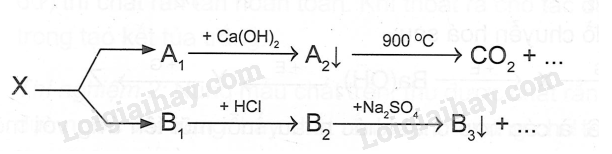
M là kim loại nào sau đây? A. Ca B. Mg C. K D. Ag Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: Vì muối nitrate của kim loại từ Mg đến Cu khi nhiệt phân tạo ra basic oxide , NO2 và O2 Đáp án B 18.5 Cho 400ml dung dịch Ba(OH)2 0,1 M vào 600ml dung dịch NaHCO3 0,1 M. Sau phản ứng thu được m gam kết tủa . Giá trị của m là A. 5,91 B. 3,94 C. 7,88 D. 4,00 Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: nBa(OH)2 = 0.1.0,4 = 0,04 (mol); nNaHCO3 = 0,1.0,6 = 0,06 (mol) Ba(OH)2 + 2NaHCO3 → BaCO3 + Na2CO3 + 2H2O 0,03 0,06 0,03 0,03 Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH 0,02 0,01 0,01 0,02 Từ PT ta có nBaCO3 = 0,03 + 0,01 = 0,04 (mol). Suy ra mBaCO3 = 0,04.197 = 7,88 (gam) 18.6 Cho sơ đồ: Chất X trong sơ đồ trên có thể là A. BaCO3 B. CaCO3 C. BaSO3 D. MgCO3 Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: BaCO3 CO2 + Ca(OH)2→ CaCO3 + H2O CaCO3 BaO + 2HCl → BaCl2 + H2O BaCl2 + Na2SO4 →BaSO4 + 2NaCl Đáp án A 18.7 Trong các mẫu nước cứng sau đây, nước cứng tạm thời là A. dung dịch Ca(HCO3)2 B. dung dịch MgSO4 C. dung dịch CaCl2 D. dung dịch Mg(NO3)2 Phương pháp giải: Dựa vào khái niệm của nước cứng. Lời giải chi tiết: Vì nước cứng tạm thời chứa ion Ca2+, Mg2+ và HCO3- Đáp án A 18.8 Trong cốc nước chưa 0,01 mol Na+; 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và 0,02 mol Cl-. Đun sôi cốc nước hồi lâu, nước thu được là A. Nước cứng tạm thời. C. Nước mềm. B. Nước cứng vĩnh cửu. D. Nước cứng toàn phần. Phương pháp giải: Dựa vào định luật bảo toàn điện tích. Lời giải chi tiết: Các phương trình hóa học của phản ứng: 2HCO3- 0,05 → 0,025 CO32- + Ca2+ → CaCO3 0,02 ← 0,02 CO32- + Mg2+ → MgCO3 0,005 → 0,005 Sau khi đun, trong cốc nước còn lại 0,01 mol Na+ ; 0,005 mol Mg2+ và 0,02 mol Cl- .Do còn muối MgCl2 nên nước cứng thu được là nước cứng vĩnh cửu. Đáp án B 18.9 Hai chất nào sau đây được dùng để làm mềm nước có tính cứng vĩnh cửu? A. NaCl và Ca(OH)2 B. Na2CO3 và Na3PO4 C. Na2CO3 và Ca(OH)2 D. Na2CO3 và HCl Phương pháp giải: Dựa vào các cách làm mềm nước cứng. Lời giải chi tiết: Để làm mềm nước cứng có tính vĩnh cửu dùng muối Na2CO3 , Na3PO4 hoặc phương pháp lọc qua màng. Đáp án B 18.10 Phản ứng giải thích sự hình thành thạch nhũ các hang động núi đá vôi là: A. CaCO3 + CO2 +H2O → Ca(HCO3)2 B. CaCO3 + 2HCl → CaCl2 + CO2 + H2O C. CaCO3 → CaO + CO2 D. Ca(HCO3)2 → CaCO3 + CO2 + H2O Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: Ca(HCO3)2 → CaCO3 + CO2 + H2O là phản ứng giải thích sự hình thành nhũ các hang động qua hàng triệu năm Đáp án D 18.11 Hợp chất Y của calcium là thành phần chính của vỏ các loại ốc, sò, .......Ngoài ra Y được sử dụng rộng rãi trong sản xuất vôi, xi măng, thủy tinh, chất phụ gia trong công nghiệp thực phẩm. Hợp chất Y là A. CaO B. CaCO3 C. Ca(OH)2 D. Ca3(PO4)2 Phương pháp giải: Dựa vào tính chất của Y. Lời giải chi tiết: Vì Y có nhiều trong vỏ các loại ốc, sò và là hợp chất của calcium nên Y là CaCO3. Đáp án B 18.12 Cho sơ đồ chyển hóa sau: Biết X, Y, Z, E, G là các hợp chất khác nhau, mỗi mũi tên ứng với một phương trình hóa học của phản ứng xảy ra giữa hai chất tương ứng. Các chất E,G trong sơ đồ trên lần lượt là A. Na2SO4, NaOH. B. NaHCO3, BaCl2. C. CO2, NaHSO4. D. Na2CO3, HCl. Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: Phương trình hóa học của các phản ứng trong sơ đồ: Ba(OH)2 + 2CO2 → Ba(HCO3)2 BaCO3 + NaHSO4 → BaSO4 + 2NaHCO3 Ba(OH)2 + CO2 → BaCO3 + H2O Ba(HCO3 )2 + 2NaHSO4 → BaSO4 + CO2 + Na2SO4 + H2O Đáp án C 18.13 Nước thải công nghiệp thường chứa các ion kim loại năng như Hg2+, Pb2+, Fe3+. Để xử lí toàn bộ và làm giảm nồng độ của các ion kim loại nặng với chi phí thấp, người ta sử dụng dung dịch chất nào sau đây? A. HCl B. NaCl C. Ca(OH)2 D. K2SO4 Phương pháp giải: Dựa vào tính chất hóa học nhóm IIA. Lời giải chi tiết: Dùng Ca(OH)2 để loại bỏ muối của các kim loại nặng vì các kim loại nặng đều tạo kết tủa với OH-. Đáp án C 18.14 Viết cấu hình electron và xác định vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học trong bảng theo mẫu sau:
Phương pháp giải: Dựa vào vị trí các nguyên tố trong bảng tuần hoàn. Lời giải chi tiết:
18.15 Trên bề mặt các hố nước vôi tôi lâu ngày thường có lớp màng chất rắn. Hãy giải thích hiện tượng này và viết phương trình hóa học minh họa cho phản ứng. Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: Lớp màng rắn đó là CaCO3. Trong nước vôi tôi có chứa Ca(OH)2 dưới dạng hòa tan vào nước (nước vôi trong) và trong không khí có khí CO2 nên xảy ra phản ứng tạo kết tủa CaCO3 Ca(OH)2 + CO2 → CaCO3 + H2O 18.16 Trên bàn thí nghiệm có những chất rắn riêng biệt màu trắng: Na2CO3, KHCO3, Ba(HCO3)2, MgCO3, BaSO4. Một học sinh đã lấy một trong những chất trên bàn để làm thí nghiệm và thu được kết quả sau: Thí nghiệm 1: cho mẫu chất trên tác dụng với dung dịch H2SO4 (loãng, dư) thì chất rắn tan hoàn toàn. Khí thoát ra cho tác dụng với nước vôi trong tạo kết tủa trắng. Thí nghiệm 2: nung mẫu chất trên, thu được chất rắn khí thoát ra làm đục nước vôi trong. Lấy chất rắn sau khi nung tác dụng với dung dịch HCl, chất khí thoát ra cũng làm đục nước vôi trong. Xác định chất mà bạn học sinh đã lấy để làm thí nghiệm. Viết các phương trình hóa học cho phản ứng xảy ra. Phương pháp giải: Dựa vào tính chất hóa học của kim loại IA và IIA. Lời giải chi tiết: Thí nghiệm 1: Cho mẫu chất trên tác dụng với dung dịch H2SO4(loãng, dư) thì chất rắn tan hoàn toàn. Khí thoát ra cho tác dụng với nước vôi trong tạo kết tủa trắng, chất đó là muối carbonate hoặc hydrogencarbonate. Thí nghiệm 2: Nung mẫu chất trên, thu được chất rắn, khí thoát ra làm đục nước vôi trong. Lấy chất rắn sau khi nung tác dụng với dung dịch HCl, chất khí thoát ra cũng làm đục nước vôi trong. Chất đó là muối hydrogencarbonate. Kết hợp hai thí nghiệm trên, chất mà bạn học sinh đã lấy để làm thí nghiệm là KHCO3 2KHCO3 + H2SO4 → K2SO4 + 2CO2 + 2H2O CO2 + Ca(OH)2 → CaCO3 + H2O KHCO3 → K2CO3 + CO2 + H2O K2CO3 + 2HCl → 2KCl + CO2 + H2O 18.17 Khi nung hoàn toàn 2,2842g một nitrate kim loại II trong không khí thì thu được 0,972g oxide kim loại. Xác định công thức muối nitrate. Phương pháp giải: Dựa vào tính chất hóa học của kim loại. Lời giải chi tiết: n M(NO3)2 = \(\frac{{2,2842}}{{M + 124}}\)mol; n MO = \(\frac{{0,972}}{{M + 16}}\)mol PTHH: M(NO3)2 → MO + 2NO2 + ½ O2 Theo phương trình phản ứng: n M(NO3)2 = n NO → \(\frac{{2,2842}}{{M + 124}}\)=\(\frac{{0,972}}{{M + 16}}\) Giải phương trình thu được: M = 64amu (Cu) Vậy công thức muối nitrate là Cu(NO3)2 18.18 Từ 2 chất ban đầu là magnesium và nitric acid đặc, mô tả cách điều chế magnesium oxide. Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: Đầu tiên chuyển Mg thành Mg(NO3)2 . Tiếp theo thu MgO bằng cách nung Mg(NO3)2 . \(\begin{array}{l}Mg + 4HN{O_3} \to Mg{(N{O_3})_{_2}} + 2N{O_2} + 2{H_2}{\rm{O}}\\Mg{(N{O_3})_{_2}} \to MgO + 2N{O_2} + \frac{1}{2}{O_2}\end{array}\) 18.19 Sau đây là hai sơ đồ phản ứng liên quan đến magnesium oxide. Sơ đồ I: Khi magnesium cháy trong oxygen thu được chất rắn A màu trắng. A tan trong dung dịch HCl, thu được dung dịch B không màu. Cho Na2CO3 vào B có kết tủa trắng C. Nung nóng C bị phân hủy thành A và sinh ra khí không màu E. Khi cho E vào nước vôi trong thì xuất hiện kết tủa trắng G. Sơ đồ II: Magnesium phản ứng với H2SO4 loãng, tạo dung dịch H không màu. Xử lí H với lượng dư NaOH tạo ra kết tủa trắng I. I tan hết trong dung dịch HNO3 1M tạo thành dung dịch không màu. Khi dung dịch bay hơi từ từ thì xuất hiện chất rắn K màu trắng. Đun nóng K thấy có khí màu nâu thoát ra. Xác định các chất A đến K và viết phương trình hóa học biểu diễn phản ứng xảy ra. Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: Sơ đồ I: 2Mg + O2 → 2MgO A MgO + 2HCl → MgCl2 + H2O A B MgCl2 + Na2CO3 → MgCO3 + 2NaCl B C MgCO3 → MgO + CO2 C A E CO2 + Ca(OH)2 → CaCO3 + H2O E G Sơ đồ II: Mg + H2SO4 → MgSO4 + H2 H MgSO4 + 2 NaOH → Mg(OH)2 + 2Na2SO4 H I Mg(OH)2 + 2HNO3 →Mg(NO3)2 + H2O I K Mg(NO3)2 MgO + 2NO2 + O2 K 18.20 Cho các sơ đồ chuyển hóa sau: Biết X, Y, Z là hợp chất của cùng một kim loại, khi đốt nóng cho ngọn lửa màu vàng. Xác định các hợp chất X, Y, Z, E. Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: X, Y, Z là hợp chất của cùng 1 kim loại, khi đốt nóng cho ngọn lửa màu vàng, vậy kim loại đó có thể là sodium. Y nhiệt phân tạo ra khí E và Z, vậy E là CO2 ,Y là NaHCO3 và Z là Na2CO3.Các phương trình hóa học của phản ứng: NaOH + NaHCO3 → Na2CO3 + H2O X Y Z 2NaHCO3 → Na2CO3 + H2O + CO2↑ Y Z E CO2 + NaOH → NaHCO3 E X Y CO2 + NaOH → Na2CO3 + H2O E X Z 18.21 Triệu chứng trào ngược vị dạ dày (hay trào ngược dạ dày ) xảy ra khi hàm lượng hydrocholoric acid trong dạ dày vượt mức bình thường. Để giảm bớt hàm lượng hydrochloric acid dư, bác sĩ thường kê toa cho bệnh nhân một số loại thuốc kháng acid có thành phần như bảng theo mẫu sau: Bảng thành phần các loại thuốc kháng acid dạ dày trên thị trường
Hoàn thành cột phản ứng (dạng ion thu gọn ) trung hòa acid dạ dày khi sử dụng các loại thuốc trên. Phương pháp giải: Dựa vào tính chất hóa học của kim loại IA, IIA. Lời giải chi tiết:
18.22 Từ dữ liệu cho ở bảng sau, hãy tính các giá trị \({\Delta _r}H_{298}^o\) của phản ứng phân hủy các chất sau và cho biết hợp chất nào dễ bị phân hủy hơn? Bảng giá trị \({\Delta _f}H_{298}^o\) của một số chất
Phương pháp giải: Dựa vào công thức tính biến thiên enthalpy của phản ứng. Lời giải chi tiết: Giá trị \({\Delta _r}H_{298}^o\) của các phản ứng phân hủy: a) MgCO3(s) \(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2}) + {\Delta _f}H_{298}^o(MgO) - {\Delta _f}H_{298}^o(MgC{O_3})\\ = - 393,50 + ( - 601,20) - ( - 1112,00) = 117,30kJ\end{array}\) b) CaCO3(s) \(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2}) + {\Delta _f}H_{298}^o(CaO) - {\Delta _f}H_{298}^o(CaC{O_3})\\ = - 393,50 + ( - 635,10) - ( - 1206,90) = 178,30kJ\end{array}\)
c) SrCO3(s) \(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2}) + {\Delta _f}H_{298}^o(SrO) - {\Delta _f}H_{298}^o(SrC{O_3})\\ = - 393,50 + ( - 592,00) - ( - 1218,00) = 232,50kJ\end{array}\) d) BaCO3(s) \(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2}) + {\Delta _f}H_{298}^o(BaO) - {\Delta _f}H_{298}^o(BaC{O_3})\\ = - 393,50 + ( - 548,10) - ( - 1219,00) = 277,40kJ\end{array}\) 18.23 Hãy viết phương trình hóa học của phản ứng để giải thích: a) Hiện tượng bào mòn thạch nhủ tao hang động( tạo hang động ). b) Hiện tượng tạo thành nhũ đá, măng đá trong các hang động tự nhiên. c) Câu tục ngữ “nước chảy đá mòn”. Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: a) Hiện tượng bào mòn thạch nhũ (tạo hang động). Trên đỉnh các hang động, núi đá vôi có các kẽ nứt rất nhỏ làm cho nước mưa thấm dần xuống kết hợp với đá vôi và khí carbonic trong không khí tạo thành muối calcium hydrocarbonate tan chảy xuống: CaCO3 + CO2 + H2O → Ca(HCO3)2 b) Hiện tượng tạo thành nhũ đá, măng đá trong các hang động tự nhiên. Một phần muối calcium hydrocarbonate chuyển lại thành đá vôi, ngày qua ngày tạo thành nhũ đá. Một phần muối calcium hydrocarbonate rơi xuống đất rồi mới chuyển thành đá vôi, qua nhiều ngày tạo thành măng đá. Ca(HCO3)2 → CaCO3 ↓ + CO2 + H2O c) Câu tục ngữ “nước chảy đá mòn”: CaCO3 + CO2 + H2O → Ca(HCO3)2 18.24 Nhiệt độ thùng vôi mới tôi có thể lên tới 150 độ C và có pH= 13,1.Nếu bị bỏng vôi mới tôi sẽ để lại những vết sẹo lồi, lõm hoặc hang ổ. Tuy nhiên, nếu được sơ cứu kịp thời thì hậu quả sẽ được giảm nhẹ rất nhiều. a) Hãy lựa chọn một phương pháp sơ cứu hiệu quả nhất trong các phương pháp sau. Giải thích lí do chọn: - Rửa sạch vôi bột bằng nước rồi rửa lại bằng dung dịch ammonium choloride 100%. - Lau khô sạch vôi bột rồi rửa bằng bằng dung dịch ammonium chloride 10%. - Chỉ rửa sạch vôi bột bằng nước rồi lau khô. - Lau khô sạch vôi bột rồi rửa bằng nước xà phòng loãng. - Dội nước lạnh liên tục vào vết bỏng cho sạch vôi rồi dùng nước mắm đổ lên (biết nước mắm có pH <7). b) Trong các phương pháp trên, phương pháp nào không nên dùng nhất? Vì sao? Phương pháp giải: Dựa vào tính chất hóa học của kim loại IIA. Lời giải chi tiết: a) Phương pháp sơ cứu hiệu quả nhất trong các phương pháp là lau khô sạch vôi bột rồi rửa bằng dung dịch ammonium chloride 10% giúp trung hòa lượng vôi trên vết bỏng. Phương trình hóa học của phản ứng: 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + H2O b) Trong các phương pháp trên, phương pháp dội nước lạnh liên tục vào vết bỏng cho sạch vôi rồi dùng nước mắm đổ lên không nên dùng nhất vì nguy cơ nhiễm trùng ở các vết thương hở, gây nguy hiểm. 18.25 Carnallite là muối khoáng, thành phần gồm có KCl và MgCl2 ngậm nước. Khi nung nóng 5,55 gam carnallite, thu được 3,39 gam muối khan. Mặt khác , nếu cho 5,55 gam carnallite tác dụng với dung dịch NaOH, thu được kết tủa. Nung kết tủa đến khối lượng không đổi thì khối lượng kết tủa giảm 0,36 gam. Xác định công thức hóa học của carnallite. Phương pháp giải: Dựa vào tính chất hóa học nguyên tố nhóm IIA. Lời giải chi tiết: Gọi công thức của muối carnallite cần xác định là: KCl.MgCl2.nH2O. Ta có khối lượng nước mất đi trong muối carnallite trên sau khi nung là: m H2O = 5,55 – 3,19 = 2,16g n H2O = 2,16 : 18 = 0,16 mol Phương trình hóa học của phản ứng: MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl 0,02 ← 0,02 Mg(OH)2 → MgO + H2O 0,02 ← 0,02 Khối lượng kết tủa giảm 0,36 g là khối lượng của nước n H2O = 0,36 : 18 = 0,02 mol → n Mg(OH)2 = 0,02 mol ta có: n Mg(OH)2 = n MgCl2 = n muối carnallite = 0,02 M muối = \(\frac{{5,55}}{{0,02}} = 277,5\)→ 39 + 35,5 + 24 + 35,5.2 + n.18 = 277,5 → n = 6 Vậy công thức hóa học của các phản ứng phân hủy: KCl.MgCl2.6H2O. 18.26 Từ dữ liệu cho ở bảng, hãy tính giá trị \({\Delta _r}H_{298}^o\) của phản ứng phân hủy các chất sau và cho biết hợp chất nào dễ bị nhiệt phân hủy hơn. Bảng giá trị \({\Delta _f}H_{298}^o\)của một số chất
Phương pháp giải: Dựa vào công thức tính biến thiên enthalpy của phản ứng. Lời giải chi tiết: Gía trị \({\Delta _r}H_{298}^o\)của các phản ứng phân hủy: a) Mg(NO3)2(s) → MgO(s) + 2NO2(g) + \(\frac{1}{2}{O_2}\) \(\begin{array}{l}{\Delta _r}H_{298}^o = 2.{\Delta _f}H_{298}^o(N{O_2}) + {\Delta _f}H_{298}^o(MgO) - {\Delta _f}H_{298}^o(Mg{(N{O_3})_2}\\ = 2.33,20 + ( - 601,20) - ( - 790,65) = 255,85kJ\end{array}\) b) Ca(NO3)2(s) → CaO(s) + 2NO2(g) + \(\frac{1}{2}{O_2}\) \(\begin{array}{l}{\Delta _r}H_{298}^o = 2.{\Delta _f}H_{298}^o(N{O_2}) + {\Delta _f}H_{298}^o(CaO) - {\Delta _f}H_{298}^o(Ca{(N{O_3})_2}\\ = 2.33,20 + ( - 635,10) - ( - 938,38) = 369,68kJ\end{array}\) c) Sr(NO3)2(s) → SrO(s) + 2NO2(g) + \(\frac{1}{2}{O_2}\) \(\begin{array}{l}{\Delta _r}H_{298}^o = 2.{\Delta _f}H_{298}^o(N{O_2}) + {\Delta _f}H_{298}^o(SrO) - {\Delta _f}H_{298}^o(Sr{(N{O_3})_2}\\ = 2.33,20 + ( - 592,00) - ( - 978,22) = 2452,62kJ\end{array}\) d) Ba(NO3)2(s) → BaO(s) + 2NO2(g) + \(\frac{1}{2}{O_2}\) \(\begin{array}{l}{\Delta _r}H_{298}^o = 2.{\Delta _f}H_{298}^o(N{O_2}) + {\Delta _f}H_{298}^o(BaO) - {\Delta _f}H_{298}^o(Ba{(N{O_3})_2}\\ = 2.33,20 + ( - 548,10) - ( - 992,06) = 510,36kJ\end{array}\)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||














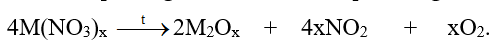
 BaO + CO2
BaO + CO2 H2O + CO2 + CO32-
H2O + CO2 + CO32-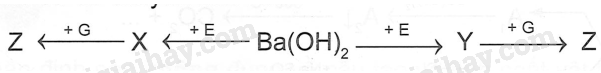
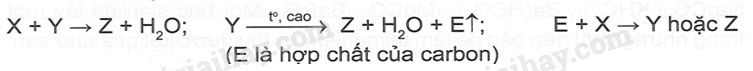

 MgO(s) + CO2(g)
MgO(s) + CO2(g)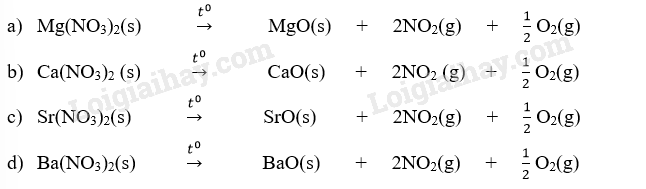






Danh sách bình luận