Bài 8. Sulfuric acid và muối sulfate trang 30, 31, 32, 33, 34 SBT Hóa 11 Kết nối tri thứcSulfuric acid đựng trong chai thuỷ tinh thường được bán trên thị trường có nồng độ là A. 98%. B. 36%. C. 63%. D. 8%. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
8.1 Sulfuric acid đựng trong chai thuỷ tinh thường được bán trên thị trường có nồng độ là A. 98%. B. 36%. C. 63%. D. 8%. Phương pháp giải: Sufuric acid bán trên thị trường được bảo quản trong chai thuỷ tinh, có nút đậy chặt, nồng độ 98%. Lời giải chi tiết: Lời giải chi tiết: Sulfuric acid đựng trong chai thuỷ tinh thường được bán trên thị trường có nồng độ là 98%. → Chọn A. 8.2 Dung dịch acid nào sau đây có khả năng gây bỏng nếu rơi vào da? A. HCl 36%. B. HNO3 63%. C. H2SO4 98%. D. H3PO4 85%. Phương pháp giải: Dung dịch sulfuric acid đặc có tính háo nước và oxi hóa mạnh. Khi acid tác động lên cơ thể, acid phá hủy cấu trúc mô như da, mỡ, gân, cơ… gây hoại tử từ ngoài vào trong theo cơ chế đông vón protein của cơ thể. Lời giải chi tiết: Dung dịch H2SO4 98% có khả năng gây bỏng nếu rơi vào da. → Chọn C. 8.3 Chất nào sau đây không bay hơi ở điều kiện thường do có nhiệt độ sôi rất cao (337 °C)? A. H2O. B. HNO3. C. NH3. D. H2SO4. Phương pháp giải: Tính chất vật lí của sulfuric acid: chất lỏng sánh như dầu, không màu, khô Lời giải chi tiết: H2SO4 không bay hơi ở điều kiện thưởng do có nhiệt độ sôi rất cao (337 °C). → Chọn D. 8.4 Quá trình pha loãng dung dịch đậm đặc của acid nào sau đây toả rất nhiều nhiệt nên không được tự ý pha loãng? A. HCl. B. H2SO4. C. CH3COOH. D. HNO3. Phương pháp giải: Sulfuric acid tan vô hạn trong nước và toả rất nhiều nhiệt. Lời giải chi tiết: Quá trình pha loãng dung dịch đậm đặc của acid H2SO4 toả rất nhiều nhiệt nên không được tự ý pha loãng. → Chọn B. 8.5 Ở thể lỏng, chất nào sau đây có dạng sánh như dầu do tồn tại liên kết hydrogen rất mạnh giữa các phân tử? A. HF. B. H2SO4. C. H2O. D. CH3COOH. Phương pháp giải: Tính chất vật lí của sulfuric acid: chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp hai lần nước (H2SO4 98% có khối lượng riêng là 1,84 g/mL). Lời giải chi tiết: Ở thể lỏng, H2SO4 có dạng sánh như dầu do tồn tại liên kết hydrogen rất mạnh giữa các phân tử. → Chọn B. 8.6 Bước sơ cứu đầu tiên cần làm ngay khi một người bị bỏng sulfuric acid là A. rửa với nước lạnh nhiều lần. B. trung hoà acid bằng NaHCO3. C. băng bó tạm thời vết bỏng. D. đưa đến cơ sở y tế gần nhất. Phương pháp giải: Khi bị bỏng sulfuric acid cần thực hiện sơ cứu theo các bước: (1) Nhanh chống rửa ngay với nước lạnh nhiều lần để làm giảm lượng aicd bám trên da . (2) Sau khi ngâm rửa bằng nước, cần tiến hành trung hoà acid bằng dung dịch NaHCO3 loãng. (3) Băng bó tạm thời vết bỏng bằng băng sạch, cho người bị bỏng uống bù nước điện giải rồi đưa đến cở sở y tế gần nhất. Lời giải chi tiết: Bước sơ cứu đầu tiên cần làm ngay khi một người bị bỏng sulfuric acid là rửa với nước lạnh nhiều lần. → Chọn A. 8.7 Trong công nghiệp, hydrogen fluoride được điều chế từ quặng fluorite theo phản ứng: Vai trò của sulfuric acid trong phản ứng là A. base. B. chất oxi hoá. C. acid. D. chất khử. Phương pháp giải: Muối + Acid → Muối mới + Acid mới. Điều kiện để xảy ra phản ứng: các chất mới tạo thành phải thỏa mãn một trong hai điều kiện (hoặc cả hai điều kiện): + Acid mới yếu hơn hoặc dễ bay hơi hơn acid ban đầu. + Muối mới kết tủa. Lời giải chi tiết: Vai trò của sulfuric acid trong phản ứng là acid. → Chọn C. 8.8 Sulfuric acid đặc thể hiện tính chất nào khi lấy nước từ hợp chất carbohydrate và khiến chúng hoá đen? A. Tính acid. B. Tính base. C. Tính háo nước. D. Tính dễ tan. Phương pháp giải: Tính háo nước: Dung dịch sulfuric acid đặc có khả năng lấy nước từ hợp chất carbohydrate và khiến chúng hoá đen (hiện tượng than hoá).
Lời giải chi tiết: Sulfuric acid đặc thể hiện tính háo nước khi lấy nước từ hợp chất carbohydrate và khiến chúng hoá đen. → Chọn C. 8.9 Phân biệt được dung dịch Na2SO4 và NaCl bằng dung dịch nào sau đây? A. MgCl2. B. FeCl2. C. HCl. D. BaCl2. Phương pháp giải: Ion \[{\rm{SO}}_{\rm{4}}^{{\rm{2 - }}}\]được nhận biết nhờ phản ứng với ion Ba2+ tạo kết tủa BaSO4 màu trắng. Kết tủa này không tan trong dung dịch acid và base. Lời giải chi tiết: Phân biệt được dung dịch Na2SO4 và NaCl bằng dung dịch BaCl2.
Phương trình hóa học: \(\;{\rm{BaC}}{{\rm{l}}_{\rm{2}}}{\rm{\;}} + {\rm{ N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}}\; \downarrow + {\rm{ }}2{\rm{NaCl}}\) → Chọn D. 8.10 Muối X không tan trong nước và các dung môi hữu cơ. Trong y học, X thưởng được dùng làm chất cản quang trong xét nghiệm X-quang đường tiêu hoá. Công thức của X là A. BaSO4. B. Na2SO4. C. K2SO4. D. MgSO4. Phương pháp giải: BaSO4 không tan trong nước, dung dịch acid và base và dung môi hữu cơ. Ứng dụng trong y tế:là thành phần chính của thuốc cản quang trong kĩ thuật chụp X-quang. Lời giải chi tiết: Công thức của X là BaSO4. → Chọn A. 8.11 Trong công nghiệp sản xuất sulfuric acid, hai nguồn nguyên liệu được khai thác từ mỏ để cung cấp nguyên tố lưu huỳnh là A. ZnS, PbS. B. H2S, SO2. C. CaSO4, BaSO4. D. S, FeS2. Phương pháp giải: Trong công nghiệp, sulfuric acid được sản xuất trong công nghiệp bằng phương pháp tiếp xúc, nguyên liệu chính là sulfur, quặng pyrite (chứa FeS2) Lời giải chi tiết: Trong công nghiệp sản xuất sulfuric acid, hai nguồn nguyên liệu được khai thác từ mỏ để cung cấp nguyên tố lưu huỳnh là S, FeS2. → Chọn D. 8.12 Khi trộn dung dịch Na2SO4 với dung dịch BaCl2 phản ứng thực chất xảy ra trong dung dịch là A. \({\rm{B}}{{\rm{a}}^{2 + }} + {\rm{SO}}_4^{2 - } \to {\rm{BaS}}{{\rm{O}}_4}.\) B. \({\rm{N}}{{\rm{a}}^ + } + {\rm{C}}{{\rm{l}}^ - } \to {\rm{NaCl}}{\rm{.}}\) C. \({\rm{B}}{{\rm{a}}^{2 + }} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} + 2{\rm{N}}{{\rm{a}}^ + }.\) D. \({\rm{BaC}}{{\rm{l}}_2} + {\rm{SO}}_4^{2 - } \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} + 2{\rm{C}}{{\rm{l}}^ - }.\) Phương pháp giải: - Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li. - Cách chuyển phương trình dưới dạng phân tử thành phương trình ion rút gọn: + Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử. Ta thu được phương trình ion đầy đủ. + Lược bỏ những ion không tham gia phản ứng, ta được phương trình ion rút gọn. Lời giải chi tiết: Khi trộn dung dịch Na2SO4 với dung dịch BaCl2 phản ứng thực chất xảy ra trong dung dịch là \({\rm{B}}{{\rm{a}}^{2 + }} + {\rm{SO}}_4^{2 - } \to {\rm{BaS}}{{\rm{O}}_4}.\] → Chọn A. 8.13
Phương pháp giải: Phản ứng oxi hóa khử là phản ứng xảy ra đồng thời quá trình oxi hoá và quá trình khử. Lời giải chi tiết:
8.14
Phương pháp giải: \({\Delta _r}H_{298}^0 = \sum {\Delta _f}H_{298}^0(sp) - \sum {\Delta _f}H_{298}^0(cd)\) Nhiệt tạo thành của đơn chất bằng 0. Lời giải chi tiết: \(\begin{array}{l}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = 2{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(S}}{{\rm{O}}_3}) - 2{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(S}}{{\rm{O}}_2})\\{\rm{ = 2}} \times {\rm{(}} - 395,7) - 2 \times ( - 296,8)\\{\rm{ = }} - {\rm{197,8 (kJ)}}\end{array}\) → Chọn B. 8.15 Cho dung dịch sulfuric acid đặc tác dụng với từng chất rắn sau: NaCl, NaBr, Nal, NaHCO3 ở nhiệt độ thường. Số phản ứng trong đó sulfuric acid đóng vai trò chất oxi hoá là A. 2. B. 4. C. 1. D. 3. Phương pháp giải: Sulfuric acid đóng vai trò chất oxi hoá khi phản ứng với các chất có tính khử. Lời giải chi tiết: Ion \({\rm{B}}{{\rm{r}}^ - },{{\rm{I}}^ - }\)có tính khử mạnh. Do đó, khi dung dịch sulfuric acid đặc tác dụng với NaBr và Nal, sulfuric acid đóng vai trò chất oxi hoá. \(\begin{array}{l}{\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2NaBr }} \to {\rm{ N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + B}}{{\rm{r}}_{\rm{2}}}{\rm{ + S}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\\{\rm{5}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + 8NaI }} \to {\rm{ 4N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + 4}}{{\rm{I}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{S + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\end{array}\) → Chọn A. 8.16 Cho các hợp chất carbohydrate sau: đường glucose, đường saccharose, bông, bột gỗ. Số hợp chất có khả năng bị hóa đen khi tiếp xúc với sulfuric acid đặc là A. 1. B. 2. C. 3. D. 4. Phương pháp giải: Tính háo nước: Dung dịch sulfuric acid đặc có khả năng lấy nước từ hợp chất carbohydrate và khiến chúng hoá đen (hiện tượng than hoá). Lời giải chi tiết: Đường glucose, đường saccharose, bông, bột gỗ đều thuộc hợp chất carbohydrate, khi tiếp xúc với sulfuric acid đặc đều bị hóa đen. → Chọn D. 8.17 Trong công nghiệp sản xuất sulfuric acid, sulfur trioxide được hấp thụ vào dung dịch sulfuric acid đặc tạo thành những hợp chất có công thức chung là A. H2S2O7. B. H2SO4. C. H2SO4.nSO3. D. (SO3)n. Phương pháp giải: Quá trình sản xuất sulfuric acid theo phương pháp tiếp xúc gồm 3 giai đoạn. Sulfur trioxide được hấp thụ vào dung dịch sulfuric acid đặc thuộc giai đoạn 3: \(\begin{array}{l}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + nS}}{{\rm{O}}_{\rm{3}}} \to {{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{.nS}}{{\rm{O}}_{\rm{3}}}\\{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{.nS}}{{\rm{O}}_{\rm{3}}} + {\rm{n}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{(n + 1)}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\end{array}\) Lời giải chi tiết: Trong công nghiệp sản xuất sulfuric acid, sulfur trioxide được hấp thụ vào dung dịch sulfuric acid đặc tạo thành oleum có công thức H2SO4.nSO3. → Chọn C. 8.18 Cho các nguyên liệu sau: sulfur, quặng pyrite (FeS2), không khí, nước, vanadium(V) oxide (V2O5). Số nguyên liệu được sử dụng trong công nghiệp sản xuất sulfuric acid là A. 4. B. 2. C. 5. D. 3. Phương pháp giải:
Lời giải chi tiết: Các nguyên liệu được sử dụng trong công nghiệp sản xuất sulfuric acid: sulfur, quặng pyrite (FeS2), không khí, nước, vanadium(V) oxide (V2O5). → Chọn C. 8.19 Kết quả phân tích thành phần một muối sulfate cho thấy nguyên tố kim loại M chiếm 28% về khối lượng, còn lại là oxygen và lưu huỳnh. Kim loại M là A. Fe. B. Cu. C. Mg. D. Ca. Phương pháp giải: Với hợp chất AxBy, ta có: \({\rm{\% A = }}\frac{{{\rm{x}}{{\rm{M}}_{\rm{A}}}}}{{{{\rm{M}}_{{{\rm{A}}_{\rm{x}}}{\rm{B}}}}_{_{\rm{y}}}}}{\rm{ }}{\rm{. 100\% }}\) Lời giải chi tiết: Gọi công thức của muối sulfate là M2(SO4)n. Ta có: kim loại M chiếm 28% về khối lượng muối sulfate \(\begin{array}{l} \Rightarrow \% {\rm{M}} = 28\% \\ \Leftrightarrow \frac{{{\rm{2M}}}}{{{{\rm{M}}_{{{\rm{M}}_{\rm{2}}}{{\left( {{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right)}_{\rm{n}}}}}}} \times 100\% = 28\% \\ \Leftrightarrow \frac{{{\rm{2M}}}}{{{\rm{2M + 96n}}}} = 0,28\\ \Leftrightarrow 1,44{\rm{M}} = 26,88{\rm{n}}\\ \Rightarrow {\rm{M}} = \frac{{26,88{\rm{n}}}}{{1,44}}\end{array}\) Vì M là kim loại nên hóa trị của M có thể là I, II, III.
Chọn n = 3; M = 56. \( \Rightarrow \)Kim loại M là Fe. → Chọn A. 8.20 Hoà tan hết m gam oxide của kim loại M (hoá trị II) vào dung dịch H2SO4 loãng, thu được 3m gam muối sulfate. Công thức của oxide kim loại là A. ZnO. B. CuO. C. CaO. D. MgO. Phương pháp giải: Lập tỉ lệ, sử dụng phương pháp bảo toàn nguyên tố để tìm M của kim loại. Lời giải chi tiết: Kim loại M có hóa trị II, do đó công thức của oxide và muối sulfate của kim loại M lần lượt là: MO, MSO4. Giả sử: \({{\rm{n}}_{{\rm{MO}}}} = {\rm{ x (mol)}}\) Bảo toàn nguyên tố M, ta có: \({{\rm{n}}_{{\rm{MS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}{{\rm{n}}_{{\rm{MO}}}} = {\rm{ x (mol)}}\) \( \Rightarrow {{\rm{m}}_{{\rm{MO}}}} = {\rm{m}} = {\rm{ (M + 16)x (gam); }}{{\rm{m}}_{{\rm{MS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = 3m = (M + 96)x (gam)}}\) Xét tỉ lệ: \(\frac{{{{\rm{m}}_{{\rm{MO}}}}}}{{{{\rm{m}}_{{\rm{MS}}{{\rm{O}}_{\rm{4}}}}}}} = \frac{{\rm{m}}}{{{\rm{3m}}}} \Leftrightarrow \frac{{{\rm{(M + 16)x}}}}{{{\rm{(M + 96)x}}}} = \frac{1}{3} \Leftrightarrow \frac{{{\rm{M + 16}}}}{{{\rm{M + 96}}}} = \frac{1}{3} \Rightarrow {\rm{M}} = 24{\rm{ (g/mol)}}\) M là Magnesium (Mg). Công thức của oxide kim loại là MgO. → Chọn D. 8.21 Cho vào hai ống nghiệm, mỗi ống 20,00 mL dung dịch X gồm các ion sau: và . Cho dung dịch NaOH dư vào ống nghiệm thứ nhất, đun nóng, thu được 0,116 g kết tủa và 49,58 mL khí (đkc). Cho dung dịch BaCl2 dư vào ống nghiệm thứ hai, thu được 0,233 g kết tủa. Xác định nồng độ mol mỗi loại ion trong dung dịch X. Phương pháp giải: Các kết tủa thu được khi cho NaOH và BaCl2 vào hai ống nghiệm là Mg(OH)2 và BaSO4, khí NH3. Áp dụng định luật bảo toàn điện tích để tìm nồng độ mol mỗi loại ion trong dung dịch X. Lời giải chi tiết: +) Xét ống nghiệm thứ nhất: Khi cho dung dịch NaOH dư vào ống nghiệm thu được kết tủa là Mg(OH)2, khí là NH3. \({\rm{M}}{{\rm{g}}^{2 + }} + 2{\rm{O}}{{\rm{H}}^ - } \to {\rm{Mg(OH}}{{\rm{)}}_{\rm{2}}} \downarrow \) \({\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ - } \to {\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\) \({{\rm{n}}_{{\rm{Mg(OH}}{{\rm{)}}_{\rm{2}}}}} = \frac{{0,116}}{{58}} = 0,002{\rm{ (mol)}} \Rightarrow {{\rm{n}}_{{\rm{M}}{{\rm{g}}^{2 + }}}} = {{\rm{n}}_{{\rm{Mg(OH}}{{\rm{)}}_{\rm{2}}}}} = 0,002{\rm{ (mol)}}\); \({{\rm{n}}_{{\rm{N}}{{\rm{H}}_{\rm{3}}}}} = \frac{{0,04958}}{{24,79}} = 0,002{\rm{ (mol)}} \Rightarrow {{\rm{n}}_{{\rm{NH}}_4^ + }} = {{\rm{n}}_{{\rm{N}}{{\rm{H}}_{\rm{3}}}}} = 0,002{\rm{ (mol)}}\) +) Xét ống nghiệm thứ hai: Khi cho dung dịch BaCl2 dư vào ống nghiệm thu được kết tủa là BaSO4. \({\rm{B}}{{\rm{a}}^{2 + }} + {\rm{SO}}_4^{2 - } \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}}\) \({{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}} = \frac{{0,233}}{{233}} = 0,001{\rm{ (mol)}} \Rightarrow {{\rm{n}}_{{\rm{SO}}_4^{2 - }}} = {{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}} = 0,001{\rm{ (mol)}}\) Áp dụng định luật bảo toàn điện tích trong dung dịch X: \(\begin{array}{l}{\rm{2}}{{\rm{n}}_{{\rm{M}}{{\rm{g}}^{2 + }}}} + {{\rm{n}}_{{\rm{NH}}_4^ + }} = {\rm{2}}{{\rm{n}}_{{\rm{SO}}_4^{2 - }}} + {{\rm{n}}_{{\rm{C}}{{\rm{l}}^ - }}}\\ \Rightarrow {{\rm{n}}_{{\rm{C}}{{\rm{l}}^ - }}} = {\rm{2}}{{\rm{n}}_{{\rm{M}}{{\rm{g}}^{2 + }}}} + {{\rm{n}}_{{\rm{NH}}_4^ + }} - {\rm{2}}{{\rm{n}}_{{\rm{SO}}_4^{2 - }}}\\{\rm{ = 2}} \times {\rm{0,002 + 0,002 - 2}} \times 0,001 = 0,004{\rm{ (mol)}}\\ \Rightarrow [{\rm{M}}{{\rm{g}}^{2 + }}] = [{\rm{NH}}_4^ + ] = \frac{{0,002}}{{0,02}} = 0,1{\rm{ (M); }}\\{\rm{[C}}{{\rm{l}}^ - }{\rm{] = }}\frac{{0,004}}{{0,02}}{\rm{ = 0,2 (M); [SO}}_4^{2 - }{\rm{] = }}\frac{{0,001}}{{0,02}}{\rm{ = 0,05 (M)}}{\rm{.}}\end{array}\) 8.22 Trong công nghiệp, copper(II) sulfate được sản xuất bằng cách ngâm đồng phế liệu trong sulfuric acid loãng và sục không khí: Cu + O2 + H2SO4 (loãng) → CuSO4 + H2O (1) a) Lập phương trình hoá học của phản ứng (1). b) Tại sao thực tế không sản xuất CuSO4 từ đồng phế liệu theo sơ đồ phản ứng: Cu + H2SO4 (đặc) \[ \to \] CuSO4 +SO2 + H2O (2) Phương pháp giải: a) Cân bằng phương trình oxi hóa khử (1). b) Xét đến các yếu tố: tỉ lệ mol giữa CuSO4 và H2SO4, nhiệt độ và khí thải ra môi trường Lời giải chi tiết: a) 2Cu + O2 + 2H2SO4 (loãng) → 2CuSO4 + 2H2O (1) b) Đồng phế liệu tác dụng với sulfuric acid đặc, nóng theo phản ứng: Cu + 2H2SO4 (đặc) \( \to \) CuSO4 +SO2 + 2H2O (2)
Thực tế không sản xuất CuSO4 từ đồng phế liệu theo sơ đồ (2) vì so với sơ đồ (1) lượng acid tiêu thụ ở sơ đồ (2) là gấp đôi, tốn nhiệt và phát thải khí SO2 gây ô nhiễm. 8.23 Sulfur dioxide là một trong các tác nhân gây mưa acid, phát thải chủ yếu từ các quá trình đốt cháy nhiên liệu như than đá, xăng, dầu,... Một nhà máy nhiệt điện than sử dụng hết 6 000 tấn than đá/ngày, có thành phần chứa 0,8% lưu huỳnh về khối lượng để làm nhiên liệu. a) Tính thể tích khí SO2 (đkc) tối đa do nhà máy tạo ra trong một ngày. b) Giả thiết có 1% lượng khí SO2 tạo ra khuếch tán vào khí quyển rồi bị chuyển hoá thành sulfuric acid trong nước mưa theo sơ đồ: Tính thể tích nước mưa bị nhiễm acid, giả thiết nồng độ sulfuric acid trong nước mưa là 1.10-5 M. Phương pháp giải: a) Tính thể tích khí theo công thức: \({\rm{V}} = {\rm{n}} \times 24,79\) b) Tính thể tích nước mưa bị nhiễm acid theo công thức: \({\rm{V}} = \frac{{\rm{n}}}{{{{\rm{C}}_{\rm{M}}}}}\) Lời giải chi tiết:
8.24 Trong sản xuất phân bón, surpephosphate kép chứa thành phần dinh dưỡng là Ca(H2PO4)2, được sản xuất từ quặng phosphorite theo hai giai đoạn sau: Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4 Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2 Để sản xuất được 1 tấn Ca(H2PO4)2 với hiệu suất của cả quá trình là 80% thì cần bao nhiêu tấn dung dịch H2SO4 70%? Phương pháp giải: Tính số mol H2SO4 thông qua Ca(H2PO4)2, rồi tính số mol H2SO4 được dùng trong thực tế theo công thức: \({{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ (TT)}}}}{\rm{ = }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ (LT)}}}} \times \frac{{{\rm{100}}}}{{\rm{H}}}\). Tính khối lượng dung dịch H2SO4 theo công thức: \({{\rm{m}}_{{\rm{dd }}}}{\rm{ = }}{{\rm{m}}_{{\rm{ct}}}} \times \frac{{100\% }}{{{\rm{C}}\% }}\). Lời giải chi tiết: Ta có: \({{\rm{n}}_{{\rm{Ca}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}} \right)}_{\rm{2}}}}} = \frac{{{{10}^6}}}{{234}} \approx 4273,5{\rm{ (mol)}}\) Xét phương trình: Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2 \({{\rm{n}}_{{{\rm{H}}_{\rm{3}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}\frac{4}{3}{{\rm{n}}_{{\rm{Ca}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}} \right)}_{\rm{2}}}}} = \frac{4}{3} \times 4273,5 = 5698{\rm{ (mol)}}\) Xét phương trình: Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4 \({{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}\frac{3}{2}{{\rm{n}}_{{{\rm{H}}_{\rm{3}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}\frac{3}{2} \times 5698 = 8547{\rm{ (mol)}}\) Vì hiệu suất của cả quá trình là 80% nên\({{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ (TT)}}}}{\rm{ = }}8547 \times \frac{{100}}{{80}}{\rm{ = 10683,75 (mol)}}\) \({{\rm{m}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ (TT)}}}}{\rm{ = 10683,75}} \times {\rm{98 = 1047007,5 (g)}}\) Khối lượng dung dịch H2SO4 70%: \({{\rm{m}}_{{\rm{dd }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = 1047007,5}} \times \frac{{100}}{{70}}{\rm{ = 1495725 (g) }} \approx {\rm{ 1,5}}\)(tấn).
|














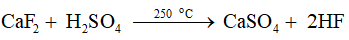











Danh sách bình luận