Bài 12. Công thức phân tử hợp chất hữu cơ trang 45, 46, 47 SBT Hóa 11 Kết nối tri thứcCông thức phân tử cho biết thông tin nào sau đây về phân tử hợp chất hữu cơ? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
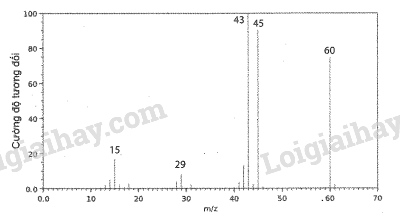
12.1 Công thức phân tử cho biết thông tin nào sau đây về phân tử hợp chất hữu cơ? A. Thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố. B. Thành phần nguyên tố và tỉ lệ số lượng nguyên tử của mỗi nguyên tố. C. Số lượng nguyên tử mỗi nguyên tố và trật tự liên kết giữa các nguyên tử. D. Tỉ lệ số lượng nguyên tử của mỗi nguyên tố và trật tự liên kết giữa các nguyên tử. Phương pháp giải: Công thức phân tử cho biết thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố trong phân tử. Lời giải chi tiết: Công thức phân tử cho biết thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố trong phân tử. → Chọn A. 12.2 Công thức nào sau đây là công thức phân tử của acetic acid? A. CH3-COOH. B. C2H4O2. C. CH2O. D. CxHyOz. Phương pháp giải: Công thức phân tử cho biết thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố trong phân tử. Lời giải chi tiết: Acetic acid có công thức cấu tạo là CH3-COOH. Công thức phân tử của acetic acid là C2H4O2. → Chọn B. 12.3 Công thức phân tử của methyl formate và glucose lần lượt là C2H4O2 và C6H12O6. Công thức đơn giản nhất của hai chất này là A. CH2O. B. C2H4O2. C. C4H8O4. D. C6H12O6. Phương pháp giải: Công thức đơn giản nhất cho biết tỉ lệ số nguyên tử của các nguyên tố có trong phân tử hợp chất hữu cơ (tỉ lệ các số nguyên tối giản). Lời giải chi tiết: Xét tỉ lệ số nguyên tử của các nguyên tố có trong methyl formate (C2H4O2): \(2:4:2 = 1:2:1\) Xét tỉ lệ số nguyên tử của các nguyên tố có trong glucose (C6H12O6): \(6:12:6 = 1:2:1\) \( \Rightarrow \) Công thức đơn giản nhất của methyl formate và glucose là CH2O. → Chọn A. 12.4 Trong phương pháp phổ khối lượng, đối với các hợp chất đơn giản, thường mảnh có giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] và giá trị này bằng giá trị ...... của chất nghiên cứu. Cụm từ thích hợp điền vào chỗ trống là. A. phân tử khối. B. nguyên tử khối. C. điện tích ion. D. khối lượng. Phương pháp giải: Phương pháp phổ khối lượng được sử dụng để xác định khối lượng phân tử các hợp chất hữu cơ. Trong máy khối phổ, chất nghiên cứu bị bắn phá bởi một dòng electron tạo ra các mảnh ion. Mảnh ion [M+] được gọi là mảnh ion phân tử. Giá trị m/z của mỗi mảnh ion và hàm lượng tương đối của chúng được thể hiện trên phổ khối lượng. Đối với các hợp chất đơn giản, thường mảnh có giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] và giá trị này bằng giá trị phân tử khối của chất nghiên cứu. Lời giải chi tiết: Trong phương pháp phổ khối lượng, đối với các hợp chất đơn giản, thường mảnh có giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] và giá trị này bằng giá trị phân tử khối của chất nghiên cứu. → Chọn A. 12.5 Hình sau đây là phổ khối lượng của phân tử acetic acid.
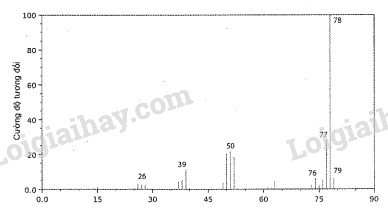
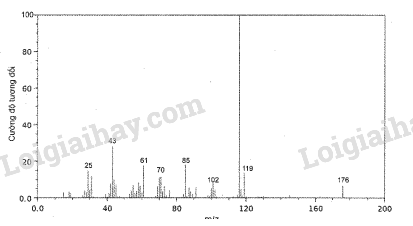
Phân tử khối của acetic acid bằng A. 43. B. 45. C. 60. D. 29. Phương pháp giải: Trong phương pháp phổ khối lượng, đối với các hợp chất đơn giản, thường mảnh có giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] và giá trị này bằng giá trị phân tử khối của chất nghiên cứu. Lời giải chi tiết: Dựa vào phổ khối lượng của phân tử acetic acid, ta thấy giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] là 60, do đó phân tử khối của acetic acid bằng 60. → Chọn C. 12.6 Hình sau đây là phổ khối lượng của phân tử benzene. Phân tử khối của benzene bằng A. 76. B. 77. C. 78. D. 79. Phương pháp giải: Trong phương pháp phổ khối lượng, đối với các hợp chất đơn giản, thường mảnh có giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] và giá trị này bằng giá trị phân tử khối của chất nghiên cứu. Lời giải chi tiết: Dựa vào phổ khối lượng của phân tử benzene, ta thấy giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] là 60, do đó phân tử khối của benzene bằng 78. → Chọn C. 12.7 Một hợp chất hữu cơ A chứa 32% C, 4% H và 64% O về khối lượng. Biết một phân tử A có 6 nguyên tử oxygen, công thức phân tử của A là A. C2H3O3. B. C4H6O6. C. C6H12O6. D. C6H4O6. Phương pháp giải: Thiết lập công thức phân tử hợp chất hữu cơ (CxHyOzNt) từ phân tử khối (M) được khái quát như sau: \({\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{O}}}}}{{{\rm{16}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; t = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{N}}}}}{{{\rm{14}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}\) Với x, y, z, t lần lượt là số nguyên tử C, số nguyên tử H, số nguyên tử O, số nguyên tử N; %mC, %mH, %mO, %mN lần lượt là % khối lượng của các nguyên tố C, H, O, N trong hợp chất hữu cơ. Lời giải chi tiết: Ta có: \({\rm{\% }}{{\rm{m}}_{\rm{O}}} = 64\% \Leftrightarrow \frac{{6 \times 16}}{{{{\mathop{\rm M}\nolimits} _A}}} \times 100\% = 64\% \Rightarrow {{\mathop{\rm M}\nolimits} _A} = 150{\rm{ (g/mol)}}\) Gọi công thức phân tử của A là CxHyO6. \(\begin{array}{l}{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{{\rm{32}}}}{{{\rm{12}}}} \times \frac{{150}}{{{\rm{100}}}} = 4\\{\rm{y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{4}{{\rm{1}}} \times \frac{{150}}{{{\rm{100}}}} = 6\end{array}\) Vậy công thức phân tử của A là C4H6O6. → Chọn B. 12.8 Một hợp chất hữu cơ X chứa 37,5% C, 3,2% H và 59,3% F về khối lượng. Cho bay hơi 1,00 g chất này tại 90 oC với áp suất 0,50 bar thì thể tích thu được là 0,93 L. Xác định công thức phân tử của X. Phương pháp giải: Thiết lập công thức phân tử hợp chất hữu cơ (CxHyOzNt) từ phân tử khối (M) được khái quát như sau: \({\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{O}}}}}{{{\rm{16}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; t = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{N}}}}}{{{\rm{14}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}\) Với x, y, z, t lần lượt là số nguyên tử C, số nguyên tử H, số nguyên tử O, số nguyên tử N; %mC, %mH, %mO, %mN lần lượt là % khối lượng của các nguyên tố C, H, O, N trong hợp chất hữu cơ. Lời giải chi tiết: Tại 90 oC với áp suất 0,50 bar thì số mol của 0,93 L khí X là \({{\rm{n}}_{\rm{X}}} = \frac{{{\rm{P}}{\rm{.V}}}}{{{\rm{R}}{\rm{.T}}}} = \frac{{0,5.1.0.93}}{{0.082.(90 + 273)}} \approx 0,0156{\rm{ }}({\rm{mol}})\) \({{\rm{M}}_{\rm{X}}} = \frac{1}{{0.0156}} \approx {\rm{64 }}({\rm{g/mol}})\) Gọi công thức phân tử của X là CxHyFz. \(\begin{array}{l}{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}} = \frac{{37,5}}{{12}} \times \frac{{64}}{{100}} = 2\\{\rm{y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}} = \frac{{3,2}}{1} \times \frac{{64}}{{100}} \approx 2\\{\rm{z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{F}}}}}{{{\rm{19}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}} = \frac{{59,3}}{{19}} \times \frac{{64}}{{100}} \approx 2\end{array}\) Vậy công thức phân tử của X là C2H2F2. 12.9 Vitamin C (ascorbic acid) chứa 40,92% C, 4,58% H và 54,50% O về khối lượng. Hình sau đây là phổ khối lượng của ascorbic acid: Xác định công thức thực nghiệm và công thức phân tử của ascorbic acid. Phương pháp giải: Có thể dự đoán phân tử khối của hợp chất hữu cơ đơn giản bằng tín hiệu của mảnh ion phân tử (kí hiệu là [M+]). Mảnh ion phân tử này thường ứng với tín hiệu có giá trị m/z lớn nhất. Thiết lập công thức phân tử hợp chất hữu cơ (CxHyOzNt) từ dữ liệu phân tích nguyên tố và phân tử khối (M) được khái quát như sau: \({\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{O}}}}}{{{\rm{16}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; t = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{N}}}}}{{{\rm{14}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}\) Với x, y, z, t lần lượt là số nguyên tử C, số nguyên tử H, số nguyên tử O, số nguyên tử N; %mC, %mH, %mO, %mN lần lượt là % khối lượng của các nguyên tố C, H, O, N trong hợp chất hữu cơ. Lời giải chi tiết: Gọi công thức phân tử của ascorbic acid là CxHyOz. Từ phổ khối lượng của ascorbic acid, ta có: \({{\rm{M}}_{{\rm{ascorbic acid}}}} = 176\) \(\begin{array}{l}{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{40,92}}{{{\rm{12}}}} \times \frac{{176}}{{{\rm{100}}}} \approx 6\\{\rm{y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{4,58}}{{\rm{1}}} \times \frac{{176}}{{{\rm{100}}}} \approx 8\\{\rm{z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{O}}}}}{{{\rm{16}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{54,5}}{{{\rm{16}}}} \times \frac{{176}}{{{\rm{100}}}} \approx 6\end{array}\) Vậy công thức phân tử của ascorbic acid là C6H8O6. 12.10 Đốt cháy 20,63 mg hợp chất Y, chỉ chứa C, H và O, bằng lượng dư khí oxygen tạo 57,94 mg CO2 và 11,85 mg H2O. a) Tính khối lượng (theo mg) của C, H và O trong hợp chất Y. b) Xác định công thức thực nghiệm của Y. c) Dựa trên phổ khối lượng của Y như hình cho dưới đây, xác định công thức phân tử của Y. Phương pháp giải: Một hợp chất hữu cơ có công thức phân tử là CxHyOz. Thiết lập công thức đơn giản nhất bằng cách lập tỉ lệ x : y : z ở dạng số nguyên tối giản p : q : r. Lập tỉ lệ mol của các nguyên tố \({\rm{x}}:{\mathop{\rm y}\nolimits} :{\rm{z}} = {{\rm{n}}_{\rm{C}}}:{{\rm{n}}_{\rm{H}}}:{{\rm{n}}_{\rm{O}}} = {\rm{p}}:{\rm{q}}:{\rm{r}}\) Từ đó thiết lập được công thức đơn giản nhất: CpHqOr. Mối quan hệ giữa công thức phân tử và công thức đơn giản nhất: CxHyOz = (CpHqOr)n Trong đó: p, q, r là các số nguyên tối giản; x, y, z, n là các số nguyên dương. Khi biết phân tử khối, xác định được giá trị n, từ đó suy ra công thức phân tử. Lời giải chi tiết: a) Bảo toàn nguyên tố C: \({{\rm{n}}_{\rm{C}}} = {{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}} \Rightarrow {{\rm{m}}_{\rm{C}}} = \frac{{57,94}}{{44}} \times 12 \approx 15,81{\rm{ (mg)}}\) Bảo toàn nguyên tố H: \({{\rm{n}}_{\rm{H}}} = 2{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}} \Rightarrow {{\rm{m}}_{\rm{H}}} = 2 \times \frac{{11,85}}{{18}} \times 1 \approx 1,317{\rm{ (mg)}}\) \( \Rightarrow {{\rm{m}}_{\rm{O}}} = {{\rm{m}}_{\rm{Y}}} - ({{\rm{m}}_{\rm{C}}} + {{\rm{m}}_{\rm{H}}}) = 20,63 - (15,81 + 1,317) = 3,503{\rm{ (mg)}}\) b) Ta có tỉ lệ mol của các nguyên tố: \(\frac{{15,81}}{{12}}:\frac{{1,371}}{1}:\frac{{3,503}}{{16}} = 1,318:1,371:0,219 = 6:6:1\) Vậy công thức thực nghiệm của Y là C6H6O. c) Từ phổ khối lượng của Y, ta có: \({{\rm{M}}_{\rm{Y}}} = 94\) \(\begin{array}{l} \Leftrightarrow {{\rm{M}}_{{{\left( {{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{6}}}{\rm{O}}} \right)}_{\rm{n}}}}} = 94\\ \Leftrightarrow (12 \times 6 + 1 \times 6 + 16) \times {\rm{n}} = 94\\ \Rightarrow {\rm{n}} = \frac{{94}}{{94}} = 1\end{array}\) Vậy công thức phân tử của Y là C6H6O.
|




















Danh sách bình luận