Bài 3. Nguyên tố hóa học trang 7, 8, 9 SBT Hóa 10 Cánh diềuĐồng vị là những nguyên tử của cùng một nguyên tố hóa học, nhưng khác nhau về Nguyên tử khối trung bình của hydrogen bằng 1,008. Hãy cho biết đồng vị nào của hydrogen chiếm tỉ lệ nhiều nhất trong tự nhiên. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 7 3.1 Đồng vị là những nguyên tử của cùng một nguyên tố hóa học, nhưng khác nhau về A. tính chất hóa học. B. khối lượng nguyên tử. C. số proton. D. số electron. Phương pháp giải: Dựa vào định nghĩa của đồng vị: Đồng vị là những nguyên tử của cùng một nguyên tố hóa học, nhưng khác nhau về khối lượng nguyên tử. Lời giải chi tiết: - Đáp án: B - Giải thích: Do khối lượng nguyên tử = số p + số n mà các đồng vị khác nhau về số neutron → khối lượng nguyên tử khác nhau CH tr 7 3.2 Trong tự nhiên, hydrogen có ba đồng vị (\({}_1^1H\);\({}_1^1H\);\({}_1^1H\)). Nguyên tử khối trung bình của hydrogen bằng 1,008. Hãy cho biết đồng vị nào của hydrogen chiếm tỉ lệ nhiều nhất trong tự nhiên. A. \({}_1^1H\). B. \({}_1^2H\). C. \({}_1^3H\). D. Không thể xác định được. Phương pháp giải: Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố X: \(\overline {{A_X}} = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\) Trong đó: + \(\overline {{A_X}} \)là nguyên tử khối trung bình của X + Ai là nguyên tử khối đồng vị thứ i + ai là tỉ lệ % số nguyên tử đồng vị thứ i Lời giải chi tiết: - Có nguyên tử khối trung bình của hydrogen là: \(\overline {{A_H}} = \frac{{{a_1}.1 + {a_2}.2 + {a_3}.3}}{{100}} = 1,008\) → Đồng vị \({}_1^1H\) chiếm tỉ lệ nhiều nhất trong tự nhiên do 1,008 ≈ 1 → Đáp án: A CH tr 7 3.3 Hãy nối các mô tả trong cột A với các kí hiệu đồng vị \({}_Z^AX\) trong cột B cho phù hợp.
Phương pháp giải: Dựa vào - Kí hiệu nguyên tử: \({}_Z^AX\) trong đó + X là kí hiệu nguyên tố hóa học + Z là số hiệu nguyên tử (= số proton) + A là số khối (= p + n) Lời giải chi tiết: 1. \({}_{29}^{65}Cu\) → số neutron = 65 - 29 = 36 2. \({}_{29}^{63}Cu → số neutron = 63 - 29 = 34 3. \({}_{18}^{40}Ar\) → số neutron = 40 - 18 = 22 4. \({}_{19}^{40}K\) → số neutron = 40 - 19 = 21 5. \({}_{19}^{39}K\) → số neutron = 39 - 19 = 20 → Đáp án: a - 2; b - 1; c - 4; d - 3 CH tr 8 3.4 Cặp nguyên tử nào sau đây có cùng số neutron? A. \({}_5^{11}B\) và \({}_6^{12}C\). B. \({}_3^7Li\) và \({}_4^9Be\). C. \({}_{12}^{24}Mg\) và \({}_{14}^{28}Si\). D. \({}_7^{14}N\) và \({}_8^{16}O\). Phương pháp giải: Dựa vào - Kí hiệu nguyên tử: \({}_Z^AX\) trong đó + X là kí hiệu nguyên tố hóa học + Z là số hiệu nguyên tử (= số proton) + A là số khối (= p + n) Lời giải chi tiết: A. - \({}_5^{11}B\) → số neutron = 11 - 5 = 6 - \({}_6^{12}C\) → số neutron = 12 - 6 = 6 B. - \({}_3^7Li\) → số neutron = 7 - 3 = 4 - \({}_4^9Be\) → số neutron = 9 - 4 = 5 C. - \({}_{12}^{24}Mg\) → số neutron = 24 - 12 = 12 - \({}_{14}^{28}Si\) → số neutron = 28 - 14 = 14 D. - \({}_7^{14}N\) → số neutron = 14 - 7 = 7 - \({}_8^{16}O\) → số neutron = 16 - 8 = 8 → Đáp án: A CH tr 8 3.5 Deuterium (D) là một đồng vị của hydrogen, được ứng dụng trong các lĩnh vực hạt nhân. Ion nào sau đây có số electron nhiều hơn số proton và số proton nhiều hơn số neutron (Biết H = \({}_1^1H\), D = \({}_1^2H\), O = \({}_8^{16}O\))? A. D-. B. H3O+. C. OD-. D. OH-. Phương pháp giải: Dựa vào - Kí hiệu nguyên tử: \({}_Z^AX\) trong đó + X là kí hiệu nguyên tố hóa học + Z là số hiệu nguyên tử (= số proton) + A là số khối (= p + n) - Số neutron và proton trong nguyên tử và ion của nguyên tử đó không thay đổi - Số electron trong nguyên tử và ion có sự thay đổi + Ion dương bao nhiêu thì số electron trong ion giảm đi bấy nhiêu so với số electron trong nguyên tử + Ion âm bao nhiêu thì số electron trong ion tăng lên bấy nhiêu so với số electron trong nguyên tử Lời giải chi tiết:
-> Đáp án: D CH tr 8 3.6 Phổ khối lượng của một mẫu lithium cho thấy nó chứa hai đồng vị là 6Li và 7Li với tỉ lệ phần trăm số nguyên tử của mỗi đồng vị lần lượt là 7,42% và 92,58%. Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hai chữ số thập phân) là A. 6,07. B. 6,50. C. 6,90. D. 6,93. Phương pháp giải: Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố X: \(\overline {{A_X}} = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\) Trong đó: + \(\overline {{A_X}} \)là nguyên tử khối trung bình của X + Ai là nguyên tử khối đồng vị thứ i + ai là tỉ lệ % số nguyên tử đồng vị thứ i Lời giải chi tiết: - Nguyên tử khối trung bình của Lithium là \(\overline {{A_{Li}}} = \frac{{7,42.6 + 92,58.7}}{{100}} = 6,93\) (amu) -> Đáp án: D CH tr 8 3.7 Neon có ba đồng vị bền trong tự nhiên. Tỉ lệ phần trăm số nguyên tử mỗi đồng vị được thể hiện trong bảng sau:
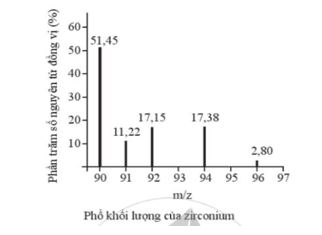
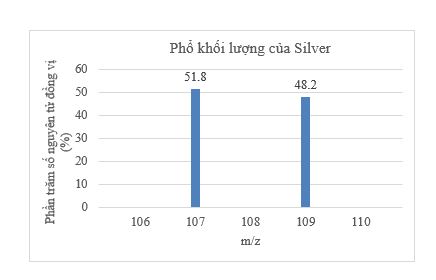
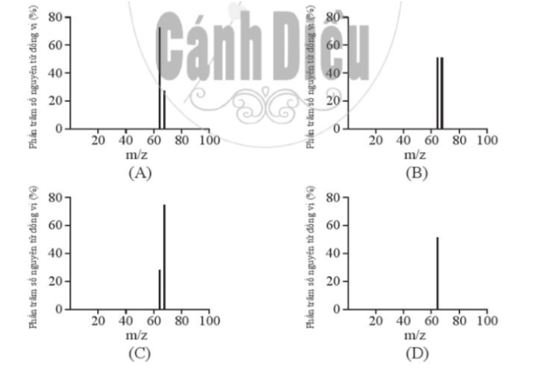
Biết rằng nguyên tử khối trung bình của Ne là 20,18. Giá trị số khối A của đồng vị đầu tiên là A. 19,00. B. 20,00. C. 20,01. D. Không xác định được. Phương pháp giải: Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố X: \(\overline {{A_X}} = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\) Trong đó: + \(\overline {{A_X}} \)là nguyên tử khối trung bình của X + Ai là nguyên tử khối đồng vị thứ i + ai là tỉ lệ % số nguyên tử đồng vị thứ i Lời giải chi tiết: - Nguyên tử khối trung bình của Neon là \(\overline {{A_{Ne}}} = \frac{{90,9.A + 0,3.21 + 8,8.22}}{{100}} = 20,18\) (amu) → A = 20,00 → Đáp án: B CH tr 8 3.8 Trong tự nhiên, carbon có hai đồng vị bền là 12C và 13C; oxygen có ba đồng vị bền là 16O; 17O và 18O. Số lượng tối đa loại phân tử CO2 có thể tạo ra từ các đồng vị này là A. 6. B. 9. C. 12. D. Vô số. Lời giải chi tiết: - Có 2 cách để chọn nguyên tử C trong phân tử CO2 là 12C hoặc 13C - Có 6 cách để chọn 2 nguyên tử O trong phân tử CO2 là: 16O-16O; 16O-17O; 16O-18O; 17O-17O; 17O-18O; 18O-18O → Có tổng cộng 2.6 = 12 cách tạo ra phân tử CO2 → Đáp án: C CH tr 8 3.9 Phổ khối lượng của zirconium được biểu diễn như hình sau đây (điện tích z của các đồng vị zirconium đều bằng 1+). Số lượng đồng vị bền và nguyên tử khối trung bình của zirconium là A. 5 đồng vị, nguyên tử khối trung bình bằng 92,60. B. 5 đồng vị, nguyên tử khối trung bình bằng 91,32. C. 4 đồng vị, nguyên tử khối trung bình bằng 91,18. D. 4 đồng vị, nguyên tử khối trung bình bằng 92,00. Phương pháp giải: Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố X: \(\overline {{A_X}} = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\) Trong đó: + \(\overline {{A_X}} \)là nguyên tử khối trung bình của X + Ai là nguyên tử khối đồng vị thứ i + ai là tỉ lệ % số nguyên tử đồng vị thứ i Lời giải chi tiết: - Quan sát phổ khối lượng của zirconium xác định được nguyên tố này có 5 đồng vị là 90Zr, 91Zr, 93Zr, 94Zr và 96Zr. - Nguyên tử khối trung bình của zirconium là \(\overline {{A_{Zr}}} = \frac{{51,45.90 + 11,22.91 + 17,15.92 + 17,38.94 + 2,80.96}}{{100}} = 91,318\) (amu) -> Đáp án: B CH tr 9 3.10 Bạc có hai đồng vị bền trong tự nhiên: 107Ag có hàm lượng tương đối là 51,8%; 109Ag có hàm lượng tương đối là 48,2%. Hãy vẽ phổ khối lượng của bạc và tính nguyên tử khối trung bình của Ag. Phương pháp giải: Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố X: \(\overline {{A_X}} = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\) Trong đó: + \(\overline {{A_X}} \)là nguyên tử khối trung bình của X + Ai là nguyên tử khối đồng vị thứ i + ai là tỉ lệ % số nguyên tử đồng vị thứ i Lời giải chi tiết: - Nguyên tử khối trung bình của silver là \(\overline {{A_{Ag}}} = \frac{{51,8.107 + 48,2.109}}{{100}} = 107,964\) (amu) - Phổ khối lượng của Ag: CH tr 9 3.11 Đồng có hai đồng vị bền trong tự nhiên là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,55 (điện tích z của các ion đồng vị đồng đều bằng 1+). Hình vẽ phổ khối nào dưới đây là đúng? Phương pháp giải: Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố X: \(\overline {{A_X}} = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\) Trong đó: + \(\overline {{A_X}} \)là nguyên tử khối trung bình của X + Ai là nguyên tử khối đồng vị thứ i + ai là tỉ lệ % số nguyên tử đồng vị thứ i Lời giải chi tiết: - Gọi % số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là x và y (%) - Nguyên tử khối trung bình của copper là \(\overline {{A_{Cu}}} = \frac{{x.63 + y.65}}{{100}} = 63,55\) (amu) (1) - Có x + y = 100 (2) -> Từ (1) và (2) giải hệ phương trình hai ẩn ta có x = 72,5% và y = 27,5% -> Đáp án: A CH tr 9 3.12 Đồng vị được sử dụng rộng rãi để nghiên cứu phản ứng hóa học. Cho biết vai trò của D (đồng vị \({}_1^2H\)) và T (đồng vị \({}_1^3H\)) là như nhau trong các phản ứng hóa học. Trong điều kiện thích hợp, xảy ra phản ứng sau: CH2=CH-CH2-CH2-CH=CHD ⇌ CH2=CH-CH2-CHD-CH=CH2 (1) Vậy cũng trong điều kiện đó, phản ứng sau đây có xảy ra không? CD2=CD-CD2-CD2-CD=CDT ⇌ CD2=CD-CD2-CDT-CD=CD2 (2) Phương pháp giải: Dựa vào đặc điểm của các đồng vị: - Các đồng vị có tính chất hoá học giống nhau. - Các đồng vị có tính chất vật lí khác nhau. - Các đồng vị có cùng số electron ở vỏ nguyên tử. - Các đồng vị có cùng số proton nhưng khác nhau về số khối Lời giải chi tiết: - Vì các đồng vị đều có tính chất hóa học giống nhau -> Phản ứng (2) có xảy ra vì vai trò của D và T là như nhau.
|




















Danh sách bình luận