Bài 9. Quy tắc octet trang 26, 27 SBT Hóa 10 Cánh diềuNguyên tử oxygen (Z = 8) có xu hướng nhường hay nhận bao nhiêu electron để đạt lớp vỏ thoả mãn quy tắc octet? Chọn phương án đúng. Nguyên tử lithium (Z = 3) có xu hướng nhường hay nhận bao nhiêu electron để lớp vỏ thoả mãn quy tắc octet? Chọn phương án đúng. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 26 9.1 Nguyên tử oxygen (Z = 8) có xu hướng nhường hay nhận bao nhiêu electron để đạt lớp vỏ thoả mãn quy tắc octet? Chọn phương án đúng. A. Nhường 6 electron. B. Nhận 2 electron. C. Nhường 8 electron. D. Nhận 6 electron. Phương pháp giải: - Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó + Nếu khí hiếm đứng trước nguyên tử của nguyên tố đang xét → cho đi (trừ đi) số electron = sự chênh lệch vị trí giữa hai nguyên tố + Nếu khí hiếm đứng sau nguyên tử của nguyên tố đang xét → nhận thêm (cộng thêm) số electron = sự chênh lệch vị trí giữa hai nguyên tố Lời giải chi tiết: - Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: Nguyên tố Oxygen (ô số 8) có vị trí gần với khí hiếm Neon (ô số 10) nhất → Nguyên tử của nguyên tố Oxygen sẽ nhận 10 - 8 = 2 electron để đạt cấu hình của khí hiếm gần nhất → Đáp án: B CH tr 26 9.2 Nguyên tử lithium (Z = 3) có xu hướng nhường hay nhận bao nhiêu electron để lớp vỏ thoả mãn quy tắc octet? Chọn phương án đúng. A. Nhường 1 electron. B. Nhận 7 electron. C. Nhường 11 electron. D. Nhận 1 electron. Phương pháp giải: - Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó + Nếu khí hiếm đứng trước nguyên tử của nguyên tố đang xét -> cho đi (trừ đi) số electron = sự chênh lệch vị trí giữa hai nguyên tố + Nếu khí hiếm đứng sau nguyên tử của nguyên tố đang xét -> nhận thêm (cộng thêm) số electron = sự chênh lệch vị trí giữa hai nguyên tố Lời giải chi tiết: - Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: Nguyên tố Lithium (ô số 3) có vị trí gần với khí hiếm Helium (ô số 2) nhất - Bước 2: Nguyên tố Lithium (ô số 3) có vị trí gần với khí hiếm Helium (ô số 2) nhất → Nguyên tử của nguyên tố Lithium sẽ cho đi 3 - 2 = 2 electron để đạt cấu hình của khí hiếm gần nhất → Đáp án: A CH tr 26 9.3 Nguyên tử nào sau đây có thể nhường hoặc nhận bốn electron để đạt cấu hình electron bền vững? A. Silicon. B. Beryllium. C. Nitrogen. D. Selenium. Phương pháp giải: - Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Nguyên tố có thể nhường hoặc nhận bốn electron để đạt cấu hình electron bền vững → Nguyên tố đó thuộc nhóm IVA Lời giải chi tiết: - Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: Nguyên tố có thể nhường hoặc nhận bốn electron để đạt cấu hình electron bền vững → Nguyên tố đó thuộc nhóm IVA → Đáp án: A (Silicon) CH tr 26 9.4 Nguyên tử nào sau đây không có xu hướng nhường hoặc nhận electron để đạt được lớp vỏ thoả mãn quy tắc octet? A. Nitrogen. B. Oxygen. C. Sodium. D. Hydrogen. Phương pháp giải: - Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó + Nếu khí hiếm đứng trước nguyên tử của nguyên tố đang xét → cho đi (trừ đi) số electron = sự chênh lệch vị trí giữa hai nguyên tố + Nếu khí hiếm đứng sau nguyên tử của nguyên tố đang xét → nhận thêm (cộng thêm) số electron = sự chênh lệch vị trí giữa hai nguyên tố Lời giải chi tiết: - Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: + Nguyên tố Sodium (ô số 11) có vị trí gần với khí hiếm Neon (ô số 10) nhất → Nguyên tử của nguyên tố Sodium sẽ cho đi 11 - 10 = 1 electron để đạt cấu hình của khí hiếm gần nhất + Nguyên tố Nitrogen (ô số 7) có vị trí gần với khí hiếm Neon (ô số 10) nhất → Nguyên tử của nguyên tố Nitrogen sẽ nhận 10 - 7 = 3 electron để đạt cấu hình của khí hiếm gần nhất + Nguyên tố Oxygen (ô số 8) có vị trí gần với khí hiếm Neon (ô số 10) nhất → Nguyên tử của nguyên tố Oxygen sẽ nhận 10 - 8 = 2 electron để đạt cấu hình của khí hiếm gần nhất + Đặc biệt: Nguyên tố Hydrogen (ô số 1) có vị trí gần với khí hiếm Helium (ô số 2) nhất → Nguyên tử của nguyên tố Hydrogen sẽ có thể: · nhận 2 - 1 = 1 electron để đạt cấu hình của khí hiếm gần nhất → tạo ion H- (ví dụ: NaH, KH, BaH2,…) · cho đi 2 - 1 = 1 electron để tạo thành H+ (ví dụ: HCl, HNO3, H2SO4,…) → Không có đáp án đúng CH tr 26 9.5 Nguyên tử nào trong các nguyên tử sau đây không có xu hướng nhường electron để đạt lớp vỏ thoả mãn quy tắc octet? A. Calcium. B. Magnesium. C. Potassium. D. Chlorine. Phương pháp giải: - Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó + Nếu khí hiếm đứng trước nguyên tử của nguyên tố đang xét → cho đi (trừ đi) số electron = sự chênh lệch vị trí giữa hai nguyên tố + Nếu khí hiếm đứng sau nguyên tử của nguyên tố đang xét → nhận thêm (cộng thêm) số electron = sự chênh lệch vị trí giữa hai nguyên tố Lời giải chi tiết: - Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: + Các nguyên tố Mg, Ca, K đều là kim loại → xu hướng nhường electron để đạt cấu hình của khí hiếm gần nhất + Nguyên tố Chlorine (ô số 17) có vị trí gần với khí hiếm Argon (ô số 18) nhất → Nguyên tử của nguyên tố Chlorine sẽ nhận 18 - 17 = 1 electron để đạt cấu hình của khí hiếm gần nhất → Đáp án: D CH tr 26 9.6 Hãy ghép mỗi nguyên tử ở cột A với nội dung được mô tả ở cột B cho phù hợp
Phương pháp giải: - Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó + Nếu khí hiếm đứng trước nguyên tử của nguyên tố đang xét → cho đi (trừ đi) số electron = sự chênh lệch vị trí giữa hai nguyên tố + Nếu khí hiếm đứng sau nguyên tử của nguyên tố đang xét → nhận thêm (cộng thêm) số electron = sự chênh lệch vị trí giữa hai nguyên tố Lời giải chi tiết: - Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
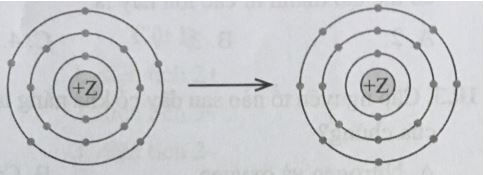
- Bước 2: + Nguyên tố Helium là khí hiếm ở ô số 2 → d - 4 + Nguyên tố Neon là khí hiếm ở ô số 10 → a - 2 + Nguyên tố Magnesium (ô số 12) có vị trí gần với khí hiếm Neon (ô số 10) nhất → Nguyên tử của nguyên tố Magnesium sẽ cho đi 12 - 10 = 2 electron để đạt cấu hình của khí hiếm gần nhất → c - 3 + Nguyên tố Fluorine (ô số 9) có vị trí gần với khí hiếm Neon (ô số 10) nhất → Nguyên tử của nguyên tố Fluorine sẽ nhận 10 - 9 = 1 electron để đạt cấu hình của khí hiếm gần nhất → b - 1 CH tr 27 9.7 Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?
A. Aluminium. B. Nitrogen. C. Phosphorus. D. Oxygen. Phương pháp giải: - Mối liên hệ giữa cấu hình electron và vị trí của nguyên tố trong bảng tuần hoàn + Số lớp electron = số chu kì + Số electron lớp ngoài cùng = số nhóm (đối với các nguyên tố nhóm A) + Ô số thứ tự = điện tích hạt nhân = số proton = số electron - Bước 1: Nhận xét số lượng electron nguyên tố nhường hay nhận + Nguyên tố nhận x electron → nguyên tố đó ở nhóm (8-x)A + Nguyên tố nhường x electron → nguyên tố đó ở nhóm (x)A - Bước 2: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn Lời giải chi tiết: - Bước 1: Từ hình vẽ ta thấy nguyên tố đang nhận 3 electron và có 3 lớp electron → Nguyên tố này ở nhóm VA, chu kì 3 - Bước 2: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
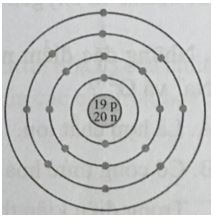
→ Đáp án: C CH tr 27 9.8 Nguyên tử có mô hình cấu tạo sau đây có xu hướng nhường hoặc nhận electron như thế nào khi hình thành liên kết hóa học?
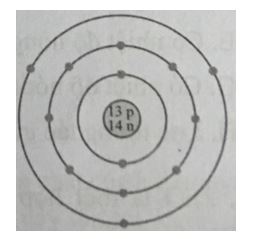
A. Nhận 1 electron. B. Nhường 1 electron. C. Nhận 7 electron. D. Không có xu hướng nhường hoặc nhận electron. Phương pháp giải: Nhận xét số lượng electron ở lớp ngoài cùng - Có từ 1-3 electron → nguyên tố có xu hướng nhường đi 1-3 electron - Có từ 5-7 electron → nguyên tố có xu hướng nhận đi 3-1 electron - Có từ 4 electron → nguyên tố có xu hướng nhường đi hoặc nhận thêm 4 electron Lời giải chi tiết: - Nguyên tố hóa học trong hình vẽ có 1 electron ở lớp ngoài cùng → nguyên tố có xu hướng nhường đi 1 electron → Đáp án: B CH tr 27 9.9 Nguyên tử có mô hình cấu tạo sau sẽ có xu hướng tạo thành ion mang điện tích nào khi nó thỏa mãn quy tắc octet?
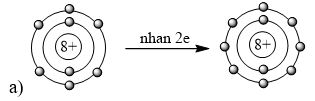
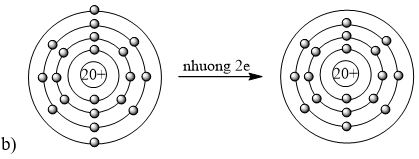
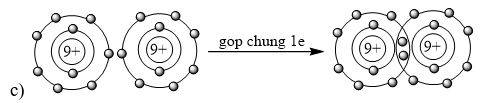
A. 3+. B. 5+. C. 3-. D. 5-. Phương pháp giải: Nhận xét số lượng electron ở lớp ngoài cùng - Có từ 1-3 electron → nguyên tố có xu hướng nhường đi 1-3 electron → tạo thành ion 1+ đến ion 3+ - Có từ 5-7 electron → nguyên tố có xu hướng nhận đi 3-1 electron → tạo thành ion 3- đến ion 1- - Có từ 4 electron → nguyên tố có xu hướng nhường đi hoặc nhận thêm 4 electron → tạo thành ion 4+ hoặc ion 4- Lời giải chi tiết: - Nguyên tố hóa học trong hình vẽ có 3 electron ở lớp ngoài cùng → nguyên tố có xu hướng nhường đi 3 electron → tạo thành ion 3+ → Đáp án: A CH tr 27 9.10 Em hãy vẽ mô hình mô tả quá trình tạo lớp vỏ thỏa mãn quy tắc octet trong các trường hợp sau đây: a) Nguyên tử O (Z = 8) nhận 2 electron để tạo thành anion O2-. b) Nguyên tử Ca (Z = 20) nhường 2 electron để tạo ra cation Ca2+. c) Hai nguyên tử fluorine “góp chung electron” để đạt được lớp vỏ thỏa mãn quy tắc octet. Lời giải chi tiết:
|




















Danh sách bình luận