Bài 4. Sơ lược về bảng tuần hoàn các nguyên tố hóa học trang 23, 24, 25, 26, 27, 28, 29 ,30, 31 Khoa học tự nhiên 7 Kết nối tri thứcTải vềNgày nay, người ta đã xác định được hàng chục triệu chất hóa học với các Sắp xếp các nguyên tố hóa học 1. Dựa vào đặc điểm nào về cấu tạo nguyên tử để sắp xếp các nguyên tố vào hàng, vào cột trong bảng tuần hoàn? 2. Sử dụng bảng tuần hoàn, hãy cho biết các nguyên tố nào trong số các nguyên tố Li, Na, C, O có cùng số lớp electron trong nguyên tử Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 23 MĐ
Lời giải chi tiết: - Nguyên tắc sắp xếp các nguyên tố để dễ dàng nhận ra tính chất của chúng + Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân + Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử + Các nguyên tố trong cùng cột có tính chất gần giống nhau CH tr 23 HĐ
Phương pháp giải: 1. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong một hàng khi đi từ trái sang phải: tăng dần 2. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột: bằng nhau Lời giải chi tiết:
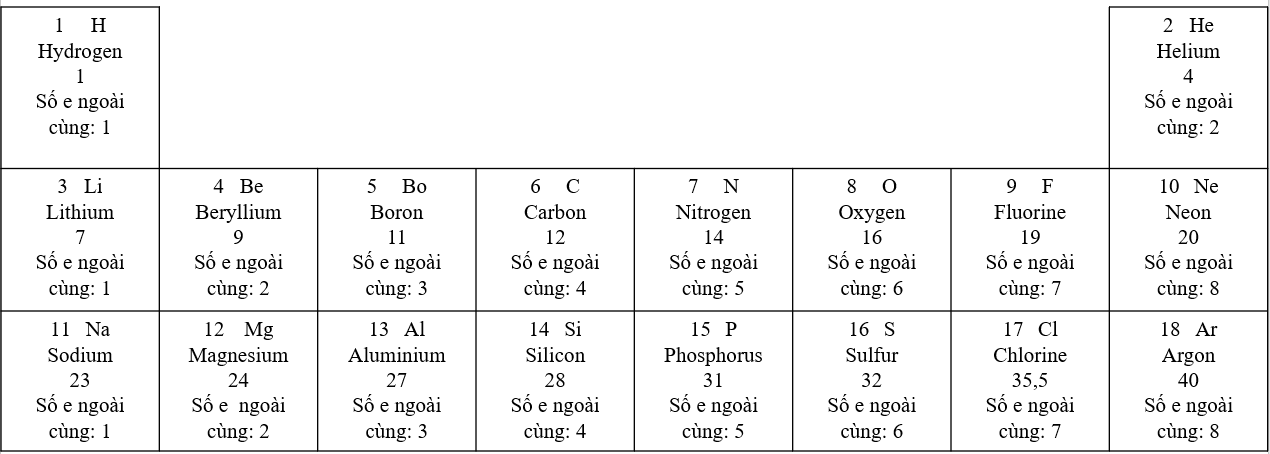
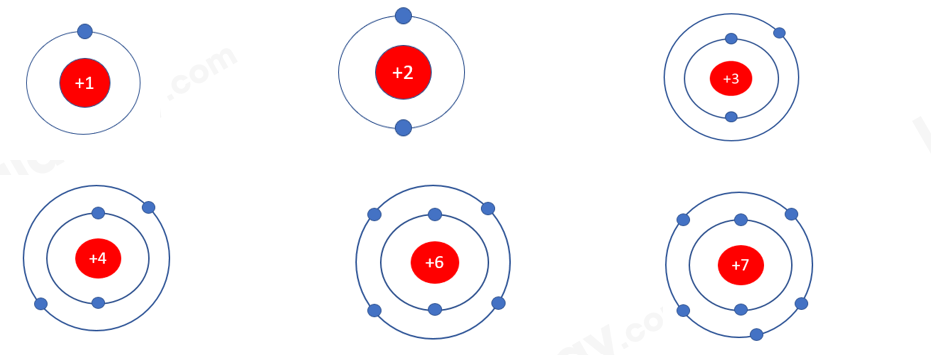
1. - Sự thay đổi số electron ở lớp ngoài cùng trong cùng 1 hàng khi đi từ trái sang phải: + Hàng thứ 1: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 2 + Hàng thứ 2: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 8 + Hàng thứ 3: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 8 2. - Sự thay đổi số electron ở lớp ngoài cùng trong cùng 1 cột khi đi từ trên xuống dưới: Trong cùng 1 cột, các nguyên tử có số electron ở lớp ngoài cùng bằng nhau. Ví dụ + Cột 1: Số electron ở lớp ngoài cùng = 1 + Cột 2: Số electron ở lớp ngoài cùng = 2 + Cột 8: Trừ He, số electron ở lớp ngoài cùng = 8 CH tr 24 CH
Phương pháp giải: 1. Dựa vào số electron ở lớp ngoài cùng và số lớp electron của nguyên tố đó 2. Các nguyên tố trong cùng một hàng sẽ có cùng số lớp electron Lời giải chi tiết: 1. - Dựa vào số electron ở lớp ngoài cùng và số lớp electron của nguyên tố đó. Ví dụ + Trong cùng một hàng, tính từ trái sang phải: Các nguyên tử có cùng số lớp electron, số electron ở lớp ngoài cùng tăng dần + Trong cùng một cột, tính từ trên xuống dưới: Các nguyên tử có cùng số electron ở lớp ngoài cùng, số lớp electron tăng dần 2. Trong 4 nguyên tố: Li, Na, C, O có 3 nguyên tố trong cùng 1 hàng đó là: Li, C, O đều nằm ở hàng thứ 2 => 3 nguyên tố Li, C, O đều có 2 lớp electron CH tr 26 CH
Phương pháp giải: 1. Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số electron trong nguyên tử 2.
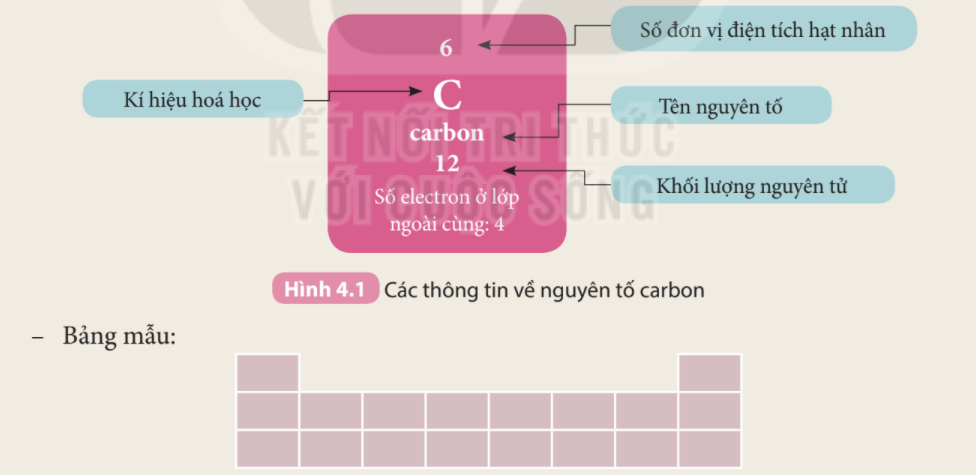
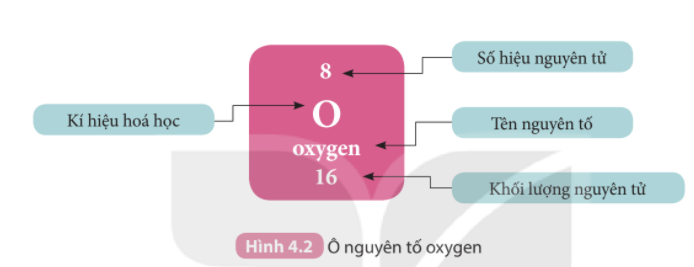
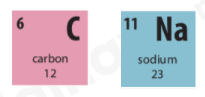
Lời giải chi tiết: 1. Ta có: số hiệu nguyên tử = số đơn vị điện tích hạt nhân (số proton) = số electron trong nguyên tử - Oxygen có số hiệu nguyên tử là 8 => Oxygen có 8 proton và 8 electron 2. - Ô số 6: + Kí hiệu hóa học: C + Tên nguyên tố: Carbon + Số hiệu nguyên tử: 6 + Khối lượng nguyên tử: 12 + Số electron trong nguyên tử = số hiệu nguyên tử: 6 - Ô số 11: + Kí hiệu hóa học: Na + Tên nguyên tố: Sodium + Số hiệu nguyên tử: 11 + Khối lượng nguyên tử: 23 + Số electron trong nguyên tử = số hiệu nguyên tử: 12 CH tr 27 HĐ
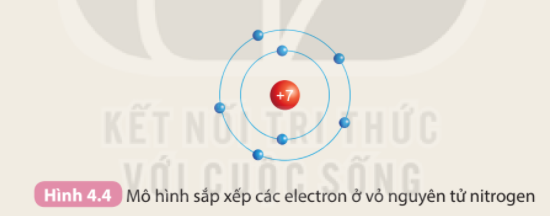
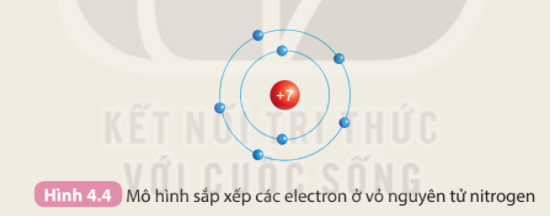
Phương pháp giải: 1. Số lớp electron là số đường tròn xung quanh hạt nhân 2. Số lớp electron = số thứ tự chu kì của nguyên tố Lời giải chi tiết: - Nguyên tố H (Z = 1), He (Z = 2), Li (Z = 3), Be ( Z = 4), C (Z = 6), N (Z = 7)
1. - Nguyên tố H, He có 1 đường tròn => 1 lớp electron - Nguyên tố Li, Be, C, N có 2 đường tròn => 2 lớp electron 2. - Nguyên tố H, He có 1 lớp electron, nằm ở chu kì 1 - Nguyên tố Li, Be, C, N có 2 lớp electron, nằm ở chu kì 2 => Số lớp electron của nguyên tử các nguyên tố = số thứ tự chu kì của các nguyên tố đó CH tr 27 CH
Phương pháp giải: 1. Nguyên tố xung quanh nguyên tố C: B, N, Si 2. Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron Lời giải chi tiết: 1. - Các nguyên tố xung quanh nguyên tố C là: B, N, Si - Nguyên tố B: + Tên: Boron + Kí hiệu hóa học: B + Điện tích hạt nhân: 5 - Nguyên tố N: + Tên: Nitrogen + Kí hiệu hóa học: N + Điện tích hạt nhân: 7 - Nguyên tố Si: + Tên: silicon + Kí hiệu hóa học: Si + Điện tích hạt nhân: 14 2. - Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron => Nguyên tử các nguyên tố thuộc chu kì 3 đều có 3 lớp electron CH tr 28 HĐ
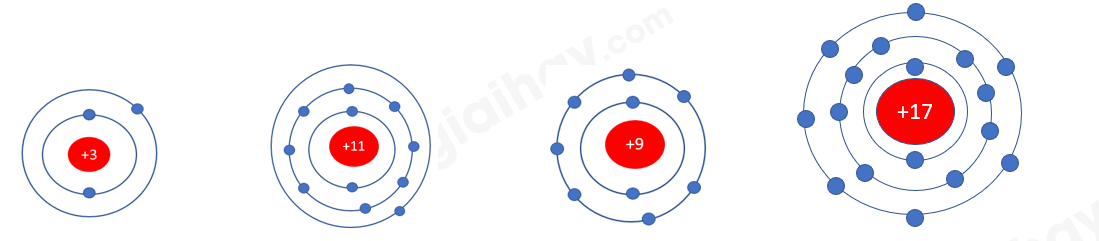
Phương pháp giải: 1. Dựa vào mô hình đã chuẩn bị, đếm số electron ở lớp ngoài cùng 2. Các nguyên tố trong cùng 1 nhóm A có số electron ở lớp ngoài cùng bằng nhau Lời giải chi tiết: 1. - Nguyên tử Li (Z = 3): Có 1 electron ở lớp ngoài cùng - Nguyên tử Na (Z = 11): Có 1 electron ở lớp ngoài cùng - Nguyên tử F (Z = 9): Có 7 electron ở lớp ngoài cùng - Nguyên tử Cl (Z = 17): Có 7 electron ở lớp ngoài cùng => Nguyên tử Li, Na có cùng số electron ở lớp ngoài cùng, nguyên tử F, Cl có cùng số electron ở lớp ngoài cùng 2. - Nguyên tử Li, Na có 1 electron ở lớp ngoài cùng => Nằm trong nhóm IA - Nguyên tử F, Cl có 7 electron ở lớp ngoài cùng => Nằm ở nhóm VIIA => Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố = số thứ tự nhóm CH tr 29 CH
Phương pháp giải: 1. Các nguyên tố trong cùng 1 nhóm A có số electron ở lớp ngoài cùng bằng nhau = số thứ tự của nhóm 2. - Chu kì 1, 2, 3 được gọi là các chu kì nhỏ - Beryllium thuộc nhóm IIA Lời giải chi tiết: 1. - Al thuộc nhóm IIIA => Al có 3 electron ở lớp ngoài cùng - S thuộc nhóm VIA => S có 6 electron ở lớp ngoài cùng 2. - Beryllium thuộc chu kì 2 nhóm IIA => Có nguyên tố Magnesium thuộc chu kì 3 nhóm IIA (cùng nhóm với nguyên tố beryllium) CH tr 30 CH
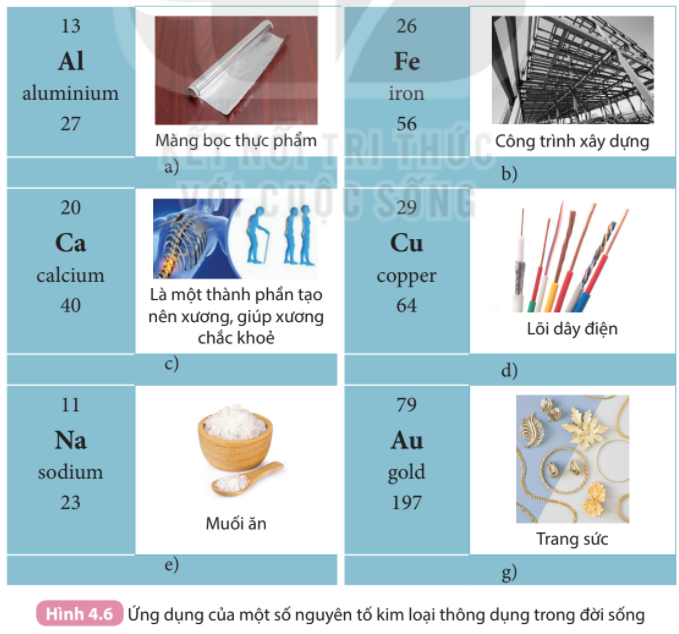
Phương pháp giải: 1. - Số thứ tự = số hiệu nguyên tử - Số chu kì = số thứ tự hàng - Số nhóm = số thứ tự cột A 2. Các tính chất của kim loại: tính dẻo, bền, dẫn điện, dẫn nhiệt, có tính ánh kim Lời giải chi tiết: 1. - Nguyên tố Al: + Số thứ tự: 13 + Chu kì: 3 + Nhóm: IIIA - Nguyên tố Ca: + Số thứ tự: 20 + Chu kì: 4 + Nhóm: IIA - Nguyên tố Na: + Số thứ tự: 11 + Chu kì: 3 + Nhóm: IA 2. - Trong Hình 4.6: + Nhôm có tính dẻo, được dùng làm màng bọc thực phẩm + Sắt cứng, bền với môi trường, được dùng làm công trình xây dựng + Đồng có tính dẫn điện tốt, được dùng làm lõi dây điện CH tr 30 CH
Phương pháp giải: - Số thứ tự = số hiệu nguyên tử - Số chu kì = số thứ tự hàng - Số nhóm = số thứ tự cột A Lời giải chi tiết: - Nguyên tố oxygen (O) + Số thứ tự: 8 + Chu kì: 2 + Nhóm: VIA - Nguyên tố chlorine (Cl) + Số thứ tự: 17 + Chu kì: 3 + Nhóm: VIIA - Nguyên tố sulfur (S) + Số thứ tự: 16 + Chu kì: 3 + Nhóm: VIIA - Nguyên tố bromine (Br) + Số thứ tự: 35 + Chu kì: 4 + Nhóm: VIIA CH tr 31 CH
Phương pháp giải: 1. - Số thứ tự = số hiệu nguyên tử - Số chu kì = số thứ tự hàng - Số nhóm = số thứ tự cột A 2. Bảng tuần hoàn gồm các nguyên tố: kim loại, phi kim và khí hiếm 3. - Nguyên tố kim loại ở góc dưới bên trái của bảng, được thể hiện bằng màu xanh - Nguyên tố phi kim chủ yếu ở góc trên bên phải, được thể hiện bằng màu hồng Lời giải chi tiết: 1. Khí hiếm Neon + Số thứ tự: 10 + Chu kì: 2 + Nhóm: VIIIA 2. Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố: kim loại (màu xanh), phi kim (màu hồng) và khí hiếm (màu vàng). Xem ở Bảng tuần hoàn trang 25 => Đáp án D 3. a) - Các nguyên tố kim loại là: Ba, Rb, Cu, Fe - Các nguyên tố phi kim là: P, Si b) Ứng dụng của nguyên tố Nhôm (Al) trong đời sống - Được dùng để chế tạo máy bay, ô tô, tên lửa, tàu vũ trụ - Dùng trong xây dựng nhà cửa và trang trí nội thất - Dụng cụ nhà bếp vì dẫn nhiệt tốt, ít bị gỉ và không độc - Bột nhôm trộn với bột sắt oxit để thực hiện phản ứng nhiệt nhôm dùng hàn đường ray
|























Danh sách bình luận