Đề số 5 - Đề kiểm tra học kì 1 - Hóa học 10Đáp án và lời giải chi tiết Đề số 5 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 10 Quảng cáo
Đề bài Phần I. Trắc nghiệm (4 điểm). Hãy chọn 1 phương án đúng và ghi vào phiếu bài làm. Câu 1: Các hạt cấu tạo nên hầu hết các nguyên tử là A. electron và proton B. electron và nơtron C. proton và nơtron D. electron, proton và nơtron Câu 2: Số electron và số nơtron của nguyên tử lần lượt là A. 15 và 31 B. 15 và 15 C. 16 và 15 D. 15 và 16 Câu 3: Cho nguyên tố Ca (Z=20), cấu hình electron của Ca là A. 1s22s22p63s23p64s1 B. 1s22s22p63s23p64s2 C. 1s22s22p63s23p64s24p1 D. 1s22s22p63s23p6 Câu 4: Nguyên tố nào sau đây là nguyên tố s ? A. 1s22s22p3 B. 1s22s22p2 C. 1s22s22p5 D. 1s22s1 Câu 5: Nguyên tử X có cấu hình electron ở lớp ngoài cùng là 4s24p3. Vị trí của X trong bảng tuần hoàn là A. Chu kì 4, nhóm IIIA B. Chu kì 3, nhóm IIIA C. Chu kì 4, nhóm VA D. Chu kì 3, nhóm VA Câu 6: Cấu hình electron của X là 1s22s22p63s23p4. Nhận xét nào sau đây đúng A. X là kim loại. B. X là phi kim. C. X là khí hiếm D. X vừa là một kim loại, vừa là một phi kim. Câu 7: Cho 2 nguyên tố X (Z=12) và Y (Z=15). Nhận định nào sau đây là đúng A. Tính kim loại của X>Y B. Tính kim loại của Y>X C. Tính phi kim của X>Y D. Tính phi kim của X=Y Câu 8: Trong cùng một nhóm A, theo chiều điện tích hạt nhân tăng thì bán kính nguyên tử A. không đổi B. tăng dần C. giảm dần D. biến đổi không có qui luật Câu 9: Cho Na (Z=11) và Cl (Z=17). Liên kết trong phân tử NaCl là A. liên kết cộng hóa trị không cực B. liên kết cộng hóa trị có cực C. liên kết ion D. liên kết cộng hóa trị Câu 10: Cộng hóa trị của cacbon và hiđro trong phân tử CH4 lần lượt là A. 4 và 1 B. 1 và 4 C. +4 và 1- D. 4+ và 1- Câu 11: Số oxi hóa của nitơ trong phân tử HNO3 là A. +3 B. 3+ C. +5 D. 5+ Câu 12: Điện hóa trị của kali trong KCl là A. +1 B. 1+ C. 1 D. 1- Câu 13: Trong phản ứng: 4NH3 + 3O2 ® 2N2 + 6H2O. Vai trò của NH3 là A. chất khử B. chất khử, đồng thời là chất oxi hóa C. chất oxi hóa D. chất cho và nhận electron. Câu 14: Quá trình nào sau đây là đúng A. \(\mathop {Al}\limits^0 + 3e \to \mathop {Al}\limits^{ + 3} \) B. \(\mathop {Mn}\limits^{ + 7} + 4e \to \mathop {Mn}\limits^{ + 4} \) C. \(\mathop S\limits^{ - 2} \to \mathop S\limits^0 + 2e\) D. \(\mathop {Mn}\limits^{ + 4} + 3e \to \mathop {Mn}\limits^{ + 7} \) Câu 15: Nguyên tử nào sau đây là đồng vị của A. \({}_{17}^{37}Y\) B. \({}_{16}^{32}Z\) C. \({}_{14}^{28}T\) D. \({}_{15}^{31}Y\) Câu 16: Cacbon có 2 đồng vị: 12C và 13C. Oxi có 3 đồng vị: 16O, 17O, 18O. Số phân tử CO khác nhau được tạo nên từ các đồng vị trên là A. 4 B. 6 C. 10 D. 12 Phần II. Tự luận (6 điểm). Câu 17: (2,0 điểm) Cân bằng phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron: Zn + H2SO4 → ZnSO4 + S + H2O Câu 18: (2,0 điểm) Tổng số hạt trong nguyên tử X là 48 hạt. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. a. Xác định số proton và số nơtron trong X? b. Viết cấu hình electron của X? Cho biết công thức oxit cao nhất với oxi của X và công thức hợp chất khí với hiđro của X? Câu 19: (2,0 điểm) Hòa tan hoàn toàn 4,6 gam một kim loại R thuộc nhóm IA vào 100 gam nước, thu được 2,24 lít khí H2 (đktc) a. Xác định tên kim loại R? b. Tính khối lượng dung dịch thu được sau phản ứng? Lời giải chi tiết
II. TỰ LUẬN (6 điểm) Câu 17:
3Zn + 4H2SO4 → 3ZnSO4 + S + 4H2O Câu 18: Đặt Z = số p = số e; N = số n - Tổng số hạt trong nguyên tử X là 48 nên ta có: Số p + số e + số n = 48 hay 2Z + N = 48 (1) - Số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt nên ta có: (số p + số e) – số n = 16 hay 2Z – N = 16 (2) Từ (1) và (2) ta có hệ phương trình: \(\left\{ \matrix{ a. Số proton trong X là 16, số notron trong X là 16. b. Cấu hình electron của 16X: 1s22s22p63s23p4 Do X có 6 electron lớp ngoài cùng nên X thuộc nhóm VIA. Vậy: X có hóa trị VI trong oxit cao nhất với oxi => Oxit cao nhất với oxi: XO3 X có hóa trị II trong hợp chất khí với hidro => Hợp chất khí với hidro: H2X Câu 19: nH2 = 2,24:22,4 = 0,1 mol PTHH: 2R + 2H2O → 2ROH + H2 0,2 ← 0,1 (mol) \({M_R} = \dfrac{{{m_R}} }{{{n_R}}} = \dfrac{{4,6} }{ {0,2}} = 23\) => R là Natri (Na) b. mH2 = 0,1.2 = 0,2 (g) Áp dụng định luật bảo toàn khối lượng, khối lượng dung dịch sau phản ứng: m dd = mNa + mH2O – mH2 = 4,6 + 100 – 0,2 = 104,4 (g) Xem lời giải chi tiết đề thi học kì 1 tại Tuyensinh247.com Loigiaihay.com
|
||||||||||||||||||||||||||||||||||||














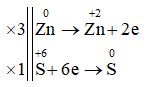






Danh sách bình luận