Đề số 9 - Đề kiểm tra học kì 1 - Hóa học 10Đáp án và lời giải chi tiết Đề số 9 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 10 Quảng cáo
Đề bài I. PHẦN TRẮC NGHIỆM (2,0 điểm) Câu 1: Chất nào sau đây chứa liên kết ion? A. N2. B. CH4. C. KCl. D. NH3. Câu 2: Tổng số hạt mang điện trong nguyên tử X là 112. Số proton trong X là A. 112. B. 56. C. 48. D. 55. Câu 3: Nguyên tố X thuộc chu kì 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là A. 3. B. 1 C. 4. D. 2. Câu 4: Thứ tự tăng dần tính phi kim của các nguyên tố trong nhóm VIIA là A. Br, F, I, Cl. B. F, Cl, Br, I C. I, Br, F, Cl. D. I, Br, Cl, F. Câu 5: Cấu hình electron nào sau đây là của nguyên tố kim loại? A. 1s22s22p63s23p6 B. 1s22s22p63s23p3 C. 1s22s22p63s23p1 D. 1s22s22p63s23p5. Câu 6: Số oxi hóa của lưu huỳnh trong SO2 bằng A. -2. B. +4. C. +2. D. +6. Câu 7: Nguyên tử kali có 19 proton, 19 electron và 20 notron. Số khối của nguyên tử kali là A. 20. B. 19. C. 38. D. 39. Câu 8: Vị trí của flo (Z = 9) trong bảng tuần hoàn là A. ô số 9, chu kì 2, nhóm VIIA. B. ô số 9, chu kì 2, nhóm VA. C. ô số 7, chu kì 3, nhóm VIIA. D. ô số 7, chu kì 2, nhóm VA. II. PHẦN TỰ LUẬN (8,0 điểm) Câu 9: (2,0 điểm) Hạt nhân nguyên tử X có 8 proton; nguyên tử Y có tổng số hạt mang điện bằng 52. a) Viết cấu hình electron của X, Y. b) Viết cấu hình electron của Y2+; Y3+. Câu 10: (2,0 điểm) Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron a) C + HNO3 → CO2 + NO2 + H2O b) Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O Câu 11: (1,5 điểm) Trong tự nhiên đồng có hai đồng vị là và . Tính phần trăm số nguyên tử của mỗi đồng vị biết nguyên tử khối trung bình của đồng là 63,54 đvC. Câu 12: (2,5 điểm) Nguyên tố X thuộc nhóm VIA trong bảng tuần hoàn. Phần trăm khối lượng của X trong oxit cao nhất là 40%. a) Tìm nguyên tố X. b) Gọi Y là hidroxit cao nhất của X. Viết công thức cấu tạo của Y (thỏa mãn qui tắc bát tử) và viết phương trình phản ứng của Y với K2CO3; BaCl2. Lời giải chi tiết
II. PHẦN TỰ LUẬN (8,0 điểm) Câu 9: a) *Cấu hình e của X: ZX = số p = 8 => Cấu hình e của X: 1s22s22p4 *Cấu hình e của Y: Tổng hạt mang điện = 2ZY = 52 => ZY = 26 => Cấu hình e của Y: 1s22s22p63s23p63d64s2 b) Cấu hình e của Y2+: 1s22s22p63s23p63d6 Cấu hình e của Y3+: 1s22s22p63s23p63d5 Câu 10:
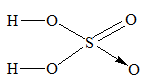
Câu 11: Đặt x % và y % lần lượt là phần trăm của 2 đồng vị \({}_{29}^{63}Cu\) và \({}_{29}^{65}Cu\). Theo đề bài ta có hệ phương trình sau: \(\left\{ \matrix{ Câu 12: a) Hóa trị trong oxit cao nhất của một nguyên tố nhóm A bằng số thứ tự nhóm của nguyên tố đó. X thuộc nhóm VIA nên có hóa trị VI trong oxit cao nhất => Công thức của oxit cao nhất là: XO3 \(\eqalign{ Vậy nguyên tố X là lưu huỳnh, kí hiệu: S b) Công thức hiroxit cao nhất của S là: S(OH)6 khi bớt 2 H2O ta được H2SO4 - Công thức cấu tạo H2SO4: - PTHH: H2SO4 + K2CO3 → K2SO4 + H2O + CO2 H2SO4 + BaCl2 → BaSO4 + 2HCl Xem lời giải chi tiết đề thi học kì 1 tại Tuyensinh247.com Loigiaihay.com
|
||||||||||||||||||





















Danh sách bình luận