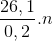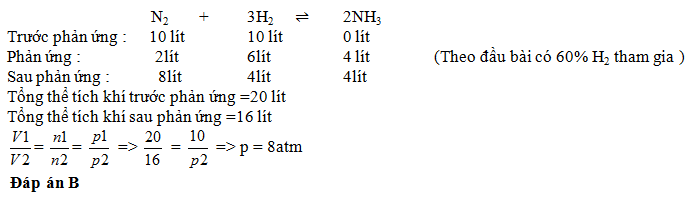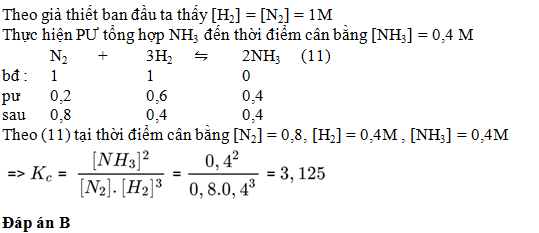30 bài tập về amoniac và muối amoni có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Cho 100 ml NaOH 2M phản ứng hết với dung dịch NH4Cl dư thu được V lít khí (đktc). Giá trị của V là
Đáp án: A Phương pháp giải: Tính theo PTHH: \(NaOH + N{H_4}Cl \to NaCl + N{H_3} + {H_2}O\) Lời giải chi tiết: \({n_{NaOH}} = 0,1.2 = 0,2(mol)\) PTHH: \(NaOH + N{H_4}Cl \to NaCl + N{H_3} + {H_2}O\) Theo PTHH: \({n_{N{H_3}}} = {n_{NaOH}} = 0,2(mol) \to {V_{N{H_3}}} = 0,2.22,4 = 4,48(l)\) Đáp án A Câu hỏi 2 : Cần lấy bao nhiêu lít khí N2 và H2 ở điều kiện chuẩn để điều chế được 8,5 gam khí amoniac, biết hiệu suất phản ứng là 40%.
Đáp án: A Phương pháp giải: Tính được n NH3 \({N_2} + {\text{3}}{H_2}\overset {{t^o},xt,p} \leftrightarrows 2N{H_3}\) Dựa vào PTHH tính được lượng N2 và H2 theo lý thuyết. Dựa vào hiệu suất tính được N2 và H2 thực tế cần dùng. Lời giải chi tiết: n NH3 = 8,5 / 17 = 0,5 (mol) \({N_2} + {\text{3}}{H_2}\overset {{t^o},xt,p} \leftrightarrows 2N{H_3}\) Theo PTHH: nN2 = 0,5.nNH3 = 0,5.0,5 = 0,25 mol → VN2 = 0,25.22,4 = 5,6 lít nH2 = 1,5.nNH3 = 1,5.0,5 = 0,75 mol → VH2 = 0,75.22,4 = 16,8 lít Do hiệu suất phản ứng đạt 40% nên thể tích N2, H2 cần dùng là: VN2 cần dùng = 5,6.(100/40) = 14 lít VH2 cần dùng = 16,8.(100/40) = 42 lít Đáp án A Câu hỏi 3 : Điều chế HNO3 từ 17 tấn NH3. Xem toàn bộ quá trình điều chế có hiệu suất 80% thì lượng dung dịch HNO3 63% thu được là
Đáp án: D Phương pháp giải: Tính được nNH3 Ta có: \(N{H_3}\xrightarrow{{H = 80\% }}HN{O_3}\) Dựa vào sơ đồ tính được lượng HNO3 thu được theo lý thuyết. Dựa vào hiệu suất cả quá trình tính được lượng HNO3 thu được thực tế. Lời giải chi tiết: nNH3 = 17 : 17 = 1 (tấn mol) Ta có: \(N{H_3}\xrightarrow{{H = 80\% }}HN{O_3}\) → nHNO3(LT) = nNH3 = 1 (tấn mol) → mHNO3 (LT) = 63 tấn → mdd HNO3 (LT) = 63.(100/63) = 100 tấn Do hiệu suất phản ứng cả quá trình là 80% nên lượng dung dịch HNO3 thu được là: m dd HNO3 thu được = 100.80% = 80 tấn Đáp án D Câu hỏi 4 : Dẫn 1,344 lít NH3 vào bình chứa 0,672 lít khí Cl2. Khối lượng muối NH4Cl được tạo ra là:
Đáp án: D Phương pháp giải: Tính theo các PTHH: 2NH3 + 3Cl2 → N2 + 6HCl NH3 + HCl → NH4Cl Lời giải chi tiết: nNH3 = 0,06 mol; nCl2 = 0,03 mol PTHH: 2NH3 + 3Cl2 → N2 + 6HCl 0,02/0,04 ← 0,03 → 0,06 (mol) NH3 + HCl → NH4Cl 0,04 → 0,04/0,02 → 0,04 (mol) Vậy mNH4Cl = 0,04.53,5 = 2,14 (gam) Đáp án D Câu hỏi 5 : Thực hiện phản ứng tổng hợp amoniac từ N2+3H2 ⇋ 2NH3 . Nồng độ mol ban đầu các chất : [N2] = 1M, [H2] = 1,2M. Khi phản ứng đạt cân bằng [NH3] = 0,2M. Hiệu suất phản ứng tổng hợp là
Đáp án: D Phương pháp giải: N2+3H2 ⇋ 2NH3 [N2] = 1M, [H2] = 1,2M => Lời giải chi tiết:
Hướng dẫn giải: N2+3H2 ⇋ 2NH3 0,1 0,3 0,2 [N2] = 1M, [H2] = 1,2M => Đáp án D. Câu hỏi 6 : X là hỗn hợp khí H2 và N2 có tỉ khối đối với oxi bằng 0,225. Dẫn X vào bình có xúc tác bột sắt, đun nóng thì thu được hỗn hợp khí Y có tỷ khối đối với oxi bằng 0,25. Tính hiệu suất tổng hợp NH3
Đáp án: A Phương pháp giải: - Phương pháp đường chéo để tính tỉ lệ mol các khí - Viết và tính theo PTHH Lời giải chi tiết: MX = 0,225.32 = 7,2 H2: 2 20,8 7,2 => nH2/nN2 = 20,8/5,2 = 4 N2: 28 5,2 Giả sử nH2 = 4 mol và nN2 = 1 mol BTKL: mX = mY => 4.2 + 1.28 = nY.0,25.32 => nY = 4,5 mol 3H2 + N2 \(\overset {{t^o},xt} \leftrightarrows \) 2NH3 Bđ: 4 1 (mol) Pư: 3x x 2x (mol) Sau: 4-3x 1-x 2x (mol) nY = 4-3x + 1-x + 2x = 4,5 => x = 0,25 mol Hiệu suất tính theo N2 => H = (0,25/1.100%) = 25% Đáp án A Câu hỏi 7 : Cho hỗn hợp khí N2, H2 và NH3 có tỉ khối so với H2 là 8. Dẫn hỗn hợp đi qua dd H2SO4 đặc dư thì thể tích khí còn lại một nửa. Thành phần phần % theo thể tích của mỗi khí trong hỗn hợp lần lượt là :
Đáp án: A Phương pháp giải: Lời giải chi tiết: NH3 bị hấp thụ bởi H2SO4 3NH3 + H2SO4 → (NH4)2SO4 Lấy 1 mol hỗn hợp => nNH3 = 0.5 nH2=x; nN2 = y x +y = 0.5 2x + 28y = 8 . 2 -17 . 0.5 => x=y=0.25 %NH3 = 50% %N2=%H2 = 25% Đáp án A Câu hỏi 8 : Cho 0,448 lít khí NH3 (đktc) đi qua ống sứ đựng 16 gam CuO nung nóng, thu được chất rắn X (giả sử phản ứng xảy ra hoàn toàn). Phần trăm khối lượng của Cu trong X là
Đáp án: D Phương pháp giải: Lời giải chi tiết:
Câu hỏi 9 : Trong một bình kín dung tích không đổi chứa khí N2 và H2 với tỉ lệ thể tích 1:2. Đốt nóng bình sau một thời gian để xảy ra phản ứng N2 (k) + 3H2 (k)
Đáp án: A Phương pháp giải: Tính toán theo PTHH. Lời giải chi tiết: Giả sử số mol N2 là 1 mol, số mol H2 là 2 mol, hiệu suất phản ứng là h. N2 (k) + 3H2 (k) Bđ: 1 2 (Ta thấy: 1/1 > 2/3 => Hiệu suất tính theo H2) Pư: 2h/3 ← 2h → 4h/3 Sau: 1-2h/3 2-2h 4h/3 Số mol khí sau phản ứng: ns = 1-2h/3 + 2 - 2h + 4h/3 = 3 - 4h/3 (mol) Ta có: \(\frac{{{p_s}}}{{{p_d}}} = \frac{{{n_s}}}{{{n_d}}} \Rightarrow \frac{{3{\rm{ }} - {\rm{ }}\frac{{4h}}{3}}}{{1 + 2}} = \frac{5}{6} \Rightarrow h = 0,375 = 37,5\% \) Đáp án A Câu hỏi 10 : Một hỗn hợp gồm 8 mol N2 và 14 mol H2 được nạp vào một bình kín có dung tích 4 lít và giữ ở nhiệt độ không đổi. Khi phản ứng đạt trạng thái cân bằng thì áp suất bằng 10/11 áp suất ban đầu. Hiệu suất tổng hợp NH3 là
Đáp án: D Phương pháp giải: Tính theo PTHH: N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3 Lời giải chi tiết: N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3 Ban đầu: 8 14 (Ta thấy: 8/1 > 14/3 nên hiệu suất tính theo H2) Phản ứng: x 3x 2x Sau: 8-x 14-3x 2x Ta có: n đầu = 8 + 14 = 22 mol và n sau = (8-x) + (14-3x) + 2x = 22 - 2x (mol) Khi hiệu suất không đổi thì: \(\frac{{{n}_{sau}}}{{{n}_{dau}}}=\frac{{{p}_{sau}}}{{{p}_{dau}}}\Rightarrow \frac{22-2\text{x}}{22}=\frac{10}{11}\Rightarrow x=1\) → nH2 pư = 3x = 3 mol → H = \(\frac{{{n}_{{{H}_{2}}pu}}}{{{n}_{{{H}_{2}}b\text{d}}}}.100%\) = \(\frac{3}{14}.100%\) = 21,43% Đáp án D Câu hỏi 11 : Cho 30 lít N2 phản ứng với 30 lít H2 trong điều kiện thích hợp sẽ tạ ra V thể tích NH3 (đktc) khi hiệu suất phản ứng đạt 30% thì giá trị của V là
Đáp án: C Phương pháp giải: Lời giải chi tiết: N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3 Ban đầu (lít): 30 30 (Ta thấy: 30/1 > 30/3 nên hiệu suất tính theo H2) Do đó: VH2 pư = 30.30% = 9 lít Theo PTHH: VNH3 thu được = 2/3.VH2 pư = 2/3.9 = 6 lít Đáp án C Câu hỏi 12 : Trộn 100 ml dung dịch natri nitrit 3M với 300 ml dung dịch amoni clorua 1,6M đun nóng đến phản ứng hoàn toàn. Thể tích khí N2 sinh ra và nồng độ mol các muối trong dung dịch sau phản ứng là:
Đáp án: A Phương pháp giải: Tính theo PTHH: NaNO2 + NH4Cl \(\xrightarrow{{{t^o}}}\) NaCl + N2 + 2H2O Lời giải chi tiết: Ta có: nNaNO2 = 0,1.3 = 0,3 mol; nNH4Cl = 0,3.1,6 = 0,48 mol PTHH: NaNO2 + NH4Cl \(\xrightarrow{{{t^o}}}\) NaCl + N2 + 2H2O Bđ: 0,3 0,48 Pư: 0,3 → 0,3 → 0,3 → 0,3 Sau: 0 0,18 0,3 0,3 ⟹ VN2 = 0,3.22,4 = 6,72 (lít); CM NaCl = 0,3 : 0,4 = 0,75 (M); CM NH4Cl = 0,18 : 0,4 = 0,45 (M). Đáp án A Câu hỏi 13 : Cho dung dịch NaOH dư vào 150 ml dung dịch (NH4)2SO4 1M, đun nóng nhẹ. Thể tích khí (đktc) thu được là:
Đáp án: B Phương pháp giải: Tính theo PTHH: (NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O Lời giải chi tiết: Ta có: n(NH4)2SO4 = 0,15 (mol) (NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O Theo PTHH → n NH3 = 2.n(NH4)2SO4 = 0,3 (mol) ⟹ VNH3 = 0,3.22,4 = 6,72 (lít) Đáp án B Câu hỏi 14 : Thực hiện phản ứng giữa 10 lít H2 và 40 lít N2 với bột Fe làm xúc tác nung nóng. Hỗn hợp sau phản ứng được dẫn qua dung dịch H2SO4 loãng dư ( hấp thụ khí NH3) còn lại 40 lít khí. Các thể tích đo ở điều kiện nhiệt độ , áp suất. Hiệu suất của quá trình tổng hợp NH3
Đáp án: A Phương pháp giải: Phương pháp: Gọi thể tích N2 tham gia phản ứng : x N2 + 3 H2 <-> 2NH3 có 40 10 p/u x 3x 2x sau 40-x 10-3x 2x Sau phản ứng: Vkhí = 50-2x H2SO4 hấp thụ hết NH3 => Vsau =40 => x => H Lời giải chi tiết:
Hướng dẫn giải Gọi thể tích N2 tham gia phản ứng : x N2 + 3 H2 <-> 2NH3 có 40 10 p/u x 3x 2x sau 40-x 10-3x 2x Sau phản ứng: Vkhí = 50-2x H2SO4 hấp thụ hết NH3 => Vsau = 50-4x=40 => x=2,5 H tính theo H2 H= Đáp án A. Câu hỏi 15 : Cho 100 ml dung dịch X chứa Al(NO3)3 0,2M, Cu(NO3)2 0,1M và AgNO3 0,2M tác dụng với dung dịch NH3 dư thu được m gam kết tủa. Giá trị của m là
Đáp án: B Phương pháp giải: Phương pháp: Kết tủa của Ag, Cu tạo phức nên tan hết trong dung dịch NH3 dư => mkết tủa = Al(NO3)3 + 3NH3+ 3H2O -> Al(OH)3 + 3NH4NO3 Lời giải chi tiết:
Hướng dẫn giải: Kết tủa của Ag, Cu tạo phức nên tan hết trong dung dịch NH3 dư => mkết tủa = Al(NO3)3 + 3NH3+ 3H2O -> Al(OH)3 + 3NH4NO3 0,02 0,02 => mkết tủa = 78.0,02=1,56 gam Đáp án B. Câu hỏi 16 : Thêm NH3 đến dư vào dung dịch hỗn hợp chứa 0,01 mol FeCl3 ; 0,2 mol CuCl2. Khi các phản ứng xảy ra hoàn toàn, khối lượng kết tủa thu được là :
Đáp án: C Phương pháp giải: Phương pháp: Tính theo PTHH. Lời giải chi tiết:
Hướng dẫn giải: FeCl3, CuCl2 Do Cu(OH)2 sinh ra tạo phức hết với dung dịch NH3 => mkết tủa = FeCl3 + 3NH3+ 3H2O -> Fe(OH)3 + 3NH4Cl 0,01 0,01 => Đáp án C. Câu hỏi 17 : Thể tích O2(đktc) cần để đốt cháy hết 6,8 gam NH3 tạo thành khí NO; H2O là:
Đáp án: D Phương pháp giải: Phương pháp: 4NH3 + 5O2 -> 4NO + 6H2O => V Lời giải chi tiết:
Hướng dẫn giải: 4NH3 + 5O2 -> 4NO + 6H2O 0,4 0,5 => VO2 = 0,5.22,4=11,2 lít Đáp án D. Câu hỏi 18 : Cho 4 mol N2 và 16 mol H2 vào bình kín. Tại thời điểm cân bằng thu được x mol hỗn hợp khí. Biết hiệu suất của phản ứng tổng hợp NH3 là 70%. Tính x?
Đáp án: B Phương pháp giải: Phương pháp: => H tính theo N2 H= N2 + 3 H2 <-> 2NH3 Thay vào PT tính số mol hỗn hợp sau phản ứng Lời giải chi tiết:
Hướng dẫn giải => H tính theo N2 H= N2 + 3 H2 <-> 2NH3 bđ 4 16 p/u 2,8 8,4 5,6 sau 1,2 7,6 5,6 => x=14,4 mol Đáp án B. Câu hỏi 19 : Nung nóng bình kín chứa a mol hỗn hợp NH3 và O2 ( có xúc tác Pt) để chuyển toàn bộ NH3 thành NO. Làm nguội và thêm nước vào bình, lắc đều thu được 1 lít dung dịch HNO3 có pH = 1, còn lại 0,25a mol khí O2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
Đáp án: D Phương pháp giải: pH = 1 => nHNO3 = ? (mol) BTNT N => nNH3 = nHNO3 = ?(mol) => nO2 = a – 0,1 (mol) BT e : => 8nNH3 = 4nO2 => a = ? (mol) Lời giải chi tiết: pH = 1=> [H+] = 10-1 = 0,1 (M) => nHNO3 = 0,1 (mol) BTNT N => nNH3 = nHNO3 = 0,1 (mol) => nO2 = a – 0,1 (mol) Sau quá trình \(\begin{gathered} BT e : => 8nNH3 = 4nO2 => 8.0,1 = 4 ( a – 0,1) => a = 0,4 (mol) Đáp án D Câu hỏi 20 : Dẫn 2,24 lít khí NH3 (đktc) đi qua ống đựng 32 gam bột CuO nung nóng thu được chất rắn X và khí Y. Thể tích khí Y sinh ra là:
Đáp án: C Phương pháp giải: Viết và tính theo PTHH Lời giải chi tiết: PTHH: 2NH3+ 3CuO \(\xrightarrow{{{t}^{o}}}\) 3Cu + N2 + 3H2O Bđ: 0,1 0,4 Pư: 0,1 → 0,15 → 0,05 (mol) nY = nN2 = 0,05.22,4 = 1,12 lít Đáp án C Câu hỏi 21 : Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là
Đáp án: D Phương pháp giải: Viết và tính toán theo PTHH. Lời giải chi tiết: NH4+ + OH- → NH3 + H2O Theo PTHH: nOH- = nNH3 = 5,6 : 22,4 = 0,25 mol => CM = n : V = 0,25 : 0,1 = 2,5M Đáp án D Câu hỏi 22 : Từ 34 tấn NH3 sản xuất 160 tấn HNO3 63%. Hiệu suất của phản ứng điều chế HNO3 là:
Đáp án: A Phương pháp giải: Phương pháp: 4NH3 + 5O2 -> 4NO + 6H2o 2NO+ O2 -> 2NO2 4NO2 + 2H2O + O2 -> 4HNO3 Bảo toàn N nN(NH3) =nN(HNO3) => Lời giải chi tiết:
Hướng dẫn giải: 4NH3 + 5O2 -> 4NO + 6H2o 2NO+ O2 -> 2NO2 4NO2 + 2H2O + O2 -> 4HNO3 Bảo toàn N nN(NH3) =nN(HNO3) = => Đáp án A. Câu hỏi 23 : Cho 6 mol N2 và 20 mol H2 vào bình kín. Tại thời điểm cân bằng thu được 18 mol hỗn hợp khí. Hiệu suất của phản ứng tổng hợp NH3 trên.
Đáp án: C Phương pháp giải: Phương pháp: N2 + 3 H2 <-> 2NH3 có 6 20 p/u x 3x 2x sau 6-x 20-3x 2x => nsau =18 => x
=> H Lời giải chi tiết:
Hướng dẫn giải:
N2 + 3 H2 <-> 2NH3 có 6 20 p/u x 3x 2x sau 6-x 20-3x 2x 6-x + 20-3x+ 2x=18 => 26-2x=18 => x=4
Đáp án C. Câu hỏi 24 : Cho 4 lít N2; 14 lít H2 vào bình phản ứng hỗn hợp thu được sau phản ứng có thể tích 16,4 lít (đktc). Hiệu suất của phản ứng tổng hợp NH3 là:
Đáp án: B Phương pháp giải: N2 + 3 H2 -> 2NH3 có 4 14 p/u x 3x 2x sau 4-x 14-3x 2x nsau =16,4 => x So sánh để xem tính hiệu suất theo N2 hay H2 Lời giải chi tiết: N2 + 3 H2 -> 2NH3 có 4 14 p/u x 3x 2x sau 4-x 14-3x 2x 4-x + 14-3x+ 2x=16,4 => 18-2x=16,4 => x=0,8 Tính hiệu suất theo N2 vì lượng H2 dư nhiều hơn (N2: 4mol, H2: 14 mol) => H= Đáp án B Câu hỏi 25 : Cho dung dịch NH4NO3 tác dụng với dung dịch bazơ của kim loạithu được 4,48 lít khí (đktc) và 26,1 gam muối. Kim loại đó là
Đáp án: D Phương pháp giải: Phương pháp: nNH4NO3 + M(OH)n -> M(NO3)n + nNH3 +nH2O 0,2 => Mmuối = M+ 62n= => M Biện luận => M, n Lời giải chi tiết:
Hướng dẫn giải: nNH4NO3 + M(OH)n -> M(NO3)n + nNH3 +nH2O => Mmuối = M+ 62n= => M=68,5n
n 1 2 3 M 68,5 137(Ba) 205,5
Đáp án D. Câu hỏi 26 : Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ được giữ không đổi. Sau thời gian phản ứng, áp suất của các khí trong bình giảm 5% so với áp suất lúc đầu. Biết rằng tỉ lệ số mol N2 đã phản ứng là 10%. Thành phần % số mol N2 và H2 trong hỗn hợp ban đầu lần lượt là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Gọi số mol N2, H2 ban đầu lần lượt là a và b (mol) => nN2 pư = 10%.a = 0,1a (mol) N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3 Ban đầu: a b Phản ứng: 0,1a → 0,3a → 0,2a Sau: 0,9a b-0,3a 0,2a → n đầu = a + b (mol) và n sau = 0,9a + b - 0,3a + 0,2a = 0,8a + b (mol) Sau phản ứng, áp suất của các khí trong bình giảm 5% so với áp suất lúc đầu nên ta có: p đầu - p sau = 0,05.p đầu → 0,95.p đầu = p sau → \(\frac{{{p_{dau}}}}{{{p_{sau}}}} = \frac{1}{{0,95}}\) Mặt khác, ở nhiệt độ không đổi thì: \(\frac{{{p_{dau}}}}{{{p_{sau}}}} = \frac{{{n_{dau}}}}{{{n_{sau}}}} \Rightarrow \frac{{a + b}}{{0,8{\text{a}} + b}} = \frac{1}{{0,95}}\) → a/b = 1/3 Giả sử có 1 mol N2 và 3 mol H2 → %nN2 = \(\frac{1}{{1 + 3}}.100\% \) = 25% và %nH2 = 75% Đáp án C Câu hỏi 27 : Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hidro để điều chế 17 gam NH3? Biết rằng hiệu suất chuyển hóa thành amoniac là 25%. Các thể tích khí đo được ở đktc.
Đáp án: A Phương pháp giải: Lời giải chi tiết: nNH3 = 17 : 17 = 1 mol PTHH: N2 + 3H2 \(\rightleftharpoons \) 2NH3 0,5 ← 1,5 ← 1 (mol) Do hiệu suất phản ứng H = 25% nên lượng cần dùng lớn hơn lượng tính toán được: nN2 cần dùng = 0,5.(100/25) = 2 mol => V N2 cần dùng = 44,8 lít nH2 cần dùng = 1,5.(100/25) = 6 mol => V H2 cần dùng = 134,4 lít Đáp án A Câu hỏi 28 : Trong một bình kín chứa 10 lít nito và 10 lít Hidro ở nhiệt đô 0o C và 10atm. Sau khi PƯ tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% Hidro tham gia PƯ , áp suất trong bình sau PƯ là :
Đáp án: B Phương pháp giải: Lời giải chi tiết:
Câu hỏi 29 : Một bình kín có thể tích là 0,5 lit chứa 0,5mol H2 và 0,5 mol N2 , ở nhiệt độ to C . Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành . Hằng số cân bằng Kc của PƯ tổng hợp NH3 là
Đáp án: B Phương pháp giải: Lời giải chi tiết:
Câu hỏi 30 : Hỗn hợp A gồm 2 chất khí N2 và H2 có tỉ lệ mol 1 : 4. Nung A với xúc tác ta được hỗn hợp khí B, trong đó sản phẩm NH3 chiếm 20% theo thể tích (biết các khí đo cùng điều kiện). Hiệu suất phản ứng tổng hợp NH3 là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Giả sử có 1 mol N2 và 4 mol H2 N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3 Ban đầu: 1 4 (Ta thấy: 1/1 < 4/3 nên hiệu suất tính theo N2) Phản ứng: x → 3x → 2x Sau: 1-x 4-3x 2x → ∑nsau = 1 - x + 4 - 3x + 2x = 5 - 2x (mol) Trong hỗn hợp sau phản ứng, NH3 chiếm 20% theo thể tích nên ta có: \(\frac{{2{\text{x}}}}{{5 - 2{\text{x}}}}.100\% = 20\% \) → x = 5/12 → nN2 pư = x = 5/12 mol → \(\% H = \frac{{{n_{{N_2}pu}}}}{{{n_{{N_2}bd}}}}.100\% = \frac{{5/12}}{1}.100\% = 41,67\% \) Đáp án C Quảng cáo
|














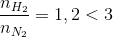 => tính hiệu suất theo H2
=> tính hiệu suất theo H2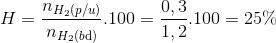
 2NH3 (k). Sau đó đưa bình về nhiệt độ ban đầu thì thấy áp suất trong bình bằng 5/6 áp suất trước phản ứng. Hiệu suất của phản ứng là
2NH3 (k). Sau đó đưa bình về nhiệt độ ban đầu thì thấy áp suất trong bình bằng 5/6 áp suất trước phản ứng. Hiệu suất của phản ứng là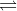 2NH3 (k)
2NH3 (k)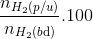 =
= 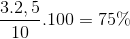
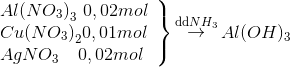
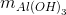
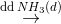 Fe(OH)3
Fe(OH)3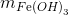
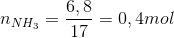
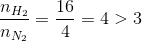
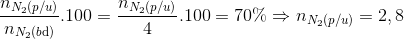 mol
mol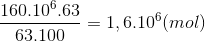
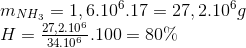
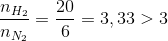 => Tính H theo N2
=> Tính H theo N2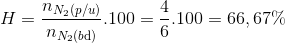
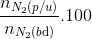 =
= 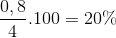
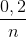 0,2
0,2