20 bài tập về nhôm và hợp chất của nhôm tác dụng với axit có tính OXH có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Hòa tan hoàn toàn m gam Al trong dung dịch HNO3 dư chỉ thu được 3,36 lít khí NO là sản phẩm khử duy nhất. Giá trị của m là
Đáp án: B Phương pháp giải: Bảo toàn electron Lời giải chi tiết: Bảo toàn e : 3nAl = 3nNO => nAl = nNO = 0,15 mol => mAl = 4,05g Đáp án B Câu hỏi 2 : Cho 4,725 gam bột Al vào dung dịch HNO3 loãng, dư thu được dung dịch X chứa 37,275 gam muối và V lít khí NO duy nhất (đktc). Giá trị của V là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: nAl = 0,175mol mAl(NO3)3 = 37,275g => không chứa muối amoni nNO = nAl = 0,175mol => V = 3,92 lít Đáp án A Câu hỏi 3 : Hòa tan hoàn toàn m gam Al trong dung dịch HNO3 loãng dùng dư thu được 3,36 lit khí NO (sản phẩm khử duy nhất của N+5) (dktc). Giá trị của m là :
Đáp án: B Phương pháp giải: Phương pháp : Bảo toàn e Lời giải chi tiết:
Bảo toàn e : 3nAl = 3nNO => nAl = nNO = 0,15 mol => m = 4,05g Đáp án B Câu hỏi 4 : Hòa tan hoàn toàn 14,58 gam Al trong dung dịch HNO3 loãng, đun nóng thì có 2,0 mol HNO3 đã phản ứng, đồng thời có V lít khí N2 thoát ra (đktc). Giá trị của V là
Đáp án: A Phương pháp giải: Lời giải chi tiết: nAl = 0,54 Gọi Đáp án A Câu hỏi 5 : Hòa tan hết 10,8 gam Al trong dung dịch HNO3 loãng không thấy khí thoát ra. Số mol HNO3 đã tham gia phản ứng là
Đáp án: A Phương pháp giải: - Bảo toàn electron. - Bảo toàn nguyên tố. Lời giải chi tiết: Do phản ứng không có khí thoát ra nên sản phẩm khử duy nhất là NH4NO3. \(\begin{gathered} Theo ĐLBT electron ta có: 1,2 = 8x → x = 0,15 (mol). Bảo toàn nguyên tố N ta có: \({n_{N{\text{[}}HN{O_3}{\text{]}}}} = {n_{N{\text{[}}Al{{(N{O_3})}_3}{\text{]}}}} + {n_{N{\text{[}}N{H_4}N{O_3}{\text{]}}}} \to {n_{HN{O_3}}} = 3{n_{Al{{(N{O_3})}_3}}} + 2{n_{N{H_4}N{O_3}}} = 3.0,4 + 2.0,15 = 1,5(mol).\) Câu hỏi 6 : Tiến hành nhiệt nhôm hoàn toàn m gam rắn X gồm Al và FeO (không có không khí) được hỗn hợp rắn Y. Cho Y tác dụng với dung dịch NaOH dư được 0,15 mol H2. Cũng lượng Y này nếu tác dụng với HNO3 loãng dư được 0,4 mol NO (sản phẩm khử duy nhất). Giá trị m là
Đáp án: A Phương pháp giải: + nAl=nH2/1,5 + BT e: 3nAl+3nFe=3nNO Lời giải chi tiết: Do Y tác dụng với NaOH sinh ra H2 => Al dư, FeO hết => sau phản ứng còn (Al dư: x mol; Fe: y mol; Al2O3). nAl dư = x = nH2/1,5 = 0,15/1,5 = 0,1 mol BT e: 3nAl+3nFe=3nNO => nFe = (0,4.3 – 3.0,1)/3 = 0,3 mol 2Al + 3FeO → Al2O3 + 3Fe 0,2 0,3 0,3 => nAl ban đầu = 0,1+0,2=0,3 mol m = mAl+mFeO=0,3.27+0,3.72=29,7 gam Đáp án A Câu hỏi 7 : Hoà tan hoàn toàn 4,5 gam bột nhôm vào dung dịch HNO3 dư thu được hỗn hợp khí X gồm NO và N2O (sản phẩm khử duy nhất) tỉ lệ số mol 1: 1 và dung dịch Y. Khối lượng muối nitrat tạo ra trong dung dịch Y là
Đáp án: C Phương pháp giải: Viết PTHH, tính toán theo PTHH 11Al +42 HNO3 → 11Al(NO3)3 + 3NO + 3N2O + 21H2O => m muối Lời giải chi tiết: 11Al +42 HNO3 → 11Al(NO3)3 + 3NO + 3N2O + 21H2O 1/6 1/6 => mmuối = 213.1/6=35,5 gam Đáp án C Câu hỏi 8 : Hoà tan hoàn toàn 35,1 gam hỗn hợp Al, Ag trong axit HNO3 loãng, dư. Sau phản ứng thu được 4,48 lit khí NO duy nhất (đktc). Khối lượng muối thu được sau phản ứng là:
Đáp án: D Phương pháp giải: \(\begin{gathered} mKl = 27x+108y =35,1 (1) ĐLBT số mol e => 3x+y=0,6(2) => x,y => mmuối = mKl + mNO3(muối) Lời giải chi tiết: \(\begin{gathered} mKl = 27x+108y =35,1 (1) ĐLBT số mol e => 3x+y=0,6(2) => x= 0,1, y=0,3 => mmuối = mKl + mNO3(muối) = 35,1+ 62.(3.0,1+0,3)=72,3 gam Đáp án D Câu hỏi 9 : Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 rất loãng thì thu được hỗn hợp gồm 0,015 mol N2O và 0,01 mol NO (phản ứng không tạo NH4NO3). Giá trị của m là
Đáp án: A Phương pháp giải: Gọi số mol của Al là x (mol) Bảo toàn electron: ne(Al nhường) = ne (N+5 nhận) => 3x = 3nNO + 8nN2O => x = ? (mol) => mAl = 27x = ? Lời giải chi tiết: Gọi số mol Al pư là x (mol) Quá trình oxi hóa Al Al → Al3+ +3e x → 3x (mol) Quá trình khử N+5 2N+5 +8e → N2O 0,12 ←0,015 (mol) N+5+ 3e → NO 0,03 ← 0,01 (mol) Bảo toàn electron ta có: ne(Al nhường) = ne (N+5 nhận) => 3x = 0,12 + 0,03 => x = 0,05 (mol) => mAl = 0,05.27 = 1,35 (g) Đáp án A Câu hỏi 10 : Cho phản ứng: Al + HNO3 → Al(NO3)3 + NO + N2O + H2O Tính tổng hệ số (tối giản) của phương trình sau khi cân bằng biết tỉ lệ thể tích của biết tỉ lệ thể tích N2O : NO = 1 : 3?
Đáp án: A Phương pháp giải: Ta cân bằng 2 phương trình nhỏ: 8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O (1) Al + 4HNO3 →Al(NO3)3 + NO + 2H2O (2) Do tỉ lệ thể tích N2O : NO = 1:3. Mà hệ số của N2O ở (1) là 3 do đó ta nhân cả 2 vế của (2) với 9 rồi cộng với (1) ta được phương trình cần tìm. Lời giải chi tiết: Ta cân bằng 2 phương trình nhỏ: 8Al + 30HNO3 →8Al(NO3)3 + 3N2O + 15H2O (1) Al +4 HNO3 →Al(NO3)3 + NO + 2H2O (2) Do tỉ lệ thể tích N2O : NO = 1:3. Mà hệ số của N2O ở (1) là 3 do đó ta nhân cả 2 vế của (2) với 9 rồi cộng với (1) 8Al + 30HNO3 →8Al(NO3)3 + 3N2O + 15H2O (1) 9x (Al + 4 HNO3 →Al(NO3)3 + NO + 2H2O) (2) Cộng lại được: 17Al + 66HNO3 →17Al(NO3)3 + 3N2O + 9NO + 33H2O Vậy tổng hệ số tối giản của các chất trong phương trình là: 17 + 66 + 17 + 3 + 9 + 33 = 145 Đáp án A Câu hỏi 11 : Cho m gam nhôm phản ứng hoàn toàn với dung dịch HNO3 loãng (dư), thu được 4,48 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của m là
Đáp án: A Phương pháp giải: BT e: 3nAl = 3nNO => nAl = nNO => mAl = ? Lời giải chi tiết: BT e: 3nAl = 3nNO => nAl = nNO = 0,2 mol => mAl = 0,2.27 = 5,4 gam Đáp án A Câu hỏi 12 : Hòa tan m gam nhôm vào dung dịch HNO3 loãng, thu được hỗn hợp khí gồm 0,15 mol N2O và 0,1 mol NO (không tạo ra NH4+). Giá trị của m là:
Đáp án: D Phương pháp giải: Bài toán kim loại tan hết trong HNO3 => Công thức giải nhanh: - ne = ne KL = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 - nHNO3 = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 Lời giải chi tiết: ne = 3nAl = 3nNO + 8nN2O = 3.0,1 + 8.0,15 = 1,5 mol => nAl = 0,5 mol => m = mAl = 27.0,5 = 13,5g Đáp án D Câu hỏi 13 : Cho 10,8 gam Al phản ứng hoàn toàn với dung dịch HNO3 loãng (dư), thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V là
Đáp án: B Phương pháp giải: BT electron: nNO = nAl = ? Lời giải chi tiết: nAl = 10,8 : 27 = 0,4 (mol) Al → Al3+ + 3e 0,4 → 1,2 (mol) ne nhường = ne nhận = 1,2 (mol) N+5 + 3e → NO 1,2 → 0,4 (mol) => VNO = 0,4.22,4 = 8,96 (l) Đáp án B Câu hỏi 14 : Hòa tan hoàn toàn m gam hỗn hợp X gồm Al và Mg trong 500 ml dung dịch HNO3 1M thu được dung dịch Y và khí NO. Cho từ từ dung dịch NaOH vào dung dịch Y, lượng kết tủa tạo thành được biểu diễn theo đồ thị sau:
Giá trị của m là
Đáp án: C Phương pháp giải: Khi nOH- = 0,1 mol thì kết tủa mới xuất hiện nên nH+ dư = 0,1 mol → nH+ pứ = 0,4 mol → nNO Khi nOH- = 0,45 mol thì 4,08 gam kết tủa thu được gồm Mg(OH)2 và Al(OH)3 Lập hệ phương trình theo định luật bảo toàn electron và khối lượng kết tủa để tìm số mol Mg và Al. Từ đó tính được m. Lời giải chi tiết: Khi nOH- = 0,1 mol thì kết tủa mới xuất hiện nên nH+ dư = 0,1 mol → nH+ pứ = 0,4 mol → nNO = 0,1 mol Đặt a, b là số mol Al và Mg Áp dụng bảo toàn electron ta có : 3.nAl + 2.nMg = 3.nNO suy ra 3a + 2b = 3.0,1 (1) Khi nOH- = 0,45 mol thì kết tủa thu được gồm Mg(OH)2 b mol; Al(OH)3 (4,08-58b)/78 mol Suy ra 0,45 = 0,1 + 2b + 4a - (4,08-58b)/78 (2) Giải hệ (1) và (2) ta có a = 0,08 và b = 0,03 Suy ra m = 2,88 gam Đáp án C Câu hỏi 15 : Tiến hành phản ứng nhiệt nhôm 10 gam hỗn hợp X gồm Al và Fe2O3 (trong điều kiện không có không khí) thu được hỗn hợp Y. Cho Y tác dụng với dung dịch HNO3 loãng dư thu được 2,24 lít khí NO (sản phẩm khử duy nhất ở đkc). Phần trăm khối lượng của Fe2O3 trong X là
Đáp án: A Phương pháp giải: Xét cả quá trình thì xem như Fe không trao đổi electron, bởi vì chất ban đầu là Fe2O3, chất cuối cùng là Fe(NO3)3 (Fe đều có số oxi hoá +3) Áp dụng định luật bảo toàn electron: trong đó Al cho e còn N+5 nhận e ta tìm được số mol của Al. Từ đó tính được mFe2O3 và %mFe2O3. Lời giải chi tiết: Xét cả quá trình thì xem như Fe không trao đổi electron, bởi vì chất ban đầu là Fe2O3, chất cuối cùng là Fe(NO3)3 (Fe đều có số oxi hoá +3) Quá trình nhường và nhận electron: Al → Al3++ 3e N+5 + 3e →N+2 Áp dụng định luật bảo toàn electron: 3nAl = 3nNO => nAl = nNO = 2,24/22,4 = 0,1 (mol) mFe2O3 = 10 - 27.0,1 = 7,3 (g) => %mFe2O3 = (7,3/10).100% = 73% Đáp án A Câu hỏi 16 : Hòa tan hoàn toàn 24,3 gam Al vào dung dịch HNO3 loãng dư thu được V lít hỗn hợp khí (đktc) gồm NO và N2O có tỉ khối so với H2 là 20,25 ( không còn sản phẩm khử khác). Giá trị của V là
Đáp án: D Phương pháp giải: Bảo toàn e Mhỗn hợp khí = \(\frac{{\sum {m_ \uparrow }}}{{\sum {n_ \uparrow }}}\) Lời giải chi tiết: Bảo toàn e có 3nNO + 8nN2O = 3nAl = 2,7 ( mol) Lại có \({M_{hh{\rm{ }}kh\'i }} = \frac{{30{n_{NO}} + {\rm{ }}44{n_{{N_2}O}}}}{{{n_{NO}} + {\rm{ }}{n_{{N_2}O}}}} = 20,25.2\) => nNO = 0,1 mol và nN2O = 0,3 mol => V = 8,96 l Đáp án D Câu hỏi 17 : Hoà tan hoàn toàn 8,1 gam Al trong dung dịch HNO3 loãng, dư thu được dung dịch X chứa m gam muối và 1,344 lít khí N2 (đktc). Giá trị của m là
Đáp án: B Phương pháp giải: Bảo toàn electron Lời giải chi tiết: nAl = 0,3 mol và nN2 = 0,06 mol Ta có ne nhường = 3nAl = 3.0,3 = 0,9 (mol e) > ne nhận = 10nN2 = 0,6 (mol e) ⟹ có tạo NH4+ Bảo toàn e có: \({n_{NH4}}^ + = \frac{{3{n_{Al}} - 10{n_{{N_2}}}}}{8} = \frac{{3.0,3 - 10.0,06}}{8} = 0,0375\left( {mol} \right)\) ⟹ muối có 0,3 mol Al(NO3)3 và 0,0375 mol NH4NO3 ⟹ mmuối = 0,3.213 + 0,0375.80 = 66,9 gam Đáp án B Câu hỏi 18 : Cho m gam Al tác dụng hết với dung dịch HNO3 rất loãng chỉ thu được hỗn hợp khí gồm 0,015 mol N2O và 0,01 mol NO. Giá trị của m là
Đáp án: B Phương pháp giải: Áp dụng phương pháp bảo toàn electron, tìm ra số mol của Al. Từ đó tính được giá trị của m. Lời giải chi tiết: Các quá trình cho - nhận e: \(\mathop {Al}\limits^0 \to \mathop {Al}\limits^{ + 3} + 3{\rm{e}}\) \(2\mathop N\limits^{ + 5} + 8e \to 2\mathop N\limits^{ + 1} ({N_2}O)\) \(\mathop N\limits^{ + 5} + 3{\rm{e}} \to \mathop N\limits^{ + 2} (NO)\) Áp dụng phương pháp bảo toàn electron: \(3{n_{Al}} = 8{n_{{N_2}O}} + 3{n_{NO}}\) \( \to {n_{Al}} = \dfrac{{8{n_{{N_2}O}} + 3{n_{NO}}}}{3} = \dfrac{{8.0,015 + 3.0,01}}{3} = 0,05mol\) \( \to m = {m_{Al}} = 0,05.27 = 1,35gam\) Đáp án B Câu hỏi 19 : Cho hỗn hợp A gồm m gam các chất Al2O3 và Al vào 56,5 gam dung dịch H2SO4 98%, thu được 0,336 lít khí SO2 thoát ra (đktc) cùng dung dịch B và a gam hỗn hợp rắn D. Lọc lấy D và chia làm 2 phần bằng nhau: + Phần 1: Cho tác dụng với dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch X chỉ chứa muối sunfat cùng 1,4 lít hỗn hợp khí không màu có khối lượng là 2,05 gam, có khí hóa nâu trong không khí. Dẫn từ từ đến dư dung dịch NaOH 1M vào X, thấy lượng NaOH dùng hết tối đa là 130 ml. + Phần 2: Nung trong không khí đến khối lượng không đổi thu được rắn Y có khối lượng giảm 1,36 gam so với lượng rắn đem đốt. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với:
Đáp án: D Phương pháp giải: Bảo toàn e, Bảo toàn điện tích Lời giải chi tiết: nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol +) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O => nNO = 0,05 ; nN2O = 0,0125 mol Muối thu được là muối sunfat => có S trog D Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol) Giả sử phản ứng D + HNO3 tạo t mol NH4+ Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4 => 3x + 6z = 2y + 0,15 + 0,1 + 8t (1) Muối sunfat thu được có : NH4+ ; Al3+ ; SO42- Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4 => t + 3x = 2z (2) Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì : Al3+ + 4OH- -> AlO2- + 2H2O NH4+ + OH- -> NH3 + H2O => nNaOH = 4x + t = 0,13 (3) +) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑ => mgiảm = mS – mO thêm => 1,36 = 32z – 16.(1,5x – y) (4) Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS) => nAl2O3 = 0,045 mol Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al => m = 12,84g Đáp án D Câu hỏi 20 : Lấy 2 mẫu Al và Mg đều có khối lượng a gam cho tác dụng với dung dịch HNO3 dư, để phản ứng xảy ra hoàn toàn. - Với mẫu Al: thu được 1,344 lít khí một chất khí X (đktc) và dung dịch chứa 52,32 gam muối. - Với mẫu Mg: thu được 0,672 lít một chất khí X (đktc) và dung dịch chứa 42,36 gam muối. Giá trị của a gần nhất với giá trị nào sau đây ?
Đáp án: C Phương pháp giải: Lời giải chi tiết: nAl: x → nMg: 1,125x; số e trao đổi của X là y Muối Ta có hệ → m = 6,48 Đáp án C Quảng cáo
|














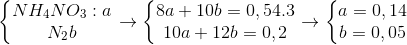 → V = 1,12 lít
→ V = 1,12 lít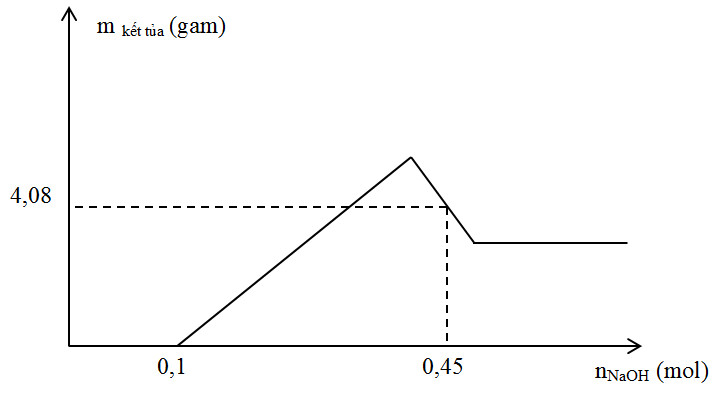
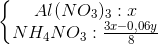 và
và